子宮頸がんに対する免疫細胞療法の実現に向けて
2020-08-03 順天堂大学,日本医療研究開発機構
概要
順天堂大学大学院医学研究科血液内科学の安藤美樹准教授、安藤純先任准教授、小松則夫教授、産婦人科学講座の増田彩子助教、寺尾泰久教授、ときわバイオ(株)取締役(産業技術総合研究所・名誉リサーチャー)の中西真人先生、東京大学医科学研究所幹細胞治療部門の中内啓光特任教授らの共同研究グループは、従来の方法より安全な方法で子宮頸がんに対して腫瘍増殖抑制効果があるiPS細胞由来のヒトパピローマウイルス(HPV)(注1)抗原特異的キラーT細胞(注2)の作製に成功しました。そして、このiPS細胞由来のキラーT細胞が、末梢血由来のキラーT細胞と比較して、子宮頸がんの増殖を生体内で強力に抑制し、生存期間を延長させる効果があることをマウスを使って確認しました。この成果は、子宮頸がんの増殖を抑制するiPS細胞由来T細胞の安定供給を可能とし、免疫細胞を用いた新規治療法の開発に大きく道を開く可能性を示しました。本研究は米国遺伝子細胞治療学会雑誌であるMolecular Therapyに先行公開(2020年7月8日付)されました。
本研究成果のポイント
- キラーT細胞からiPS細胞を樹立する際に、遺伝子を傷つけるリスクのあるSV40 large T抗原を使用することなく安全にiPS細胞を作製しました。
- マウスによる実験でiPS細胞由来HPV抗原特異的キラーT細胞(注3)は、子宮頸がんの増殖を強力に抑制し、末梢血キラーT細胞と比較して有意な生存期間延長効果を示すことが分かりました。
- 子宮頸がんに抗腫瘍効果を持つ免疫キラーT細胞をiPS細胞から何度でも十分量作ることが可能となり、難治性子宮頸がんに対する新たな治療として大いに期待できます。
背景
子宮頸がんの多くはHPV感染が原因で発症します。HPVワクチンはHPV感染予防には有効ですが、子宮頸がんを発症した場合は効果がありません。現在、日本ではワクチン接種率は1%以下まで低下しています。そのため、20代から30代の子育て世代の罹患率が上昇しており、子宮頸がんはマザーキラーと呼ばれ深刻な問題となっています。子宮頸がんは再発進行すると化学療法、放射線療法が効きにくく、新たな治療法の開発が望まれていました。
研究グループは2013年に末梢血由来のiPS細胞から、機能的に若返ったウイルス抗原特異的キラーT細胞を作製することに成功し、難治性腫瘍に対する新規治療開発を目指して研究を続けてきました。本研究は研究グループが開発を進めてきた「iPS細胞由来ウイルス抗原特異的キラーT細胞」が、子宮頸がんの新規治療法となりうるかを明らかにする目的で行われました。
内容
本研究グループは、子宮頸がん患者と健常人ドナーよりiPS細胞由来HPV抗原特異的キラーT細胞を作製し、子宮頸がんに対する抗腫瘍効果を確かめました。
まず、子宮頸がん患者の末梢血よりHPV特異的キラーT細胞の作製を試みましたが、抗がん剤や放射線、ステロイドの影響でT細胞は疲弊により減少していたため、作製できませんでした。そこで、健常人ドナーの末梢血より作製を試みたところ、非常に少ない頻度ですがHPV特異的キラーT細胞を作製できました。次に、HPV抗原特異的キラーT細胞からiPS細胞の作製を試みました。しかしながら、山中4因子(注4)の遺伝子を導入するだけではキラーT細胞からiPS細胞を作製できませんでした。また、従来の方法では、ウイルス成分のSV40 large T抗原を同時に遺伝子導入する必要がありますが、これは遺伝子を傷つけるリスクを伴います。そこで本研究では、効率改善と安全化を図る試みとして、SV40 large T抗原を使用せず他の2つの因子(LIN28とNANOG)を追加しました。その結果、健常人ドナーの末梢血を使用して、HPV特異的キラーT細胞からiPS細胞を作製することに成功しました。この6因子を導入したiPS細胞から再びT細胞へ分化誘導して若返りキラーT細胞を作製しました。このiPS細胞由来若返りHPV抗原特異的キラーT細胞は、子宮頸がん細胞株に対し持続的で強力な細胞傷害活性を示しました。(図1)
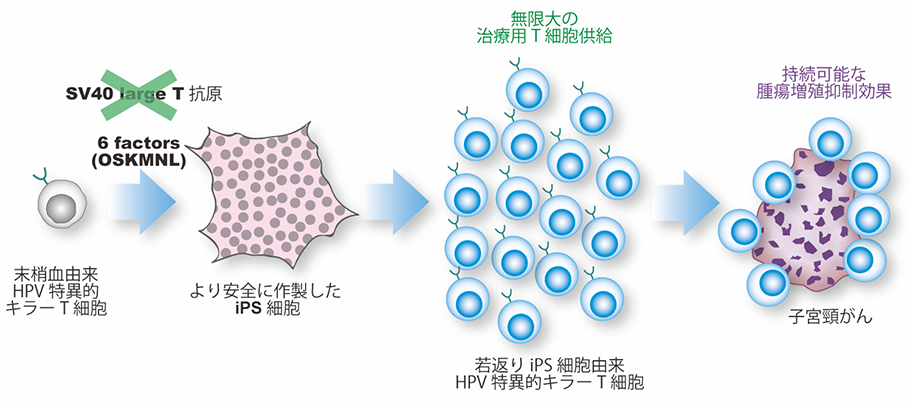 図1 本研究が提唱する免疫細胞療法の概念図末梢血由来のHPV抗原特異的キラーT細胞からiPS細胞を作製し、そのiPS細胞から若返りHPV抗原特異的キラーT細胞を作製し、子宮頸がんに対する免疫細胞療法として用いる。iPS細胞作製に用いた6factors(OSKMNL)は、山中4因子(Oct3/4、Sox2、Klf4、c-Myc)とLIN28とNANOGの6つの因子の頭文字を並べたもの。
図1 本研究が提唱する免疫細胞療法の概念図末梢血由来のHPV抗原特異的キラーT細胞からiPS細胞を作製し、そのiPS細胞から若返りHPV抗原特異的キラーT細胞を作製し、子宮頸がんに対する免疫細胞療法として用いる。iPS細胞作製に用いた6factors(OSKMNL)は、山中4因子(Oct3/4、Sox2、Klf4、c-Myc)とLIN28とNANOGの6つの因子の頭文字を並べたもの。
次に、iPS細胞由来HPV抗原特異的キラーT細胞が生体内でどれぐらいの抗腫瘍効果を発揮するか調べました。免疫不全マウスに子宮頸がん細胞株を腹腔内注射し、3日後に「末梢血由来HPV抗原特異的キラーT細胞」もしくは「iPS細胞由来HPV抗原特異的キラーT細胞」を注射しました。その結果、3週間後の腫瘍の量の測定では「iPS細胞由来HPV抗原特異的キラーT細胞」で治療したマウスグループでは有意な腫瘍抑制効果を認めました。さらに、より長期における生存率の比較においても、「iPS細胞由来HPV抗原特異的キラーT細胞」は「末梢血由来HPV抗原特異的キラーT細胞」に比較して有意な生存期間延長効果を認めました。(図2)
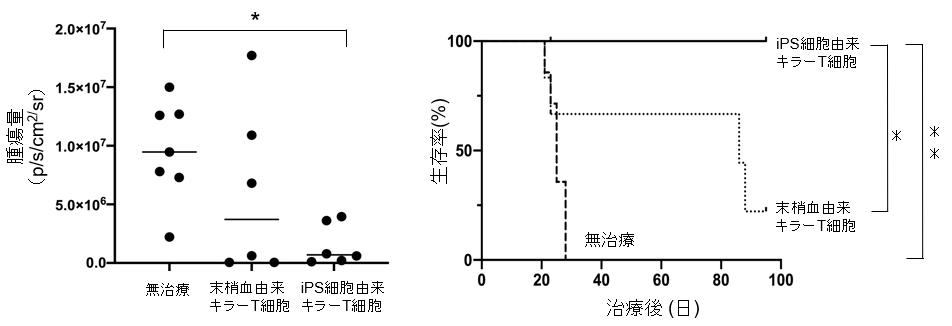 図2 末梢血由来キラーT細胞とiPS細胞由来キラーT細胞との比較(左)初回治療3週間後の腫瘍量:「iPS細胞由来HPV抗原特異的キラーT細胞」により初回治療3週間後に子宮頸がんの有意な腫瘍抑制効果を示した。
図2 末梢血由来キラーT細胞とiPS細胞由来キラーT細胞との比較(左)初回治療3週間後の腫瘍量:「iPS細胞由来HPV抗原特異的キラーT細胞」により初回治療3週間後に子宮頸がんの有意な腫瘍抑制効果を示した。
(右)マウス生存率:「末梢血由来HPV抗原特異的キラーT細胞」はある程度がんの増殖を抑制したが、生存期間延長効果は認められなかった。一方で機能的に若返った「iPS細胞由来HPV抗原特異的キラーT細胞」は明らかな生存期間延長効果を示した。
以上の結果より、「iPS細胞由来HPV抗原特異的キラーT細胞」は試験管内だけでなく、マウス生体内でも子宮頸がんに抗腫瘍効果を持つことがわかりました。つまり、末梢血由来のHPV抗原特異的キラーT細胞からiPS細胞を作製し、そのiPS細胞から作製した増殖力の強い元気なHPV抗原特異的キラーT細胞を作製し、子宮頸がんに対する免疫細胞療法として用いることで、マザーキラーと呼ばれる難治性の子宮頸がんの新たな治療法となる可能性を示すことができました。
今後の展開
今回の研究により、臨床現場での利用を目指してより安全な方法で作製したiPS細胞から、子宮頸がんに効果のある若返りキラーT細胞を無限に作製することが可能となりました。このiPS細胞由来HPV抗原特異的キラーT細胞を用いた治療は難治性子宮頸がんの強力な新規治療法となる可能性があります。キラーT細胞を用いた治療では、免疫拒絶が起きないようにドナーと患者のHLA(注5)遺伝子型を一致させる必要があることから、今後はHLA遺伝子をゲノム編集することで免疫拒絶を回避し、一つのiPS細胞から多くの患者さんに適用できる治療開発に発展させるべく準備を進めています。今回の成果により「子宮頸がんに対する新規免疫細胞療法」の臨床研究の実現に向けた加速が期待されます。
用語解説
- (注1)キラーT細胞(抗原特異的細胞傷害性T細胞)
- 免疫細胞であるTリンパ球の中でも、ウイルス抗原や腫瘍抗原を認識し、異常細胞を攻撃するリンパ球。患者のウイルス特異的細胞傷害性T細胞を体外で増幅し、再び患者体内に戻す免疫T細胞療法は、重症ウイルス感染症やウイルス関連腫瘍に有効である。
- (注2)ヒトパピローマウイルス(HPV)
- 子宮頸がんの原因ウイルス。HPV感染後、多くは自然にウイルスが排除されるが排除されなかった場合、前がん状態を経て子宮頸がんを発症する。
- (注3)iPS細胞由来HPV抗原特異的キラーT細胞
- iPS細胞から作製したHPV抗原に特異的に反応するキラーT細胞。iPS細胞技術は細胞の若返り法の一つと言える。この手法を利用してHPVによって生じた腫瘍と反応する末梢血中のHPV抗原特異性をもつ免疫キラーT細胞からiPS細胞を作製し、再びT細胞に分化させることにより、腫瘍を攻撃する若いキラーT細胞を無限に供給することが可能になる。
- (注4)山中4因子
- 京都大学の山中教授らが報告した4つの遺伝子(Oct3/4、Sox2、Klf4、c-Myc)。山中教授らはこれらの遺伝子を初期化因子として強制発現させることで線維芽細胞からiPS細胞を誘導できることを2006年に報告した。
- (注5)HLA(Human Leukocyte Antigen)
- ヒト白血球抗原。白血球にはABO血液型よりも複雑なヒト白血球抗原(HLA:Human Leukocyte Antigen)と言われる型があり、造血幹細胞移植や免疫細胞療法の際の免疫反応に重要な役割を果たす。
原著論文
本研究は米国遺伝子細胞治療学会雑誌であるMolecular Therapy 誌に2020年7月8日付けで先行公開されました。
- 論文タイトル:
- ”Sustainable tumor suppressive effect of iPSC-derived rejuvenated T cells targeting cervical cancers”
- 論文タイトル(日本語訳):
- 「子宮頸がんに対するiPSC由来若返りキラーT細胞の持続可能な腫瘍抑制効果」
- 著者:
- Tadahiro Honda1, Miki Ando1,2*, Jun Ando1, Midori Ishii1, Yumi Sakiyama1,2, Kazuo Ohara1, Tokuko Toyota1, Manami Ohtaka3, Ayako Masuda4, Yasuhisa Terao4, Mahito Nakanishi3,5, Hiromitsu Nakauchi2,6,7*, and Norio Komatsu1,7
- 著者(日本語表記):
- 本田匡宏1、安藤美樹1、2、安藤純1、石井翠1 、崎山祐未1、2、小原和男1 、豊田釈子1 、大高真奈美3、増田彩子4、中西真人3、5、寺尾泰久4、中内啓光2、6、小松則夫1
- 所属:
- 1順天堂大学医学部血液学講座、2東京大学医科学研究所幹細胞治療部門、3ときわバイオ株式会社、4順天堂大学医学部産婦人科学講座、5産業技術総合研究所、6スタンフォード大学医学部幹細胞生物学・再生医療研究所
本研究はAMED「再生医療実現拠点ネットワークプログラム(技術開発個別課題)」JP19bm0404032、および 「再生医療・遺伝子治療の産業化に向けた基盤開発事業(再生医療シーズ開発加速支援)」JP19be0404011およびJSPS科研費JP18K07273の助成を受け実施されました。また、本研究に協力頂きました患者さまのご厚意に深謝いたします。
お問い合わせ先
研究内容に関するお問い合せ先
順天堂大学医学部 血液学講座
准教授 安藤美樹(あんどうみき)
取材に関するお問い合せ先
順天堂大学総務局 総務部文書・広報課
担当:長嶋文乃(ながしまあやの)
AMED事業に関するお問い合せ先
国立研究開発法人日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部
再生医療研究開発課