2022-04-21 慶應義塾大学,日本医療研究開発機構
慶應義塾大学医学部坂口光洋記念講座(オルガノイド医学)の佐藤俊朗教授らの研究グループは、患者由来オルガノイド (注1)を用いた新規薬剤スクリーニングシステム(注2)を開発しました。
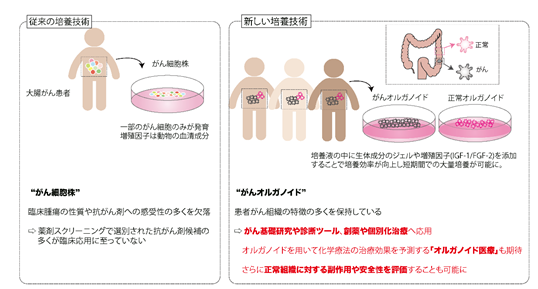
本研究グループ.は、従来のオルガノイド培養技術に改変を加えることで正常大腸オルガノイドの短期間での大量培養を実現し、患者由来大腸がんオルガノイドの大規模薬剤スクリーニングに正常組織を組み込むことに成功しました。この創薬プラットフォームを用いることで、個々のがんに効果を示す抗がん剤だけでなく、正常組織に対する副作用が少なく、がんに対して特異的に効果を示すような薬剤を探索することが可能になりました。
佐藤教授らは患者組織を「ミニ臓器」として培養皿上で永続的に培養するオルガノイド技術を開発し、これまで大腸がん、胃がんをはじめとした多くのがんのオルガノイドバンクを構築してきました。従来のがん創薬で主に用いられるがん細胞株(注3)には、臨床腫瘍の性質や薬剤への反応を必ずしも反映していないという難点がありましたが、患者由来がんオルガノイドは元の患者がん組織の特徴の多くを培養中も保持しており、近年では薬剤試験に応用され始めています。しかし、従来のオルガノイド培養技術では正常組織を大量かつ効率的に培養することができなかったため、正常組織オルガノイドを用いた薬剤スクリーニングは不可能でした。
今回、佐藤教授らは培養方法を改良することで、正常大腸オルガノイドの培養効率を飛躍的に改善することに成功し、正常組織、がんを問わずに薬剤スクリーニングを可能にする創薬プラットフォームを開発しました。このプラットフォームを用い、正常大腸オルガノイド6ラインおよび患者由来がんオルガノイド20ラインに対して、56薬剤の網羅的スクリーニングを実施、高精度な治療効果データを取得しました。
その結果、正常大腸組織への影響は少なく、がんに対して特異的に効果を示す薬剤や、大腸がんの一定のタイプに強い効果を発揮する抗がん剤を同定しました。この技術は大腸のみならず他の臓器にも幅広く応用可能であり、今後の新規創薬の発展や個別化治療の推進に貢献することが期待されます。
本研究成果は、2022年3月10日(英国時間PM16:00)に国際科学誌『Nature Chemical Biology』オンライン版に掲載されました。
研究の背景
多数の治療薬候補の効果を網羅的に探索する薬剤スクリーニングは、がん創薬における基盤技術です。従来のがん創薬では患者がん組織から樹立したがん細胞株を用いて一次スクリーニングを行い、動物モデルを用いて、安全性や副作用を確認するという手法をとってきました。
がん細胞株には、実際の臨床腫瘍の性質や抗がん剤への感受性の多くを欠落しているという問題点があります。加えて、がんはたとえ同じ臓器に発生しても、患者ごとに異なる遺伝学的、生物学的な特徴を示しますが、がん細胞株ではこの多様性を網羅できません。結果として、がん細胞株を用いて選別された抗がん剤候補の多くが臨床応用に至っておらず、この創薬研究における「死の谷」が大きな医学的および社会的問題となっています。
佐藤教授らは、組織幹細胞を永続的に三次元培養するオルガノイド技術を世界に先駆けて開発し(Sato T, et al. Nature 2009, Sato T, et al., Gastroenterology 2011.)、さまざまな患者由来がん組織に応用することで、大腸がん、膵臓がん、胃がんなどのがんオルガノイドバイオバンクを構築してきました(Fujii M, et al. Cell Stem Cell, 2016, Seino T, et al. Cell Stem Cell 2018, Nanki K, et al. Cell 2018)。
患者由来がんオルガノイドは患者がん組織の特徴を多く保持しており、「生きた」がん組織からなるオルガノイドバイオバンクは次世代のがん研究リソースとして、がん基礎研究や診断ツール、創薬や個別化治療へ応用されようとしています。最近の海外の臨床試験では、患者由来がんオルガノイドの薬剤感受性と臨床腫瘍の抗がん剤への反応が相関することが示され、オルガノイドを用いて化学療法の治療効果を予測する「オルガノイド医療」の実装も期待されています。しかしながら、オルガノイドを用いたこれまでの薬剤スクリーニングは、がん細胞株を用いた薬剤試験と同様に抗がん作用のみに焦点を当てており、正常組織に対する副作用や安全性を評価することは困難でした。また、オルガノイド技術を用いることで正常組織の培養が可能ですが、従来の培養技術では正常組織オルガノイドを安定的に大量培養することが難しく、薬剤スクリーニングに導入することができていませんでした。
研究の概要
ヒト大腸オルガノイドを用いた大規模薬剤スクリーニングシステムの確立
大規模薬剤スクリーニングでは、多数の候補薬剤をさまざまな濃度で検討するため、事前に細胞を効率よく大量に培養する必要があります。また、ばらつきが少なく信頼性が高いデータを取得するためには、細胞あるいはオルガノイドが均等に育たなくてはなりません。従来のヒト大腸オルガノイド培養法は、効率が低かったためこれらの条件を満たすことができず、正常ヒト大腸オルガノイドを大規模薬剤スクリーニングに用いることは困難でした。近年、佐藤教授らは、IGF-1とFGF-2という増殖因子を培地に添加することで、ヒト腸管オルガノイドの培養効率が飛躍的に向上することを報告しました (Fujii et al., Cell Stem Cell 2018)。
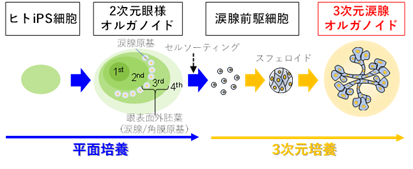
本研究では、この培養条件を応用した浮遊培養技術を用いることで、内視鏡下生検検体に相当する少量の組織量から、正常ヒト大腸及び大腸がん細胞を約1~2ヶ月の間に1,000万細胞まで安定的に増やすことが可能になりました(図1)。このシステムを利用して正常ヒト大腸オルガノイド6株とヒト大腸がんオルガノイド20株に対して56種類の薬剤を用いてスクリーニングを行い、高精度な薬剤感受性データを取得しました。
【図1】患者由来オルガノイドを用いた新規薬剤スクリーニングシステムの開発IGF-1とFGF-2という2つの増殖因子を加えることで、正常及びがんヒト腸管上皮オルガノイドの安定かつ効率的な大量培養が可能になった。
大腸がんに対してのみ効果を示す薬剤の探索
正常大腸オルガノイドと大腸がんオルガノイドの治療応答性を直接比較することで、正常細胞を傷害せず大腸がんに対してのみ効果を示す薬剤を探索しました。その結果、ブロモドメインタンパク質阻害剤である(+)-JQ1が、正常大腸オルガノイドに比べて大腸がんオルガノイドに対して強い効果を示すことを明らかにしました(図2)。また、トランスクリプトミクス分析により、(+)-JQ1は結腸直腸がんで異常に活性化される遺伝子発現を抑制することが明らかになりました。
ブロモドメインタンパク質阻害剤はスーパーエンハンサーを標的とすることが知られているため、本研究結果は、(+)-JQ1が発がん性依存性プログラムを抑制することによってがんオルガノイドの増殖を抑制したことを示唆しました。 本研究結果はまた、潜在的な治療法の発見のために正常細胞を使用することの有用性も示しました。
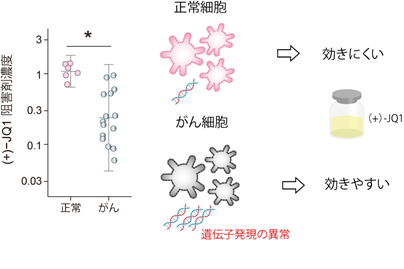
【図2】BETブロモドメインタンパク質阻害剤の効果
プロモドメインタンパク質阻害剤である(+)-JQ1は正常大腸オルガノイドと比較し大腸がんオルガノイドに強い効果を示す。
エピゲノム異常による治療応答性予測
がんでは多数の遺伝子異常が見られますが、同時に、遺伝子配列には異常をきたさない異常(エピゲノム異常)があることも知られています。大腸がんでは、約20%の症例において、CpG island methylator phenotype (CIMP)というエピゲノム異常が見られます。薬物反応の統合分析により、パクリタキセル感受性とCpGアイランドメチレーター表現型(CIMP)の間に有意な正の相関が検出されました。これは、BRAF変異とマイクロサテライト不安定性を伴う結腸直腸がんでよく見られます。 CIMP陽性がんの異種移植片は、一貫してパクリタキセルに対する感受性を示しました。 CIMP陽性の結腸直腸がんにおけるパクリタキセル感受性の根底にある分子メカニズムとして、紡錘体チェックポイント関連遺伝子であるCHFRの不活性化を特定しました。 CRISPR / Cas9を介したノックアウトとオルガノイドにおけるCHFRの過剰発現により、CHFRの欠陥とパクリタキセルの感受性との因果関係を検証しました。さらに、CIMP陽性がんのパクリタキセル感受性は、異種移植片を使用して試験管内で確認されました。本研究の結果は、乳がん、胃がん、卵巣がんなどのさまざまながんで臨床的に用いられる抗がん剤パクリタキセルの、CIMP 陽性結腸直腸がん治療への転用の可能性を示唆しています。
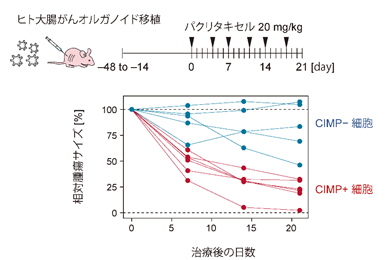
【図3】CIMP陽性がんオルガノイドのパクリタキセル感受性
CIMP陰性がんと比較してCIMP陽性がんはパクリタキセルに対する感受性が高い。
今後の展開
本研究では、正常細胞を含む幅広い患者由来オルガノイドに適用可能なハイスループット薬剤スクリーニングシステムを確立し、大腸がんにおける分子生物学的異常と複数の薬剤の治療応答性を結びつけることに成功しました。本研究により、患者由来オルガノイドを用いたハイスループットスクリーニングのバイオマーカー解析における応用可能性が実証されました。本研究で開発した技術は、バイオマーカー研究及び新規創薬研究に有用であり、基礎研究及び創薬研究での幅広い応用が期待されます。
特記事項
本研究は日本医療研究開発機構 次世代がん医療創生研究事業「がん多階層フェノタイプの理解に基づいた先端的創薬システムの開発」、JSPS科研費JP17H06176・JP18J21346・JP17K09395、国立研究開発法人科学技術振興機構(JST) ムーンショット型研究開発事業「生体内ネットワークの理解による難治性がん克服に向けた挑戦」の支援によって行われました。
論文情報
- 英文タイトル
- Organoid screening reveals epigenetic vulnerabilities in human colorectal cancer
- 著者名
- Kohta Toshimitsu, Ai Takano, Masayuki Fujii, Kazuhiro Togasaki, Mami Matano, Sirirat Takahashi, Takanori Kanai, Toshiro Sato
- タイトル和訳
- オルガノイドスクリーニングにより明らかとなったヒト大腸がんのエピジェネティックな脆弱性
- 著者名
- 利光考太、高野愛、藤井正幸、戸ヶ崎和博、股野麻未、シリラット高橋、金井隆典、佐藤俊朗
- 掲載紙
- Nature Chemical Biology(オンライン版)
- DOI
- 10.1038/s41589-022-00984-x
用語解説
- (注1)オルガノイド
- 従来の細胞培養技術では多くの細胞はシート状に培養されている。オルガノイドは細胞増殖の足場となるジェルと増殖因子と呼ばれる細胞の増殖を促す分子を含む培養液により、立体的な細胞塊を形成するように育てられた培養細胞を指す。1つの幹細胞から生体内の組織に似た構造を培養皿の中で作り出すことが可能であり、胃、小腸、大腸、膵臓、肝臓など、さまざまな組織の正常細胞およびがん幹細胞を無限に増やすことが可能である。
- (注2)薬剤スクリーニングシステム
- 現在医療で使用されている、または研究段階にある薬剤からがんを縮小する効果のある薬剤を選び出す手法。
- (注3)がん細胞株
- 臨床検体から単一のがん細胞を単離して株化したもの。株化したがん細胞は、培養・維持が簡便で安価で実験に用いやすく、単一の遺伝背景に由来するため、実験結果の再現が得やすく、遺伝子操作なども簡便に行える利点がある。ほぼ全てのがん種でさまざまな人種に由来するがん細胞株が樹立され、研究者間で譲渡されて使用されている。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部坂口光洋記念講座 (オルガノイド医学)
教授 佐藤 俊朗(さとう としろう)
本リリースの配信元
慶應義塾大学信濃町キャンパス総務課:山崎・飯塚・奈良
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
次世代がん医療創生研究事業(P-CREATE)