2022-05-06 理化学研究所
理化学研究所(理研)生命医科学研究センター細胞機能変換技術研究チームの鈴木貴紘上級研究員、鈴木治和チームリーダーらの研究チームは、ヒトiPS細胞[1]から肝細胞に分化する過程のDNAメチル化[2]変化を網羅的に解析し、転写因子[3]GATA6が肝細胞分化初期にDNA脱メチル化[2]を引き起こすことを発見しました。
本研究成果は、創薬研究や肝細胞移植への応用に貢献すると期待できます。
今回、研究チームは、ヒトiPS細胞から肝細胞を誘導し、その分化過程でのDNAメチル化情報を網羅的かつ経時的に取得しました。取得した経時的DNAメチル化情報を基に、研究チームが以前開発したDNAメチル化制御転写因子同定法を応用して、DNAメチル化制御転写因子候補を複数同定しました。その中で、転写因子GATA6がiPS細胞から肝細胞に至る分化初期段階である胚体内胚葉[4]分化において弱く弛緩しているクロマチン[5]に結合し、結合部位特異的にDNA脱メチル化を誘導するとともに、クロマチン状態を活性化していることを明らかにしました。
本研究は、オンライン科学雑誌『Communications Biology』(5月4日付)に掲載されました。
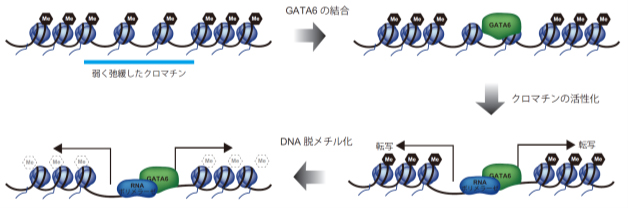
転写因子によるクロマチン活性化のモデル
背景
肝臓の約60~80%を構成する肝細胞は胆汁の生成、分泌タンパク質の合成、脂質・炭水化物の代謝、薬物・毒物の解毒など生体におけるさまざまな重要な働きを担っています。そのため、アルコールやウイルス感染などを原因とした肝炎や肝硬変で肝臓の機能が大きく失われると、生活に大きな支障をきたします。現在、重篤な肝硬変への標準治療として肝臓移植が行われています。
近年では、肝細胞移植による再生医療研究も活発に行われています。また、現在は新薬の開発プロセスでの肝毒性試験にも、体外で培養された肝細胞が用いられています。しかし、これらの肝細胞のもととなる肝臓のドナーが慢性的に不足していることが問題となっており、代替法が求められています。
体内から取り出した肝臓由来の肝細胞の代替として、ヒトiPS細胞から誘導した肝細胞様細胞の活用が期待されていますが、さまざまな肝細胞誘導方法が開発されている一方、完全に肝臓由来の肝細胞を再現する肝細胞様細胞の開発には至っていません。
ヒトiPS細胞から肝細胞様細胞を作製するためには、肝細胞発生の分子メカニズムの理解が重要となります。肝細胞の発生では重要な働きをする遺伝子は多く知られている一方、それらの遺伝子発現の制御機構はよく分かっていません。特に、DNAメチル化は遺伝子発現を制御する重要なエピゲノム修飾[2]ですが、ヒトiPS細胞から肝細胞様細胞分化でのDNAメチル化ダイナミクスは十分に調べられていませんでした。
研究手法と成果
研究チームはまず、ヒトiPS細胞から肝細胞様細胞を誘導し、分化過程の経時的網羅的DNAメチル化データと遺伝子発現データを取得しました(図1)。
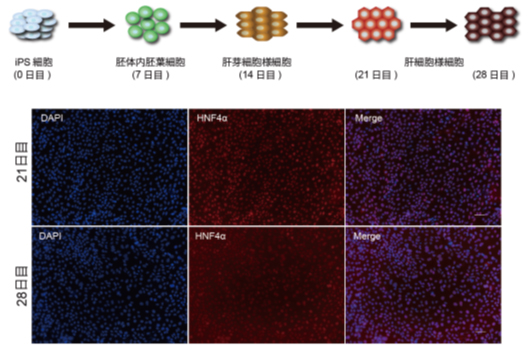
図1 ヒトiPS細胞から肝細胞様細胞への分化誘導
ヒトiPS細胞から肝細胞様細胞へは、胚体内胚葉細胞、肝芽細胞様細胞、肝細胞様細胞へと段階的に分化誘導される(上段)。21日以降の肝細胞様細胞では、肝細胞マーカーであるHNF4αが発現している(下段)。下段の写真は核染色(左:DAPI)、HNF4αの染色(中央)、重ね合わせ画像(右:Merge)。
取得した網羅的DNAメチル化データを基に、研究チームが2017年に開発したDNAメチル化制御転写因子同定法注1)を用いるとともに、遺伝子発現情報から肝細胞分化で発現している転写因子に絞り込むことで、ヒトiPS細胞から肝細胞様細胞への各分化過程で働くDNAメチル化制御転写因子候補を同定しました。
さらに、同定されたDNAメチル化制御転写因子候補の中で、肝細胞発生の初期段階である胚体内胚葉細胞分化で重要な働きをする転写因子GATA6に着目し、ヒトiPS細胞から胚体内胚葉細胞分化でGATA6が発現するタイミングで詳細な解析を行いました。その結果、GATA6の発現が上昇する直前から6時間ごとのDNAメチル化、遺伝子発現、クロマチン状態、およびGATA6のゲノムへの結合パターンを統合解析することで、GATA6のゲノムへの結合によってDNA脱メチル化・クロマチンの活性化が生じることが分かりました。また、GATA6が結合する領域はGATA6が結合する前から既にクロマチン状態が弱く弛緩していることも明らかになりました。
このような不活性化されているクロマチンに結合して活性化する転写因子は「パイオニア因子[6]」と呼ばれていますが、これまでパイオニア因子がどのように不活性化されているクロマチンに結合するのかはよく分かっていませんでした。本研究により、パイオニア因子が不活性化クロマチンを認識し、クロマチンを活性化する一連の機序の一部が明らかになりました(図2)。
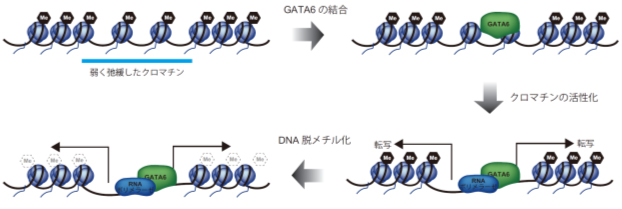
図2 パイオニア因子によるクロマチン活性化モデル
転写因子GATA6は弱く弛緩したクロマチン領域に結合する。その後、クロマチンのさらなる弛緩や転写などクロマチン活性化が起こるとともに、DNA脱メチル化が誘導される
注1)2017年12月14日プレスリリース「DNAのメチル化を切り替える因子の同定法を開発」
今後の期待
本研究で同定されたDNAメチル化制御転写因子を導入することで、ヒトiPS細胞から肝細胞分化の効率化が期待できます。また、本研究で得られた知見を肝臓由来の肝細胞と比較することで、iPS細胞から誘導された肝細胞様細胞の機能性の改善にもつながる成果であり、将来的な肝臓再生医療や創薬への貢献が期待できます。
補足説明
1.iPS細胞
分化した体細胞に転写因子を導入することでリプログラミン(初期化)された誘導多能性幹細胞。2006年に京都大学山中伸弥教授らの研究グループが世界で初めてマウスiPS細胞の作製に成功し、2007年にはヒトでも成功している。iPS細胞はES細胞と同様の特徴を持ち、無限に増殖することができ、さらに体のほとんどの細胞に分化することができる。
2.DNAメチル化、DNA脱メチル化、エピゲノム修飾
哺乳類では、シトシン・グアニン(CG)配列のCにメチル基が修飾されるDNAメチル化が生じている。遺伝子発現制御領域のDNAがメチル化されると遺伝子発現が抑制され、一方で遺伝子発現活性化のためには脱メチル化される必要がある。このようなDNAメチル化やヒストン修飾などのゲノム配列を変化させない修飾をエピゲノム修飾という。
3.転写因子
特定のゲノム配列に結合し、遺伝子発現を制御するタンパク質。
4.胚体内胚葉細胞
発生初期に胚の内部細胞塊から分化してくる細胞で、将来的に肝臓、肺、すい臓、小腸や大腸を構成する細胞へと分化する。
5.クロマチン
ゲノムのDNAとヒストンなどのタンパク質の複合体。立体構造をとり、その構造変化で物理的に転写因子や遺伝子発現に必要なタンパク質の結合を阻害することで遺伝子発現を制御している。
6.パイオニア因子
不活性化されて密な状態のクロマチンに結合し、クロマチン状態を弛緩させて活性化する能力のある転写因子。通常の転写因子は密な状態のクロマチンには結合できない。
研究チーム
理化学研究所 生命医科学研究センター 細胞機能変換技術研究チーム
上級研究員 鈴木 貴紘(すずき たかひろ)
(横浜市立大学 大学院生命医科学研究科 大学院客員准教授)
テクニカルスタッフⅠ 降籏 絵里奈(ふるはた えりな)
テクニカルスタッフⅠ 前田 紫緒里(まえだ しおり)
テクニカルスタッフⅠ 木嶋 真美(きしま まみ)
特別研究員 宮島 優里奈(みやじま ゆりな)
大学院リサーチ・アソシエイト 田中 優希(たなか ゆき)
パートタイマー(研究当時)リム・ジョアン(Lim Joanne)
人材派遣 西村 創(にしむら はじめ)
テクニカルスタッフⅠ 中西 友理(なかにし ゆり)
研修生(研究当時)庄島 愛子(しょうじま あいこ)
チームリーダー 鈴木 治和(すずき はるかず)
原論文情報
Takahiro Suzuki, Erina Furuhata, Shiori Maeda, Mami Kishima, Yurina Miyajima, Yuki Tanaka, Joanne Lim, Hajime Nishimura, Yuri Nakanishi, Aiko Shojima, Harukazu Suzuki, “GATA6 is predicted to regulate DNA methylation in an in vitro model of human hepatocyte differentiation”, Communications Biology, 10.1038/s42003-022-03365-1
発表者
理化学研究所
生命医科学研究センター 細胞機能変換技術研究チーム
上級研究員 鈴木 貴紘(すずき たかひろ)
チームリーダー 鈴木 治和(すずき はるかず)
報道担当
理化学研究所 広報室 報道担当