プロテインキナーゼCのC1ドメインの構造が解明され、治療法の新しいアイディア New ideas for treatments may come from newly solved structures of the C1 domain of protein kinase C
2022-05-16 テキサス A&M大学
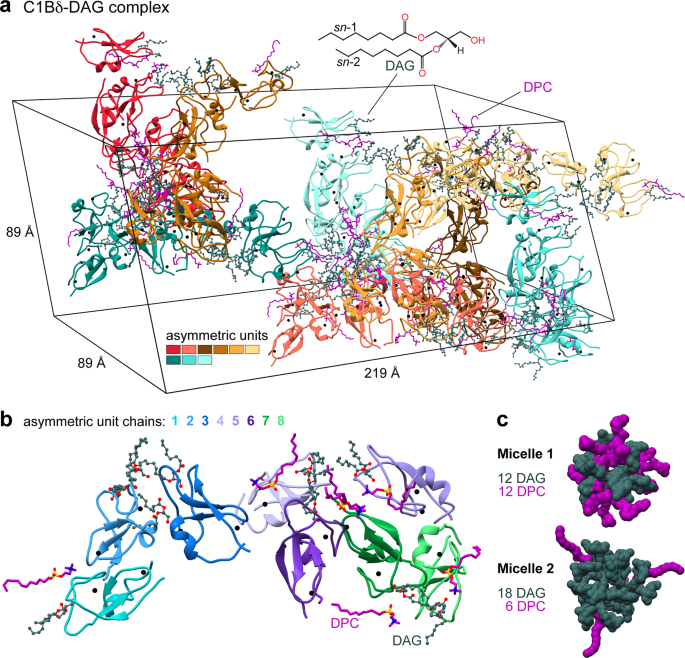
具体的には、プロテインキナーゼC(PKC)のC1ドメイン(生体内でPKCの活性を調節する役割を果たすドメイン)について説明しました。この構造では、C1ドメインが治療上重要なさまざまな分子を包み込んでおり、医薬品候補を設計するための信頼性の高い原子分解能のガイドを初めて提供するものです。
この研究は、テキサスA&M大学農学生命科学部生化学・生物物理学科のTatyana Igumenova准教授が指導し、5月16日発行の『Nature Communications』誌に掲載されました。このプロジェクトの主執筆者は、イグメノバと共同研究している博士研究員のサチン・カッティ(Sachin Katti)博士です。
<関連情報>
- https://agrilifetoday.tamu.edu/2022/05/16/texas-am-agrilife-describes-new-protein-structures-to-aid-rational-drug-design/
- https://www.nature.com/articles/s41467-022-30389-2
プロテインキナーゼC C1ドメインとジアシルグリセロールおよび他のアゴニストとの相互作用の構造解明 Structural anatomy of Protein Kinase C C1 domain interactions with diacylglycerol and other agonists
Sachin S. Katti,Inna V. Krieger,Jihyae Ann,Jeewoo Lee,James C. Sacchettini & Tatyana I. Igumenova
Nature Communications Published: 16 May 2022
DOI:https://doi.org/10.1038/s41467-022-30389-2
Abstract
Diacylglycerol (DAG) is a versatile lipid whose 1,2-sn-stereoisomer serves both as second messenger in signal transduction pathways that control vital cellular processes, and as metabolic precursor for downstream signaling lipids such as phosphatidic acid. Effector proteins translocate to available DAG pools in the membranes by using conserved homology 1 (C1) domains as DAG-sensing modules. Yet, how C1 domains recognize and capture DAG in the complex environment of a biological membrane has remained unresolved for the 40 years since the discovery of Protein Kinase C (PKC) as the first member of the DAG effector cohort. Herein, we report the high-resolution crystal structures of a C1 domain (C1B from PKCδ) complexed to DAG and to each of four potent PKC agonists that produce different biological readouts and that command intense therapeutic interest. This structural information details the mechanisms of stereospecific recognition of DAG by the C1 domains, the functional properties of the lipid-binding site, and the identities of the key residues required for the recognition and capture of DAG and exogenous agonists. Moreover, the structures of the five C1 domain complexes provide the high-resolution guides for the design of agents that modulate the activities of DAG effector proteins.