2022-05-30 京都大学iPS細胞研究所
ポイント
- ヒトiPS細胞から誘導した骨格筋幹細胞を用いて骨格筋細胞を作製する技術を開発した。
- この骨格筋細胞は非常に成熟した成体骨格筋と似た特徴をもっている。
- 純度の高い骨格筋細胞を作製し、創薬スクリーニングに耐えうる均一な分化系を構築した。
- 人工的な遺伝子操作による影響を受けずに種々の筋疾患の病態再現ができる。
1. 要旨
藤原慧 元特定研究員(京都大学CiRA臨床応用研究部門、現大阪医療センター)、久保田智哉 助教(大阪大学大学院医学系研究科保健学専攻)、櫻井英俊 准教授(京都大学CiRA臨床応用研究部門)らの研究グループは、遺伝子導入を用いずヒトiPS細胞から骨格筋幹細胞を誘導し、骨格筋細胞を作製する技術を開発しました。この細胞は従来から報告されているものと比較して、骨格筋に特徴的な細胞内構造を持った非常に成熟度の高いものであり、患者由来iPS細胞を用いた筋疾患の病態メカニズム解析につながると考えられます。さらに本誘導系で作製される骨格筋細胞は分化率、均一性ともに高く、創薬スクリーニングに適応可能と考えられ、創薬開発に貢献できると期待されます。
この研究成果は2022年5月30日にスイス科学誌「Frontiers in Cell and Developmental Biology」でオンライン公開されました。
2. 研究の背景
遺伝性筋疾患において、患者由来iPS細胞を用いて病態メカニズムの解明が進み、創薬スクリーニングを実現することが、新規治療法の確立に向けて期待されています。筋疾患においては3つ組構造注1)やサルコメア構造注2)といった細胞内部構造に異常をきたすことが多く、病態を正確に再現するためにはこういった構造を持つ「成熟した」骨格筋細胞を作製することが重要と考えられています。さらにその骨格筋細胞は実際のヒトの筋線維に近い「生理的な」細胞であることが望ましいと考えられます。これまでにも本研究グループを含めいくつかのグループが、電気刺激装置やモールドを使った3D培養法などを駆使して成熟化させることに成功していますが、特殊な器具や装置を必要とする方法であり、創薬スクリーニングへの応用にはさらなる技術革新を必要としていました。
また、従来ヒトiPS細胞から骨格筋細胞を効率よく作製する際には、特定の遺伝子を導入し分化誘導を行うことが多く用いられています。しかしながら、この方法では特定の遺伝子発現が増幅されることで不自然な遺伝子ネットワークが形成されるおそれがあり、骨格筋疾患の病態解析に悪影響が出る可能性がありました。本研究グループはこの問題を克服するため、以前に報告した外来遺伝子の導入を行わない分化誘導法で骨格筋幹細胞(iMuSC)を誘導し(CiRAプレスリリース2020年7月3日「筋ジストロフィーマウスにおけるヒトiPS細胞由来骨格筋幹細胞の移植効果を確認」)、iMuSCを純化した後に再度培養することで「生理的な」骨格筋細胞を作製し、さらに病態解析に適した「成熟した」骨格筋細胞にすることを目指して研究を行いました。
3. 研究結果
1)iMuSCsから成熟骨格筋細胞の作製に成功
iMuSCの目印として特異的なマーカー遺伝子であるPAX7が発現すると黄緑色の蛍光を発するPax7-VenusレポーターiPS細胞を用いて、2020年に報告した方法でiMuSCを分化誘導し、得られたiMuSCsを用いて成熟した骨格筋細胞の誘導条件を検討しました。
まず、iMuSCを播種後に5日間増殖培地で十分に増殖させたのち、分化誘導培地に切り替えます。この際、無血清培地を用いると、従来使用していたウマ血清培地と比較して、筋収縮に重要な役割を果たすミオシン重鎖タンパク質(MHC)が多くみられ、高効率に骨格筋分化が進むことがわかりました(図1A,B)。さらに、培養7日目に高濃度マトリゲル注3)を培養皿底面に重層することで細胞の成熟化を図りました。その結果、培養42日目では整列したサルコメア構造、3つ組構造いずれもが電子顕微鏡で確認できました(図1C)。
またこれらの特徴は、他のiPS細胞株を用いて表面マーカーによる純化法でiMuSCを純化した場合にも確認されました。
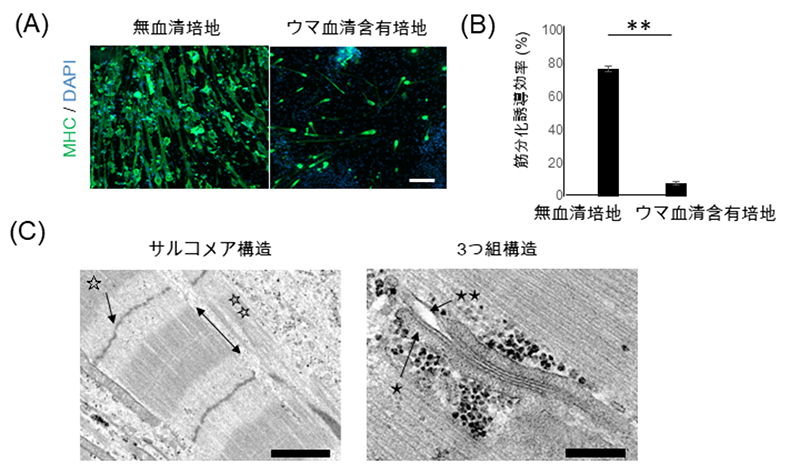
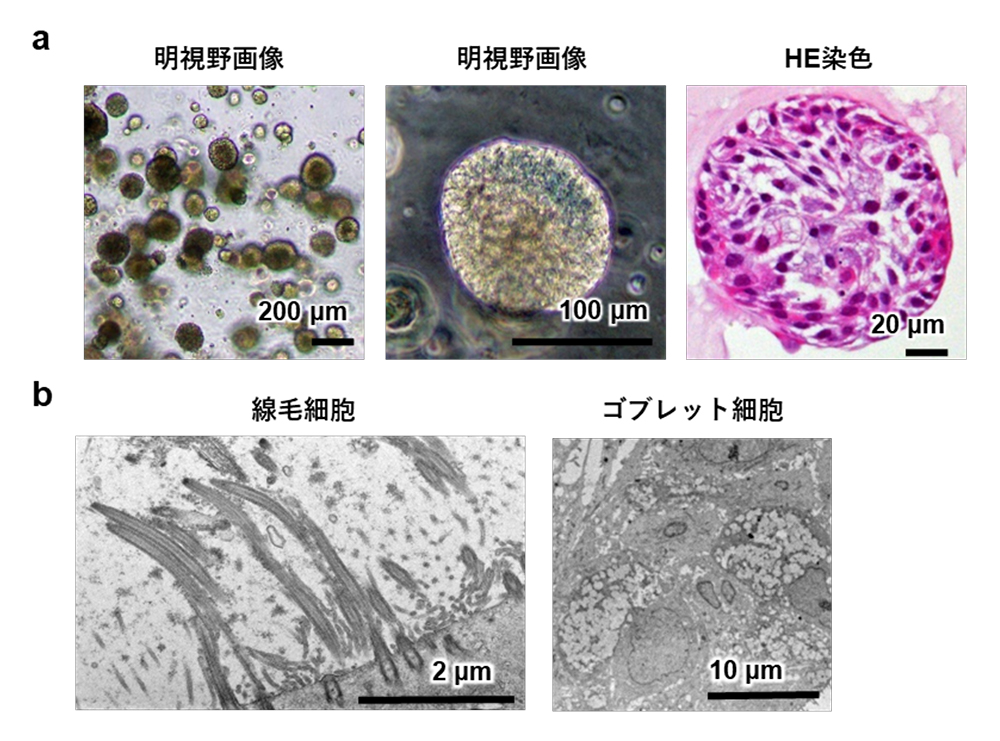
図1 iMuSCsから成熟骨格筋細胞を作製
A: 無血清培地、血清培地で分化誘導した骨格筋細胞。ミオシン重鎖(MHC:緑)陽性の筋細胞が無血清培地条件では多数誘導されている。スケールバー 200μm
B: 分化誘導効率の評価としてAの細胞のMHC陽性率を定量したグラフ。**p値が0.01未満としこれを統計学的に有意とみなした。
C: 培養42日目の骨格筋細胞の電子顕微鏡写真、整列したサルコメア構造と3つ組構造が観察される。☆:Z線、☆☆:A帯、★:筋小胞体、★★:T管、スケールバー 250nm(左)、200nm(右)
2)高濃度マトリゲル3D重層により作製した骨格筋細胞の遺伝子発現解析
次に、高濃度マトリゲル3D重層注3)が骨格筋の成熟化にどのような影響を及ぼしているのかを調べるため、成熟化に関連して上昇する遺伝子の発現量を解析しました。種々のミオシン重鎖遺伝子(MYH2〜8)と筋小胞体関連遺伝子 (CASQ1 ATP2A1)、T管関連遺伝子 (DHPRα DHPRβ DHPRγ)の発現パターンを比較すると、培養14日では高濃度マトリゲル3D重層を行った群では、解析を行った遺伝子発現いずれもが、重層しなかった群と比較して上昇傾向にあることがわかりました。(図2)
またこれらの特徴は、他のiPS細胞株を用いて表面マーカーによる純化法でiMuSCを純化した場合にも確認されました。
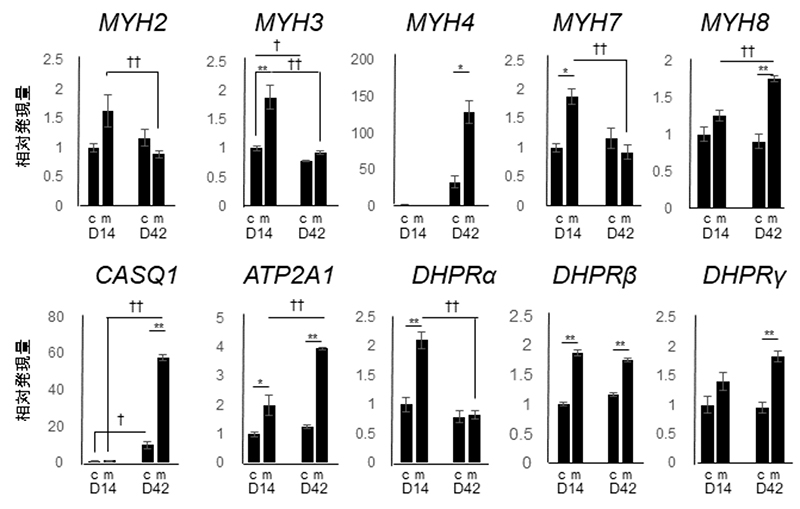
図2 高濃度マトリゲル3D重層を行った群と行わない群での遺伝子発現の比較
上段: 高濃度マトリゲル3D重層群と何も行わない群で各種ミオシン重鎖(MYH2~8)遺伝子の発現量の比較。
下段: 高濃度マトリゲル3D重層群と何も行わない群で筋小胞体関連遺伝子(CASQ1 ATP2A1)T管関連遺伝子(DHPRα DHPRβ DHPRγ)の発現量の比較。
実験は培養14日と培養42日で行った。cは高濃度マトリゲル3D重層を行っていない群、mは行った群。
†マークは培養14日と42日の比較;†p値が0.05未満、††p値が0.01未満としこれらを統計学的に有意とみなした。
*マークはcとmの比較;*p値が0.05未満、**p値が0.01未満としこれらを統計学的に有意とみなした。
3)骨格筋細胞のナトリウムチャネルを介した電気生理学的解析
続いて、高濃度マトリゲル3D重層により作製した骨格筋細胞のナトリウムチャネルの発現、電気生理学的な性質の解析を行いました。一般的に、ナトリウムチャネルの1種であるSCN4Aは骨格筋が成熟するにつれその発現が上がり、一方でまた別の種類のナトリウムチャネルであるSCN5Aは胎児期の骨格筋、心筋に発現していることが知られています。iPS細胞から分化誘導された筋細胞において、SCN4Aの発現が上昇することは、筋細胞が胎児期から成熟化に向かっている特徴であると考えられます。この成熟化培養法を用いると、SCN4Aの発現は経時的に上昇していきました(図3A)。一方、SCN5Aの発現量には変化はありませんでした。
次に骨格筋細胞を用いてパッチクランプ法注4)でナトリウム電流を測定しました。その結果このナトリウム電流はフグ毒として知られるナトリウムチャネル阻害剤であるテトロドトキシン(TTX)によって抑制されたことから、SCN4Aチャネルを介した電流であることが示唆されました(図4B)。
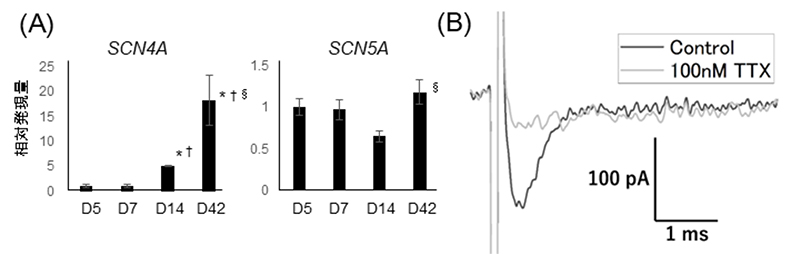
図3 iMuSCsから作製した骨格筋細胞のナトリウムチャネル発現と電流解析
A: SCN4A、SCN5Aの発現量を、培養5日、7日、14日、42日の骨格筋細胞で測定した。
B: パッチクランプ法を用いて確認したナトリウム電流の波形。TTXを用いてナトリウムチャネルを阻害することで、電流波形は抑制される。
4)iMuSCsを起点とした成熟骨格筋分化系は創薬スクリーニングにも使用可能
最後に、このiMuSCsから誘導した成熟骨格筋細胞が将来的な創薬スクリーニングに使用できるか評価を行いました。96wellの細胞プレートの内側60wellにiMuSCsを培養し、骨格筋細胞に分化させ、その分化均一性を評価しました。ほとんどのWellで分化誘導効率は70%後半から80%台であり平均誘導効率は約79%と高効率でした(図4A、B)。また、正確なスクリーニングを行うためにはwell間のばらつきの指標であるCV値が10%を切ることが必要と言われていますが、CV値は3.17%と非常に低い値であり(図4B)、このiMuSCsから作製した成熟骨格筋細胞分化系は筋疾患に対する創薬スクリーニングにも有望であることが分かりました。
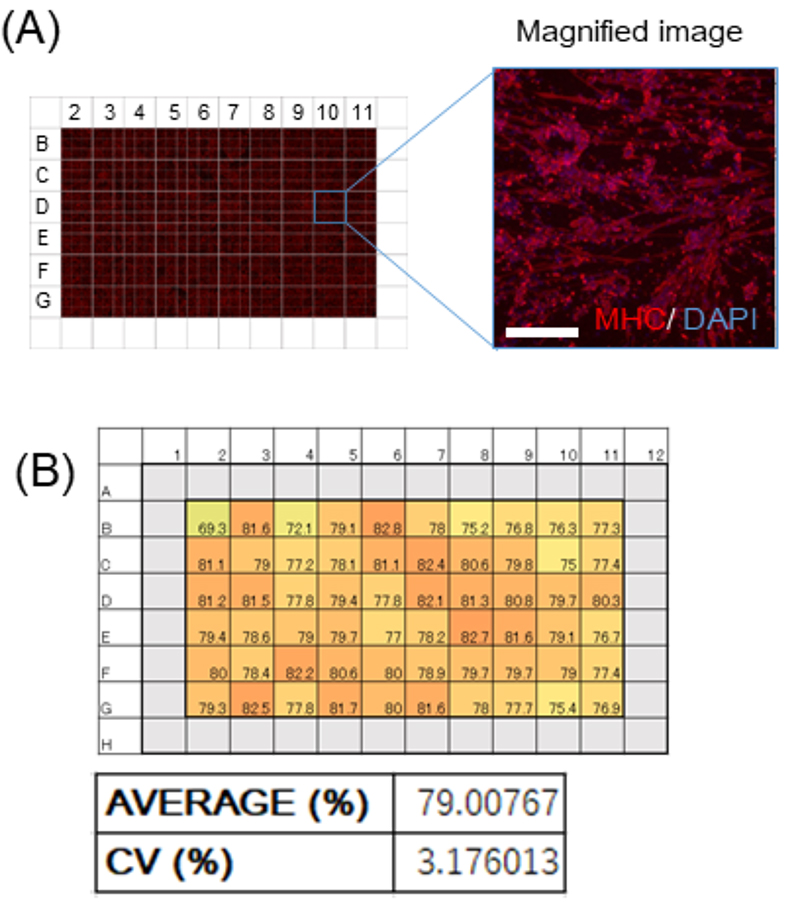
図3 iMuSCsから作製した骨格筋細胞のナトリウムチャネル発現と電流解析
A: Pax7-Venusで抽出したiMuSCsをマルチウェルプレートに播種し、21日間培養、分化させた骨格筋細胞を骨格筋のマーカーであるMHCを染色した像。
B: どのウェルも高い骨格筋分化効率を示し、平均誘導効率は79%であった。ばらつきを示す指標CVは3.17と非常に低かった
4. 本研究の意義と今後の展望
本研究ではヒトiPS細胞から骨格筋幹細胞iMuSCsを誘導し、これを用いることで成熟した骨格筋細胞を得ることに成功しました。この骨格筋細胞は細胞内収縮装置である整列したサルコメア構造、筋小胞体とT管からなる3つ組構造が存在し、さらに成熟骨格筋に特徴的なナトリウムチャネルの発現を備え機能も評価可能です。こういった特徴は従来法でiPS細胞から分化誘導された骨格筋細胞には見られず、格段に成熟した骨格筋細胞であることがうかがえます。さらに本法は特定の外来遺伝子を強制発現させることなく分化を行っており、より生理的に分化させた骨格筋細胞であるというメリットもあります。
遺伝性筋疾患のいくつかにはサルコメア構造や3つ組構造に異常を認めるという報告があり、本細胞を用いることで筋疾患の病態モデルの作製、疾患のメカニズム解析が進むと考えられます。さらにこの骨格筋細胞誘導法は高い分化効率と均一性を持ち、将来的に創薬スクリーニングを行い筋疾患に対する有効な治療標的を見つけることに貢献できると期待されます。
5. 論文名と著者
- 論文名
Mature myotubes generated from human induced pluripotent stem cells without forced gene expression - ジャーナル名
Frontiers in Cell and Developmental Biology - 著者
Kei Fujiwara1, Risa Yamamoto2, Tomoya Kubota2, Atsutoshi Tazumi3, Tomoka Sabuta1, Masanori P. Takahashi2 and Hidetoshi Sakurai1* - 著者の所属機関
- 京都大学iPS細胞研究所 臨床応用研究部門
- 大阪大学大学院 医学系研究科 保健学専攻 臨床神経生理学
- 旭化成ファーマ株式会社
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「疾患特異的iPS細胞の利活用促進・難病研究加速プログラム」
7. 用語説明
注1)3つ組構造
骨格筋細胞が筋力を発生させるためには、神経からの刺激がT管という構造物を通って筋小胞体に到達し、筋小胞体に蓄えられているカルシウムイオンが流出することが必要になります。骨格筋ではT管の左右に筋小胞体が2つ隣接したような形態をとっており、これを3つ組構造と呼んでいます。
注2)サルコメア構造
骨格筋細胞は収縮することで筋力を発生させますが、その収縮の機能上での最小単位を指します。フィラメントという長細い線維成分がよりあわさってできており、骨格筋細胞の短軸、長軸方向に特徴的な構造を形成します。
注3)三次元 (3D)マトリゲル重層
マトリゲルとは細胞外基質タンパク質に富む腫瘍であるEHSマウス肉腫細胞から単離した再構成基底膜のことを言います。このマトリゲルを細胞の上にのせ、37℃環境下に30分程度置くとゼリー状に固まり、三次元的に細胞を包み込むような形になります。
注4)パッチクランプ法
イオンチャネルを介したイオンの挙動を記録することで、細胞膜上のイオンチャネルの活動を直接的に測定する方法。