2022-10-18 京都大学iPS細胞研究所
ポイント
- 新たに開発した温度感受性センダイウイルスベクター注1を用いることで、ヒトナイーブ型iPS細胞注2樹立後に不要に残存するウイルスベクターの迅速な除去を可能にした。
- ヒト皮膚線維芽細胞のみならず、ヒト末梢血単核球注3からもヒトナイーブ型iPS細胞を作製することが可能となった。
- フィーダー細胞注4を用いずにヒト皮膚線維芽細胞からヒトナイーブ型iPS細胞を作製することができた。
- 本法により作製されたヒトナイーブ型iPS細胞は、従来の方法で樹立されたヒトナイーブ型iPS細胞と比べて、三胚葉注5および栄養外胚葉注6への分化能が著明に高い。
- 本法は現在広く用いられているプライム型ヒトiPS細胞注7の樹立にも応用が可能である。
1. 要旨
國富晃 元特定研究員(CiRA基盤技術研究部門、現米国グラッドストーン研究所 循環器疾患部門)と株式会社IDファーマらの共同研究グループは、新たに開発した温度感受性センダイウイルスベクターを用いることで、ヒトナイーブ型iPS細胞の樹立後により迅速かつ簡便にウイルスベクターを除去する方法を確立しました。またiPS細胞樹立時に用いる遺伝子の組み合わせを変更することで、ヒトの皮膚線維芽細胞のみならず末梢血単核細胞からもナイーブ型iPS細胞を作製することができるようになり、さらに皮膚線維芽細胞からはフィーダー細胞を用いずにナイーブ型iPS細胞を作製できるようになりました。また本法により作製されたヒトナイーブ型iPS細胞は外来遺伝子の発現が消失しているため、従来の方法で作製されたナイーブ型iPS細胞と比べてより優れた三胚葉および栄養外胚葉への分化能を持つことが分かりました。さらにこの技術はプライム型ヒトiPS細胞の樹立にも応用できることが分かりました。
本研究成果は2022年10月17日11時(ET:アメリカ東部時間)にCell Reports Methods誌でオンライン公開されました。
2. 研究の背景
ヒトナイーブ型iPS細胞は現行のプライム型iPS細胞と比較してより多くの細胞に分化できる能力を持つことが報告されています。当初ヒトナイーブ型iPS細胞は既に樹立されたプライム型iPS細胞に複数の多能性を誘導する遺伝子、サイトカイン注8、または化学物質を導入することにより作製されていましたが、最近、より簡便かつ迅速な作製方法としてセンダイウイルスベクターを用いて初期化因子OCT4、SOX2、KLF4、CMYCをヒト皮膚線維芽細胞に導入することにより、ヒトナイーブ型iPS細胞を体細胞から直接樹立する方法が報告されました。しかしこの方法を用いた場合、初期化完了後のナイーブ型iPS細胞においてセンダイウイルスゲノムの発現は高レベルで持続することが多く、ウイルスベクター由来の初期化因子の発現が持続することにより多分化能が阻害されるのみならず、iPS細胞の腫瘍原性に繋がる可能性があることが問題となっていました。
現在広く用いられているプライム型iPS細胞の場合はiPS細胞のコロニーが大きいため、手作業によるiPS細胞コロニー単離でウイルスベクターが消失しているiPS細胞を選別できますが、この方法はプライム型iPS細胞よりも細胞のコロニーがはるかに小さいナイーブ型iPS細胞では困難であり、結果としてヒトナイーブ型iPS細胞からセンダイウイルスベクターを除去する信頼性の高い方法は今まで確立されていませんでした。
また、体細胞からのナイーブ型iPS細胞樹立はヒト皮膚線維芽細胞を用いることに限られており、またプライム型iPS細胞のようにフィーダー細胞を用いないでiPS細胞を樹立する方法はこれまで報告がありませんでした。
3. 研究結果
1) 樹立したiPS細胞内でより早く除去されるセンダイウイルスベクターを開発した
ヒトiPS細胞の樹立に用いられている代表的な体細胞として、皮膚線維芽細胞や末梢血単核球などが挙げられますが、現在広く使われているヒトiPS細胞樹立用センダイウイルスベクター(CytoTune™-iPS 2.0 Sendai Reprogramming Kit)では末梢血単核球からナイーブ型iPS細胞を樹立することはできませんでした。そこで初期化因子のうちCMYCをLMYCに変更(図1右側)したところ、末梢血単核球からの樹立も可能となりました。しかし上記の方法で樹立したナイーブ型iPS細胞は、長期継代後も著しいセンダイウイルスゲノムの残存を認め、この原因として既存のセンダイウイルスベクターのうち、特にKLF4のみを搭載しているベクター(図1 左側の一番下にあるSeV-KLF4/TSベクター)の存在がセンダイウイルスゲノムの残存に関わっていると考えられました。
この問題を解決するため、SeV-KLF4/TSベクターに2つ改良を加えました。まず1つ目に温度感受性がより高くなる遺伝子変異をウイルスゲノムに導入しました。2つ目にヒトプライム型およびナイーブ型iPS細胞で特異的に高発現しているマイクロRNA注9(miR-367)の標的配列をウイルスゲノムに搭載することで、iPS細胞内でマイクロRNAによりウイルスベクターが分解されるようにしました(図1右側)。この改良型ベクターを使用することにより、ベクター感染細胞の培養温度を変化させるだけで速やかなセンダイウイルスベクターの除去が可能となりました。また皮膚線維芽細胞のみからではあるものの、フィーダー細胞を用いない環境で維持が可能であるヒトナイーブ型iPS細胞も樹立することが可能となりました。さらに現在広く用いられているプライム型ヒトiPS細胞の樹立にもこの技術を用いることが可能であり、ウイルスベクターが発現していないプライム型iPS細胞株を手作業でクローニングする工程が不要となりました。
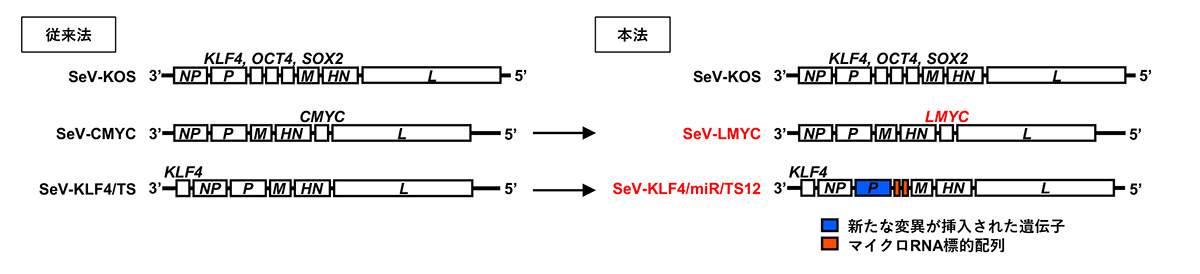
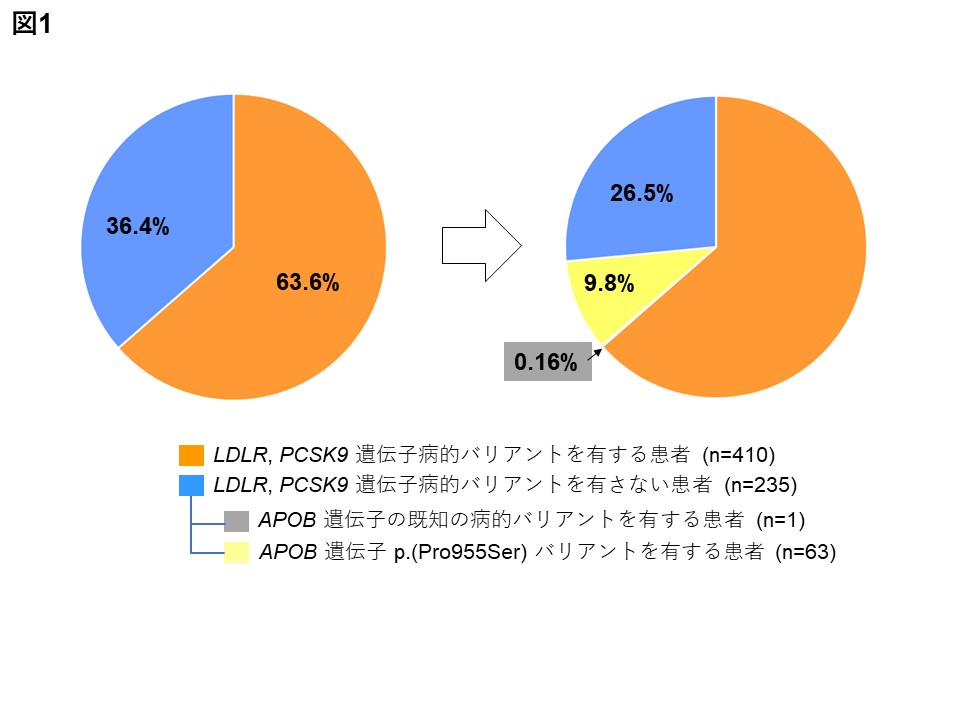
図1 改良型センダイウイルスベクター
従来のセンダイウイルスベクター(左)のCMYCベクターをLMYCベクターに変更し、
KLF4ベクターの構造に改良を加えた(右)

図2 本法で樹立したナイーブ型ヒトiPS細胞
(a) フィーダー細胞上で維持されているナイーブ型ヒトiPS細胞(スケールバーは200μm)
(b) フィーダー細胞を用いずに維持されているナイーブ型ヒトiPS細胞(スケールバーは200μm)
2) 本法で樹立したヒトナイーブ型iPS細胞は、より優れた多分化能力を持っている
本研究で開発した改良型センダイウイルスベクターを用いて樹立したナイーブ型iPS細胞は、プライム型から樹立され現在広くナイーブ型ヒト多能性幹細胞として用いられているナイーブ型ヒトES細胞と同様の遺伝子発現やDNAメチル化注10を示していました。また従来の方法で樹立されたセンダイウイルスゲノムが残っているナイーブ型iPS細胞と、本法で樹立されたナイーブ型iPS細胞でその多分化能を比較したところ、後者は三胚葉への分化能および栄養外胚葉への分化能が著明に優れていることが分かりました。この理由として本法ではiPS細胞樹立後にセンダイウイルスゲノムがほぼ完全に除去されるため、より本来のナイーブ型iPS細胞の多分化能が発揮されたものと考えられました。
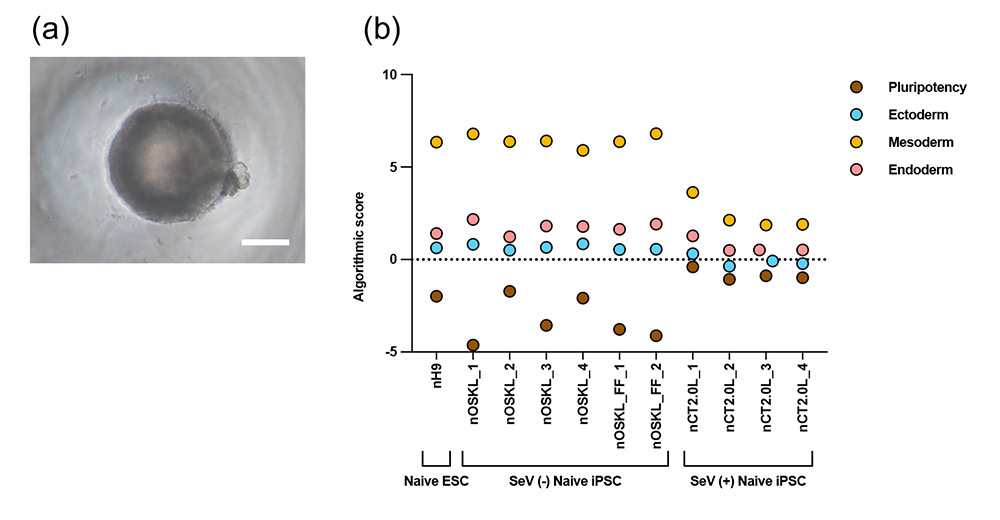
図3 三胚葉分化能の比較
(a) ナイーブ型ヒトiPS細胞から分化誘導した胚様体注11(スケールバーは100μm)
(b) 作製した胚様体における多能性遺伝子および三胚葉の遺伝子発現の比較
※SeV(+) Naive iPSCは従来法で作製したナイーブ型iPS細胞、SeV(-) Naive iPSCは本法で作製したナイーブ型iPS細胞を示しています。
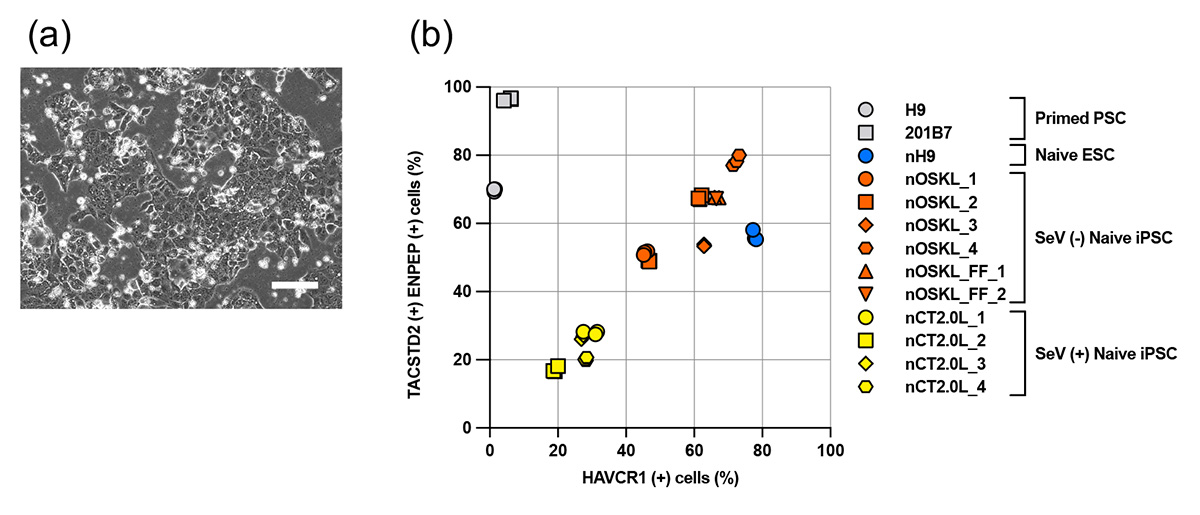
図4 栄養外胚葉分化能の比較
(a) ナイーブ型ヒトiPS細胞から分化誘導した栄養外胚葉(スケールバーは400μm)
(b) フローサイトメトリー注12を用いて調べた栄養外胚葉マーカー陽性細胞数の割合の比較
※SeV(+) Naive iPSCは従来法で作製したナイーブ型iPS細胞、SeV(-) Naive iPSCは本法で作製したナイーブ型iPS細胞を示しています。
4. 本研究の意義と今後の課題
本研究では新たなセンダイウイルスベクターを用いることで、これまで樹立が困難であった細胞種や培養条件からヒトナイーブ型iPS細胞を樹立できるようになっただけでなく、早期かつ簡便なセンダイウイルスベクターゲノムの除去ができることが分かりました。その結果より優れた多分化能を持つヒトナイーブ型iPS細胞を作製することに成功しました。近年ナイーブ型ヒト多能性幹細胞はその高い多分化能を活用してヒト初期胚の研究に多く用いられており、本法はこれらの研究の発展に貢献することが期待されます。
またこの技術はプライム型ヒトiPS細胞の樹立にも応用でき、従来では必要であった手間のかかるクローン選別作業を行わなくてもウイルスベクターゲノムの存在しない細胞株を得ることが可能となりました。そのため多数のドナーからの自家iPS細胞作製を容易にし、それを用いた様々な疾患モデリング、創薬、細胞治療の取り組みを一層進展させることが期待されます。
5. 論文名と著者
- 論文名
Improved Sendai viral system for reprogramming to naive pluripotency - ジャーナル名
Cell Reports Methods - 著者
Akira Kunitomi1,2*, Ryoko Hirohata1,3, Vanessa Arreola2, Mitsujiro Osawa1, Tomoaki M Kato1,3,
Masaki Nomura1,3, Jitsutaro Kawaguchi4, Hiroto Hara4, Kohji Kusano4, Yasuhiro Takashima1,
Kazutoshi Takahashi1, Keiichi Fukuda5, Naoko Takasu1,3, and Shinya Yamanaka1,2,3
*:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所
- グラッドストーン研究所 循環器疾患部門
- 京都大学iPS細胞研究財団
- 株式会社IDファーマ
- 慶應義塾大学医学部 循環器内科
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)
「再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点」 - iPS細胞研究基金
- 日本学術振興会 科研費
7. 用語説明
注1)温度感受性センダイウイルスベクター
ベクターとは遺伝子の運び屋で、生体内外において核酸物質を細胞内へ導入し細胞の機能を改変する能力を持つ。ウイルスを用いた方法は一般的に遺伝子導入効率は高いものの、その細胞毒性やゲノム障害性に問題があったが、センダイウイルスベクターは遺伝子が標的細胞の核内に侵入せず染色体に組み込まれないという特長を持ち安全性や効率の面で優れている。さらに本研究で用いたセンダイウイルスベクターはウイルスゲノム配列に改変を加えており、高温培養を経ることで細胞内から迅速に除去される性質を獲得している。
注2)ナイーブ型iPS細胞
着床前の胚に類似した性質を有する多能性幹細胞を指す。2014年に初めて樹立が報告された。
注3)末梢血単核球
単球やリンパ球など球状の核をもち、免疫に関係する細胞のこと。
注4)フィーダー細胞
目的の細胞を培養する際、培養条件を整える補助的な役割をもつ細胞。通常は薬剤処理または放射線照射によって分裂できないように処理されている。iPS細胞の樹立および維持培養の際には、マウス胎仔由来の線維芽細胞などがフィーダー細胞として用いられる。
注5)三胚葉
受精後の胚からできる細胞の塊で、内胚葉、中胚葉、外胚葉に分けられる。内胚葉は、その後消化器官や呼吸器官を形成する。中胚葉は骨、心筋、赤血球などに分化する。外胚葉は、神経や感覚器官を形成する。本研究ではiPS細胞から胚様体に分化させることでこれらへの分化能を調べている。
注6)栄養外胚葉
胚盤胞の外側に位置する細胞。胎盤細胞の発生の出発点となり、将来胎盤を作る細胞。
注7)プライム型iPS細胞
着床後の胚に類似した性質を有する多能性幹細胞を指す。2007年に世界で初めて公表された、4つの初期化因子を用いて山中教授らの研究グループが樹立したヒトiPS細胞はプライム型に分類される。
注8)サイトカイン
免疫細胞が出す液性因子。他の免疫細胞を活性化させ、炎症を増強する働きを持つものもある。
注9)マイクロRNA(miRNA)
20~30塩基程度の長さの短いノンコーディング(タンパク質をコードしていない)RNA。相補的な配列を持つmRNAと結合して翻訳を抑制したり、mRNAを分解したりすることで、そのmRNAからのタンパク質の合成を抑制する働きをもつと考えられている。」
注10)DNAメチル化
DNAの中の主にCG配列の部分においてメチル基が付加される化学反応。メチル基が付加されるCG配列は細胞の種類によって異なり、遺伝子の発現量と相関する。哺乳類の個体発生に必須で、その異常は白血病などのがん発生の原因となることが知られている。
注11) 胚様体
EB(embryoid body)とも言われ、ES細胞やiPS細胞などを浮遊培養するとボール状の細胞塊を形成する。この状態で2 週間程度培養すると、様々な細胞種への分化が観察される。細胞の分化多能性を調べる一般的な方法の一つとして用いられている。
注12)フローサイトメトリー解析
流動細胞計測法。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量など、細胞の生物学的特徴を解析することができる。