2023-08-25 京都大学iPS細胞研究所
ポイント
- デュアルCRISPR-Cas3システムにより、複数のエクソンを含む数百kbのゲノムDNA欠失を誘導することができる。
- 複数のエクソンを一度に取り除くことで、さまざまなDMD患者さん由来iPS細胞でジストロフィンタンパク質の発現を回復することができた。
- 全ゲノム解析を行ったところ、Cas3によるオフターゲット変異は検出されなかった。
1. 要旨
北 悠人 元CiRA研究員、堀田秋津 准教授らの研究グループは、CRISPR-Cas3注1システムをペアで利用することで、さまざまなデュシェンヌ型筋ジストロフィー(DMD)注2患者さん由来のiPS細胞でジストロフィンタンパク質の発現を回復可能なマルチエクソンスキッピング(MES)注3を誘導する方法を開発しました。このアプローチは、より広範なDMD患者さんに対するゲノム編集治療の開発につながる可能性があります。
DMDは様々な遺伝子の変異パターンがあり、これまで変異パターンごとにジストロフィンを回復させる方法が開発されてきました。これに対し、変異の集積するエクソン45から55までの領域を同時にスキッピングさせるMES法により、複数の変異パターンであっても、一つの方法でジストロフィンタンパク質を回復できることが知られていました。しかし、ゲノムDNA上で数百kb(キロベース)にわたる標的エクソンを網羅するような大規模なDNA欠失を誘導する技術は限られています。
今回の研究では、MESをゲノムDNAレベルで誘導するために、CRISPR-Cas9よりも大きなDNA欠失誘導が得意なCRISPR-Cas3システムのcrRNA注4をペアとして、ジストロフィン遺伝子のエクソン45-55領域(340 kb~)を挟みこむことで、巨大なDNA欠失を誘導できることを示しました。また、ゲノムが編集された細胞を濃縮するために、Cas3/crRNAが活性を示した細胞だけ蛍光を発するSSAレポーターを二色組み合わせる方法を開発しました。このMES誘導システムを用いて、異なる変異を持つ3名のDMD患者さん由来のiPS細胞においてジストロフィンタンパク質が回復することを実証しました。さらに、全ゲノム解析により、推定crRNA結合部位近傍の有意なオフターゲット欠失は検出されませんでした。デュアルCRISPR-Cas3は、巨大なゲノム欠失を誘導し、MES誘導によってジストロフィンタンパク質を回復させる有望なツールであると期待できます。
この研究成果は2023年8月25日(日本時間)に「Stem Cell Reports」で公開されました。
2. 研究の背景
DMDは、筋細胞を維持するために重要な遺伝子であるジストロフィンのゲノム変異により、タンパク質の読み枠が変わってしまい(フレームシフト)、ジストロフィンタンパク質が作られなくなる筋変性疾患です。現在のところ、根治的治療法はありません。ジストロフィンタンパク質を回復させる手段の一つとして、オープンリーディングフレーム(タンパク質の読み枠)を修正するエキソンスキッピングが注目されており、エクソン53をスキップする核酸医薬品が日米で販売されています。
また、CiRAの堀田秋津准教授らのグループの他に海外でも複数のグループが、CRISPR-Cas9を用いたゲノムDNAレベルのエクソンスキッピングも研究しています(CiRAニュース 2014年11月27日)。しかし、現在の単一のエクソンをスキッピングする方法は、限られた変異(8〜13%)にしか適用できません。2012年にマウスでの核酸医薬研究において、国立精神・神経医療研究センター(NCNP)の研究グループがエクソン45から55を標的として複数のエクソンを同時にスキップする方法(MES)であれば、DMD患者さんの60%以上に有効であると報告しました。また、2019年になって、CRISPR-Cas3ゲノム編集技術が報告されました(CiRAニュース2019年12月6日)。CRISPR-Cas3は狙った箇所から一方向に数 kbのゲノム配列を削るという特徴を持ち、堀田准教授らのグループはMESにも利用可能であると考えました。
そこで今回の研究では、デュアルCRISPR-Cas3システムを用い、エクソン45から55を標的とした大規模ゲノム欠失の誘導を目指しました。
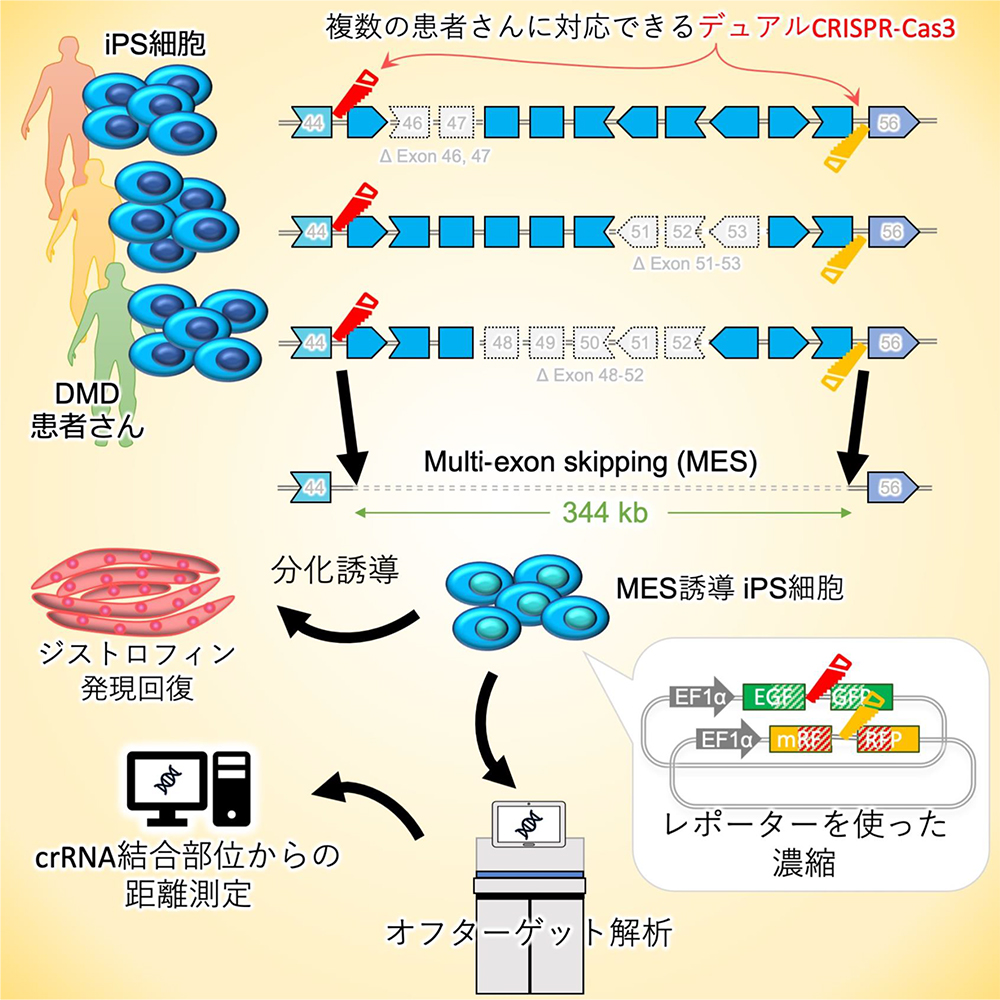
Fig. 1 論文の概要
3. 研究結果
1)デュアルCRISPR-Cas3による数百kbの欠失誘導
1つのcrRNAで誘導されるDNA欠失は数 kb程度であり、100 kb以上の欠失が誘導されることは稀なため、標的とするエクソン45〜55が内側に挟まれるような一対のcrRNAを使用しました。両端のcrRNA標的部位から1-2 kb以内の位置(1 kb、342 kb )と中間地点(232 kb)の位置でどの程度DNA欠失が起こっているかddPCR注5を用いてDNAコピー数を測定したところ、両端と比較して中間地点までが欠失されている細胞は少なかったものの、単一のCas3/crRNAと比較して、デュアルCas3を用いることで344 kbのDNA領域が欠失されている細胞を検出することができました。
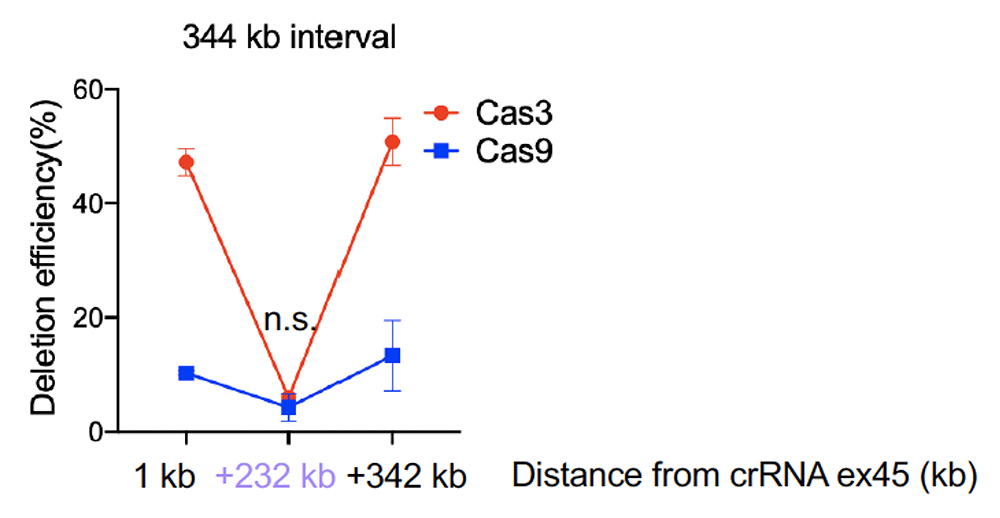
Fig. 2 欠失の誘導効率
2)一本鎖アニーリング(SSA)レポーターを用いたデュアルCas3編集細胞の濃縮
デュアルCas3を用いることで大規模な欠失を誘導することが可能なものの、効率は高くありませんでした。編集された細胞を効率よく濃縮するために、デュアルCas3が機能した細胞だけ、2種の蛍光タンパク質(mRFPおよびEGFP)が光るようなレポーターを作成しました。コントロールcrRNAs(標的を切断しないcrRNA, B2M#1)と比較して、ジストロフィンのエクソン45と55を標的とするcrRNAs(ex45 & 55)を用いた場合にGFP蛍光とmRFP蛍光が観察され、このGFP/mRFP両陽性の細胞をソーティングすることで、必要な細胞群を濃縮することができました(Fig. 3)。
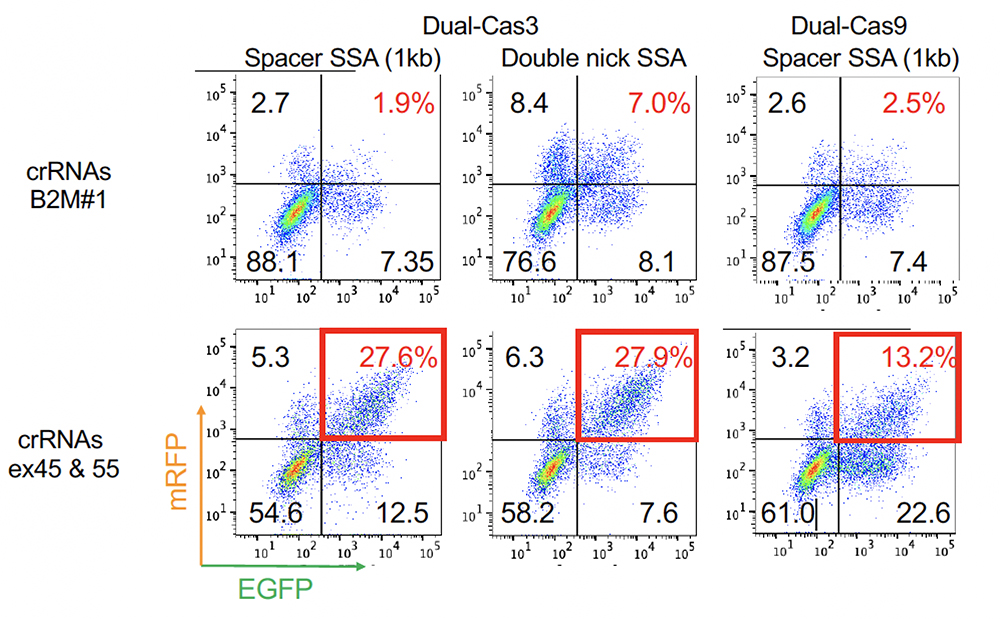
Fig. 3 FACSによる分析
3)患者さん由来iPS細胞を用いたMES誘導
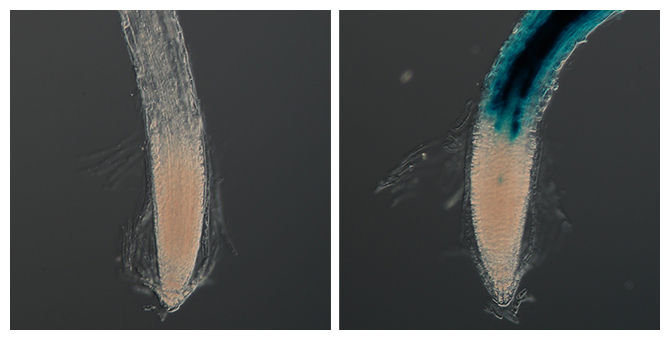
異なる遺伝子変異を持つ3名のDMD患者さんから作成したiPS細胞(FF12020、CiRA00458、CiRA00646)に、デュアルCas3システムを利用してMESを誘導しました。その結果、MESの誘導をする前の細胞ではジストロフィンタンパク質(緑色・Dystrophin)が見られなかったにも関わらず、MESを誘導した細胞ではジストロフィンの発現が確認できました。(Fig. 4)また、MES誘導前後のiPS細胞で全ゲノム解析を実施して、標的以外での欠失誘導が無いことを確認しました。
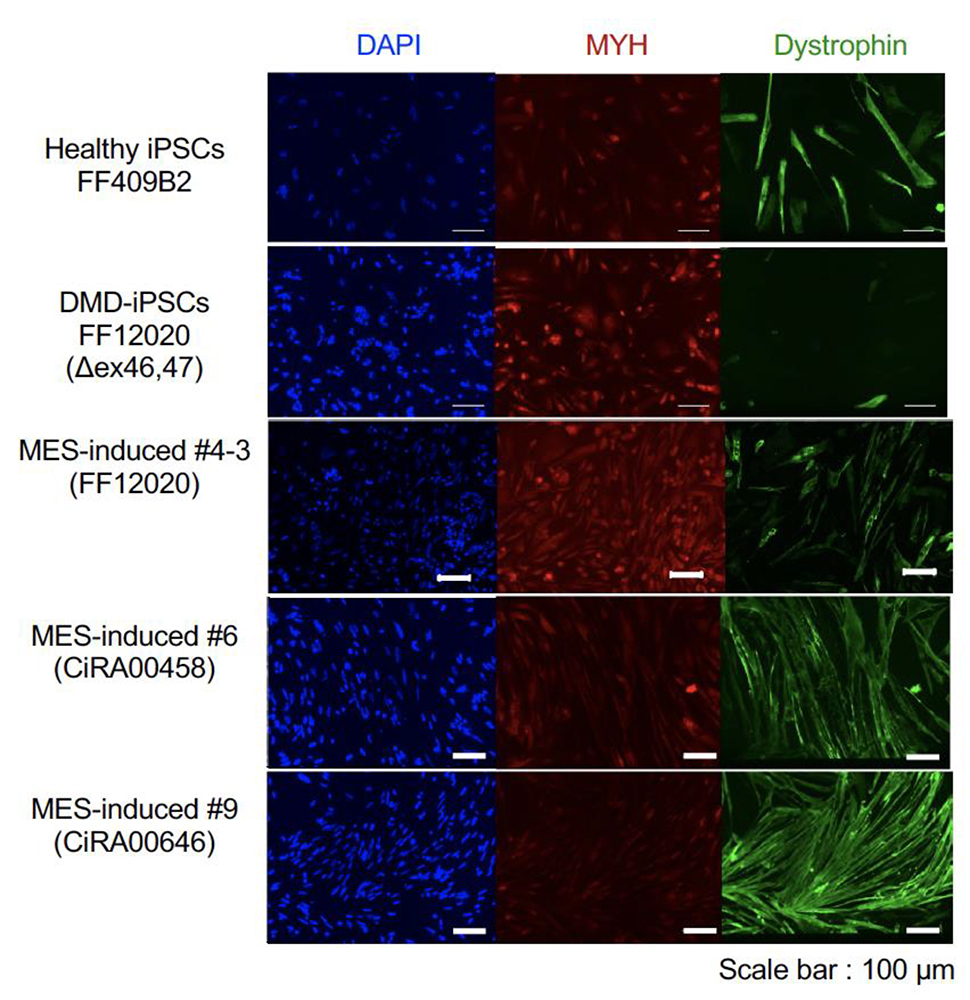
Fig. 4 患者さん由来iPS細胞でのジストロフィン発現
4. まとめと展望
デュアルCas3システムを利用することで、複数のDMD患者さんから作成したiPS細胞において、意図しなかった欠失(オフターゲット効果)を起こすことなく、ジストロフィンタンパク質を回復させることができました。
今回の方法で、大規模に標的ゲノム領域を欠失することができましたが、欠失される開始点を厳密に制御することはできませんでした。また、回復したジストロフィンタンパク質がどの程度機能するのか、現在のところ未確認です。
デュアルCas3システムを使ってゲノム編集を行ったiPS細胞は、将来、DMD患者さんに対して自己細胞治療へと応用する際に重要な細胞源になることが期待できます。また、大規模に遺伝子を欠失させる技術は、基礎研究にも広く応用できると期待できます。
5. 論文名と著者
- 論文名
Dual CRISPR-Cas3 system for inducing multi-exon skipping in DMD patient-derived iPSCs - ジャーナル名
Stem Cell Reports - 著者
Yuto Kita1, Yuya Okuzaki2, Youichi Naoe1, Joseph Lee1, Uikyu Bang1, Natsumi Okawa1,5, Akane Ichiki1, Tatsuya Jonouchi1, Hidetoshi Sakurai1, Yusuke Kojima1, Akitsu Hotta1,3*
*責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 名古屋大学大学院生命農学研究科
- タケダ-CiRA共同研究プログラム(T-CiRA)
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(JP17bm0804005, JP13bm0104001, JP17ek0109293, JP21am0401016)
- 日本学術振興会 科研費(21J13593, 22H02601, 474 21K15361)
- iPS細胞研究基金
- 国立精神・神経医療研究センター(NCNP)(no.28-6)
- 日本学術振興会 卓越大学院プログラム 京都大学メディカルイノベーション大学院プログラム(MIP)
7. 用語説明
注1)CRISPR-Cas3
ゲノムを編集する技術の一つ。広く利用されているCRISPR-Cas9同様に、二本鎖DNAを切断するが、crRNA(ガイド)認識配列が27 塩基と長いことから、特異性が高く、オフターゲット変異が起こりにくい、より安全なゲノム編集ツールとしての使用が期待されている。また、大きな欠失を起こすことも可能なため、遺伝子の改変に加えて遺伝子の機能を失わせることも得意としている。
注2)デュシェンヌ型筋ジストロフィー(DMD)
筋ジストロフィーとは骨格筋の壊死・再生を主病変とする遺伝性筋疾患の総称。中でも、デュシェンヌ型は、ジストロフィンと呼ばれるタンパク質が全くもしくはほとんどないために起こる。ジストロフィンは筋細胞が壊れにくくする役割を持つタンパク質で、ジストロフィンが少ないと筋細胞が壊れ、炎症、線維化が起こり、筋力の低下による運動障害、呼吸筋障害、心筋障害などが引き起こされる。 ジストロフィン遺伝子はX染色体に存在し、2200 kbの巨大遺伝子で、79のエクソンを持つ。
注3)マルチエクソンスキッピング(MES)
遺伝子の中でタンパク質合成の情報を担う部分をエクソンと呼び、直接タンパク質をコードしていない領域をイントロンと呼ぶ。多数のエクソンから一つのタンパク質は合成されているが、一部分のエクソンをスキップして少し短いタンパク質を作らせる方法をエクソンスキッピングという。その中でも、複数のエクソンをスキップする方法をMESと呼ぶ。
注4)crRNA(CRISPR RNA)
CRISPR-Casシステムにおいて、標的となるDNA配列を認識する役割を持つRNA。
注5)ddPCR(Droplet Digital PCR)
遺伝子を含むサンプルを限界希釈し、ターゲットとなるDNAが1か0となるように、微小区画内に分散させた状態でPCR増幅を行う方法。高精度・高感度にDNAを定量することができる技術。