バクテリアの受容体とペプチドの相互作用をハイスループットでスクリーニングする方法を世界で初めて開発 High-throughput method is first for screening bacterial receptor-peptide interactions
2022-12-12 ライス大学
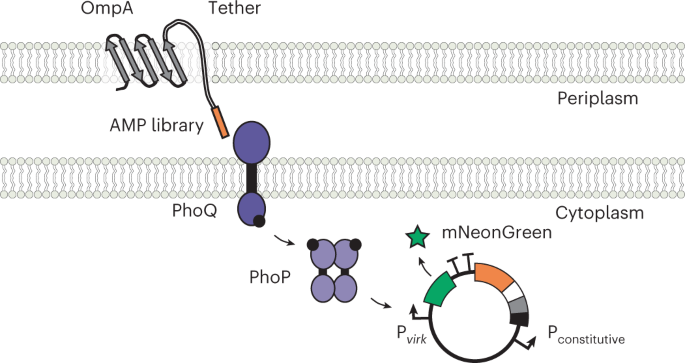
病原性細菌では、PhoPQというセンサーが、感染に必要な遺伝子群をオンにする。ライス大学の研究者たちは、PhoPQをレポーター遺伝子に配線し直し、この遺伝子が刺激されるたびに蛍光タンパク質を作るようにした。その後、研究者らは、操作した微生物をペプチドと呼ばれる数千個の小さなタンパク質に暴露した。すると、ペプチドがPhoPQセンサーを作動させるたびに、微生物が目印の蛍光を発した。
Nature Chemical Biology誌に掲載された論文では、ライス大学のジェフ・タボール教授、共著者のキャサリン・ブリンク教授(21)らが、この技術について述べ、ペプチドディスプレイと呼ばれる手法と組み合わせて、大量のペプチドライブラリーを迅速にスキャンして細菌のセンサーを活性化するものを特定できる方法を示しています。
ペプチドは、バクテリアのセンサー受容体を活性化する重要な物質である。細菌は、危険を知らせたり、集団行動を組織したりするために、化学的なつぶやきのようにペプチドを放送することができる。また、病原性細菌は、ヒトの抗菌ペプチド(AMP)など、脅威となるペプチドを検出するように進化してきた。
「病原性大腸菌と肺炎桿菌のPhoPQは、感染する組織で濃縮されたAMPにより強く反応するという驚くべき証拠を発見しました」とTaborは述べた。例えば、病原性大腸菌のPhoPQは、その菌が頻繁に感染症を引き起こす膀胱のAMPにより強く反応したのです。
<関連情報>
- https://news.rice.edu/news/2022/pathogenic-sensors-surprising-capabilities-revealed
- https://www.nature.com/articles/s41589-022-01207-z
ペプチド-センサーキナーゼ相互作用の特性解析のための大腸菌ディスプレイ法 An E. coli display method for characterization of peptide–sensor kinase interactions
Kathryn R. Brink,Maxwell G. Hunt,Andrew M. Mu,Ken Groszman,Ky V. Hoang,Kevin P. Lorch,Brett H. Pogostin,John S. Gunn & Jeffrey J. Tabor
Nature Chemical Biology Published:08 December 2022
DOI:https://doi.org/10.1038/s41589-022-01207-z
Abstract
Bacteria use two-component system (TCS) signaling pathways to sense and respond to peptides involved in host defense, quorum sensing and inter-bacterial warfare. However, little is known about the broad peptide-sensing capabilities of TCSs. In this study, we developed an Escherichia coli display method to characterize the effects of human antimicrobial peptides (AMPs) on the pathogenesis-regulating TCS PhoPQ of Salmonella Typhimurium with much higher throughput than previously possible. We found that PhoPQ senses AMPs with diverse sequences, structures and biological functions. We further combined thousands of displayed AMP variants with machine learning to identify peptide sub-domains and biophysical features linked to PhoPQ activation. Most of the newfound AMP activators induce PhoPQ in S. Typhimurium, suggesting possible roles in virulence regulation. Finally, we present evidence that PhoPQ peptide-sensing specificity has evolved across commensal and pathogenic bacteria. Our method enables new insights into the specificities, mechanisms and evolutionary dynamics of TCS-mediated peptide sensing in bacteria.