2023-01-12 理化学研究所,東北大学,学習院大学
理化学研究所(理研)生命機能科学研究センター 個体パターニング研究チームの濱田 博司 チームリーダー、加藤 孝信 基礎科学特別研究員、細胞極性統御研究チームの岡田 康志 チームリーダー、細胞場構造研究チームの岩根 敦子 チームリーダー、東北大学大学院 工学研究科 ファインメカニクス専攻の大森 俊宏 助教、同大学院 医工学研究科 医工学専攻の石川 拓司 教授、学習院大学 理学部 物理学科の西坂 崇之 教授らの共同研究グループは、哺乳類の発生過程の初期に体の左右の違いを決定するシグナルが、「機械的な力」によって制御されていることを明らかにしました。
これまで20年にわたり、体の左右対称性が破られる仕組みについて論争が続いていましたが、本研究成果は生物物理学的視点からそのメカニズムを解明した、教科書を書き換える画期的なものです。
ヒトやマウスの内臓は、心臓が体の左側にあるなど非対称に配置されています。この左右の非対称性は、胎児(胚)が成長する初期の段階で、胚の腹側にある「ノード[1]」と呼ばれるくぼみにおいて「左側を決めるシグナル[2]」が活性化されることにより決定されますが、そのメカニズムは長らく未解明でした。
今回、共同研究グループはマウス胚において、光ピンセット[3]や超解像顕微鏡[4]など独自の先進的な光学顕微鏡を用い、物理的解析を行うことで、この問題の解明に挑みました。その結果、①ノードで生じる左向きの体液の流れ(ノード流[5])により、ノードの左側の不動繊毛[6]は腹側に曲げられ、右側の不動繊毛は背側に曲げられる、②不動繊毛は腹側への曲げのみに反応する「曲げられる向きを感知できるアンテナ」であることから、ノードの左側のみで左側を決めるシグナルが活性化する、つまり不動繊毛がノード流の力を感知して活性化されることを明らかにしました。
本研究は、科学雑誌『Science』オンライン版(1月6日付)に掲載されました。
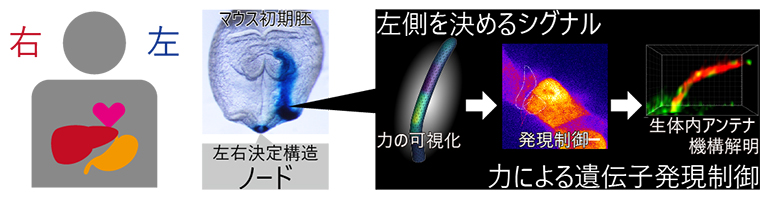
体の左右を決定するノードという構造で、機械的な力によって対称性が破られる
背景
ヒトやマウスの体内では、内臓は心臓が左側、肝臓が右側など左右非対称に配置されています。この左右非対称性は胎児が成長する過程で決定され(ヒトは受精後3週目、マウスは受精後7.5日目)、内臓の正常な形成と機能に必須であるとされています。左右非対称性に異常が生じると、先天性の心疾患をはじめとする重篤な病気が引き起こされ、多くは出生後に生命の危機に陥ります。
ヒトを含む哺乳類の胚は、最初は左右対称です。左右対称性が破られるきっかけは、初期胚の腹側に一過的に形成される「ノード(図1A、B)」と呼ばれるくぼみにおいて、「左側を決めるシグナル」が活性化されることです。ノードは水を入れたお椀のような構造をしていて、お椀の中では体液が左向きに流れています(ノード流)。ノード流は、ノードのお椀の底の細胞に生えている動繊毛[5]が斜めに回転運動をすることで作られます。お椀の縁の細胞には不動繊毛が生えていて、アンテナの役割を担っています(図1B)。不動繊毛は何らかの方法でノード流を感知し、ノード流の下流側(ノードの左側)でのみ、左側を決めるシグナルが活性化注1、2)されることが分かっています(図1C)。
しかし、「不動繊毛というアンテナがどのようにノード流を感知するのか」、そして「なぜ左側の不動繊毛だけが活性化されるのか」という、左右非対称性を決定する根源的なメカニズムは未解明のままでした(図1D)。
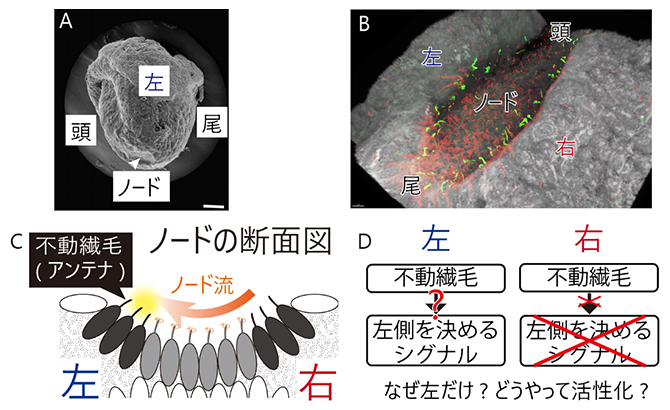
図1 初期胚の「ノード」で左右を決める不動繊毛
(A)電子顕微鏡で見たマウスの初期胚の拡大写真(受精後8日目)※。マウスでは受精後7.5日目の初期胚の腹側に、ノードと呼ばれる一過的なくぼみが生じる(矢頭)。スケールバーは10μm。※出典はShiratori, H.; Hamada, H. The left-right axis in the mouse: From origin to morphology. Development 133, 2095-2104(2006)。
(B)マウスノードの超解像顕微鏡写真。白色が細胞の表面、赤色が動繊毛、黄緑色が不動繊毛を表す。
(C)ノードの断面の模式図(腹側を上にして胚の頭側から見た状態)。ノードの中央にある細胞(灰色)に生えている「動繊毛」という動く繊毛が、斜めに回転運動をすることで周りの体液を左方向へ動かし、ノード流という左向きの流れが生じる(オレンジ色矢印)。一方、ノードのくぼみの左右両側の縁にある細胞(黒色)には、「不動繊毛」という「動かない繊毛」(アンテナ)が存在する(細胞から伸びた黒い棒)。
(D)ノードの左右両側に不動繊毛が存在するが、「なぜ左側の不動繊毛のみが活性化されるのか」そして「どのように不動繊毛が活性化されるのか」はこれまで未解明であった。
不動繊毛の長さはわずか5マイクロメートル(μm、1μmは1,000分の1mm)程度で、直接触れることはおろか、詳細な観察も極めて困難です。こうした技術的制約から、不動繊毛の機能を直接解析することは難しく、これまで不動繊毛の活性化メカニズムとして「化学受容(ノード流で運ばれてくる化学物質を感知)」と「機械刺激受容(流れの力を感知)」の2説が提唱され、論争が続いていました。今回共同研究グループは、光ピンセットや超解像顕微鏡を組み合わせた先進的な光学顕微鏡を用いて、物理的な解析を行うことで、この謎の解明に挑みました。
注1)2020年7月28日プレスリリース「動物の左右決定に関わるカルシウムイオンの役割」
注2)2021年7月30日プレスリリース「体の左右非対称性はmRNAの分解から始まる」
研究手法と成果
(1)ノード流によって、不動繊毛は曲げられていた
ノード流は不動繊毛に何をしているのでしょうか?この問いに答える実験の一つは、ノード流を止めてその影響を見ることです。そこでまず、共同研究グループはノード流を人工的に制御することで、不動繊毛がどのように変形するのか調べました。蛍光タンパク質[7]で不動繊毛を光らせ可視化してから高解像度の光学顕微鏡で撮影することで、不動繊毛の3次元的な形状を取得する技術を開発しました(図2A、B)。さらに、ノード流を生み出す動繊毛の分子モーター[5]を紫外線で破壊する技術を開発し、生体内でノード流を止めることに成功しました。
この二つの技術を組み合わせると、最初にノード流がある状態での不動繊毛の形状を、次に紫外線を照射してノード流を止めた直後の不動繊毛の形状を取得することができます。観察の結果、ノード流によってノードの左側の不動繊毛は腹側に曲げられ、右側の不動繊毛は背側に曲げられるという、不動繊毛の左右非対称な変形が明らかになりました(図2C)。
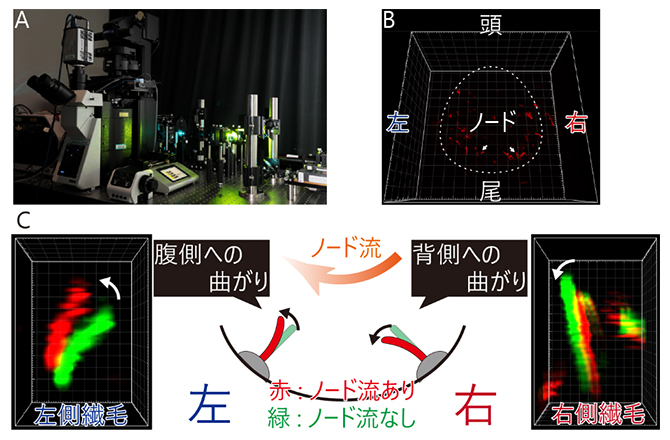
図2 独自に開発した光学顕微鏡システムと、ノード流による不動繊毛の曲がりの観察
(A)独自に開発した光学顕微鏡システム。顕微鏡の上には生命維持装置が組み込まれていて、生きたマウス胚のノードに高精度で紫外線を照射しながら、高解像度で不動繊毛の形状を観察できる。さらに、不動繊毛を操作する光ピンセット(後述)も備える。
(B)Aで撮影した、生きたマウス初期胚でのノード不動繊毛の3次元高解像度画像。このあと、紫外線を照射することにより、ノード流を止めた。白矢印で示した2本の繊毛の拡大図をCに示す。
(C)ノード流により、ノードの左側の不動繊毛は腹側(図では上向き)に、右側の不動繊毛は背側(同下向き)に曲げられていた。模式図はノードの断面図で、腹側を上にして胚の頭側から見た状態。画像は、ノード流が有るとき(赤色)と無いとき(緑色)の不動繊毛の3次元画像を高解像度で取得し、形状を解析した結果。不動繊毛の直径はわずか0.2μmで、一般的な光学顕微鏡では見ることはできない。生きたマウス胚での不動繊毛の「曲がり」を検出することに成功したのは、本研究が世界で初めてである。
(2)不動繊毛を光で「つかむ」ことで、不動繊毛にかかる「力」が「左側を決めるシグナル」を活性化することを発見
このノード流による不動繊毛の曲がりは、「左側を決めるシグナルの活性化」とどのような関係があるのでしょうか?共同研究グループは不動繊毛が流れによって運ばれてくる化学物質ではなく、機械的な力によって曲げられて活性化するのではないかと考え、その実証を試みました。光を使って溶液内の微小物体を「つかむ」技術である光ピンセットを用いて、人工的に不動繊毛を曲げながら左側を決めるシグナルの活性化を測定しました。
光ピンセットでプラスチックの微小粒子(ビーズ)を捕捉し、上下方向にビーズを振動させて不動繊毛に押し当てると、生体内のノード流を模した力を不動繊毛に与えることができます(図3A、B)。この操作を、先天的にノード流を欠失した変異体マウス(iv/iv変異体)の不動繊毛に対して行い、左側を決めるシグナルであるカルシウムイオンのシグナル注1)や、そのシグナルを受けて左側特異的に発現するNodal遺伝子の活性(図3C)などを測定しました。その結果、不動繊毛が腹側に曲がったときにのみ、左側を決めるシグナルが活性化されることを発見しました(図3C、D)。
このことは、ノードの不動繊毛が「機械的な力」で活性化されることを示しただけでなく、不動繊毛が「曲げられる向きを感知するアンテナ」として機能する全く新しいタイプの受容組織であることを示しています。
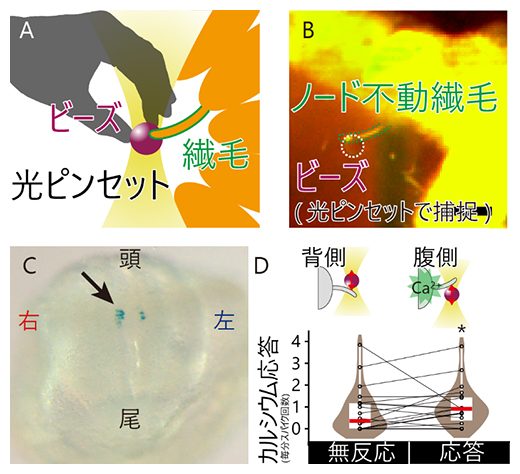
図3 光ピンセットを用いた、不動繊毛への「力」による「左側を決めるシグナル」の活性化
(A)光ピンセットを用いると、顕微鏡で見ているものを、まるで「つかむ」ように操作できる。今回はプラスチックの微小粒子(ビーズ)を捕捉し、不動繊毛に押し当てることで、ノードの不動繊毛1本を曲げることに成功した。
(B)実験中の画像。生きたマウスの初期胚に対し、光ピンセットで「つかんだ」ビーズ(白点線で囲んた円)をノードの不動繊毛に押し当てている。ビーズの直径はわずか4μm。特殊な顕微鏡を使わないと見ることができないミクロの世界での実験である。
(C)光ピンセットで人工的に不動繊毛を曲げて、「左側を決めるシグナル」を活性化させた(矢印で示した青色の領域)。実際の生体内で起こることと逆側の、右側の不動繊毛を曲げると、右側でも「左側を決めるシグナル」が強く活性化された(ノードを腹側から観察した写真)。
(D)同一の不動繊毛(グラフ上の丸)に対して、背側と腹側の曲げを与えたときのカルシウムイオンの応答(左側を決めるシグナルの一つ)を測定した。不動繊毛を腹側に曲げると、その不動繊毛が生えている細胞でのカルシウムイオン応答が有意に増加した(データのばらつきを示す茶色の図形の水平方向の広がりと、平均値を示す赤色の横線で統計的な解析結果を表現)。
(3)不動繊毛は「曲げられる向き」を感知することにより、左右非対称性を決定する
では、なぜ不動繊毛は腹側への曲げのみに応答するのでしょうか?その仕組みを解明するため、まず不動繊毛が曲げられたときにどのような力が働いているのかを、新しく開発した独自の画像解析アルゴリズムにより可視化しました。ノード流が無いときと有るときの不動繊毛の3次元画像(図2C)を比較し、不動繊毛内の各領域がどのように変形するのかを厳密に求めることにより、ノード流によって不動繊毛表面がどのように引っ張られるか(膜張力の分布)を算出しました(図4A)。その結果、ノード流により腹側に曲げられる左側の不動繊毛では、不動繊毛の背側で膜張力が増加していることが明らかになりました。
次に、超解像顕微鏡(3D STED顕微鏡[4])を用いて、不動繊毛表面におけるセンサータンパク質(Pkd2チャネル[8])の分布を3次元的に解析したところ、左右どちらの不動繊毛においても、腹側よりも背側により多く分布していることを発見しました(図4B)。Pkd2チャネルは膜張力の増加で活性化するセンサーと考えられており、不動繊毛内で膜張力が増加する領域にPkd2チャネルが存在する場合のみにセンサーが反応できます(図4C)。そのため、不動繊毛が腹側に曲げられ背側の膜張力が増加する左側の不動繊毛だけがノード流に応答すると考えられます。
以上の結果から、ノードの不動繊毛が「機械刺激を受容するアンテナ」であることが初めて示されただけでなく、
①ノードで生じる左向きのノード流により、左側の不動繊毛は腹側に曲げられ、右側の不動繊毛は背側に曲げられる
②不動繊毛は腹側への曲げのみに反応する「曲げられる向きを感知できるアンテナ」であるため、ノードの左側のみで左側を決定するシグナルが活性化する
ことが、ノード流により左右対称性が破られるメカニズムであることが明らかになりました(図4C)。
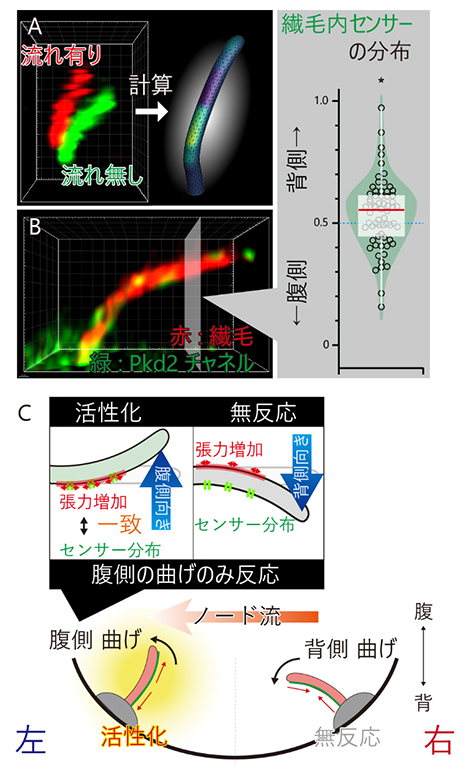
図4 不動繊毛の偏ったセンサータンパク質の分布が左右対称性を破る仕組み
(A)ノード流によって不動繊毛が曲げられたときに不動繊毛に働く力。厳密な計算を行う画像解析アルゴリズムを新たに開発し、実際の3D画像(左)から膜張力を可視化した(右)。膜張力が高くなる領域を黄緑色で表した。
(B)不動繊毛の中にある膜張力のセンサータンパク質(Pkd2チャネル)を、超解像顕微鏡により可視化した(左)。3次元的にセンサータンパク質の分布を調べたところ、背側に偏って多く存在することを発見した(右)。
(C)今回の研究で明らかになった、左右対称性が破られるメカニズム。不動繊毛の中のセンサータンパク質の分布と、膜張力が増加する領域が一致した場合のみ、すなわち不動繊毛が腹側に曲げられたときのみ、不動繊毛は活性化する(上)。左向きのノード流は左側の不動繊毛のみを腹側に曲げるため、左側のみでシグナルが活性化する(下)。
今後の期待
本研究により、左右非対称性の決定メカニズムにおける残された重要な謎の一つが解かれ、私たちの体がどのように作られるのかという発生学的問いに対する理解を一歩深めることができました。一方で、「曲げられる向きを感知するアンテナ」を実現するのに必須な膜張力のセンサータンパク質(Pkd2チャネル)の偏りがどのように作られるのかは不明です。さらに左右非対称性が決定された後に、その情報を利用して正確な位置に正確な形状の臓器を形成していく過程には未解明な点が多く、今後の研究の進展が望まれます。
生体組織内に生じる機械的な力により細胞や組織が制御されるメカニズムの研究は、世界的にみても始まったばかりです。今後、共同研究グループは本研究で開発した顕微鏡技術・解析技術を応用し、生体内での力学的シグナルが関与する生命機能制御の解明を進めていきます。
補足説明
1.ノード
哺乳類において、左右非対称性を決定する機能を持つことが知られている胚の部位。「左側を決めるシグナル」を活性化することにより、左右非対称性を決定する。マウスの場合は受精後7.5日目に、胚の腹側(へその辺り)に一過的に生じる。お椀のようなくぼみの形をしており、繊毛を持つ細胞が存在する。
2.左側を決めるシグナル
初期胚には、1996年に大阪大学の濱田研究室などから報告されたLefty遺伝子をはじめ左側だけに発現する遺伝子が存在し、そうした遺伝子により左右非対称性が決定される。これまでの研究から、左側のノード不動繊毛や細胞で右側と比べてより活発なカルシウムイオンシグナルが見られることや、Dand5遺伝子のmRNAの分解が左側だけで起こること、Nodal遺伝子の活性が左側だけで高くなることなど、左側を決定するメカニズムが明らかにされてきた。一方で、なぜ左側だけで「左側を決めるシグナル」が活性化するのかは分かっていなかった。
3.光ピンセット
2018年にノーベル物理学賞の対象となった、光を使って溶液内の微粒子を「つかむ」技術。溶液中で強いレーザー光(赤外線レーザーを使用することが多い)を極限まで集光させて、溶液に対して屈折率の異なる微粒子を近づけると、運動量の変化から粒子を捕捉できる。
4.超解像顕微鏡、STED顕微鏡
超解像顕微鏡は2014年にノーベル化学賞の対象となった技術。通常の光学顕微鏡では、光の回折の影響により、200ナノメートル(nm、1nmは10億分の1メートル)以下の解像度を実現することはできない。STED顕微鏡(誘導放出抑制顕微鏡)は誘導放出という現象を巧みに使用することにより、従来に比べて10倍以上高い数十nmの解像度を実現した。STEDはStimulated emission depletion microscopyの略。
5.ノード流、動繊毛、分子モーター
ノードのお椀の中には体液の左向きの流れが存在しており、ノード流と呼ばれる。ノード流は、分子モーターと呼ばれる動くタンパク質によって駆動された動繊毛が回転して、水をかき出すことにより生まれる。ノード流の向きは左右非対称性の決定に重要で、ノード流の下流側(左側)で左側を決めるシグナルが活性化される。
6.不動繊毛
細胞から生えた、長さわずか5μm程度の動かない繊毛。多くは一つの細胞から1本だけ生えている。従来その機能はあまり分かっていなかったが、近年になって細胞外の化学物質を受容したり、流れを受容するアンテナのような働きをすることが明らかになってきている。不動繊毛は腎臓や肝臓などさまざまな臓器の細胞にも見られるが、その詳細な機能については現在も研究途上である。本研究によって初めてノードの不動繊毛の機能が明らかにされた。
7.蛍光タンパク質
特定の波長の光(励起光)を照射すると、蛍光を発するタンパク質の総称。2008年にノーベル化学賞を受賞した、下村脩博士の緑色蛍光タンパク質 (GFP)が有名。本研究では、人工的に改変した超高輝度の蛍光タンパク質であるmNeonGreenを使用した。
8.Pkd2チャネル
多発性嚢胞腎の原因となるタンパク質として知られる。近年の研究から、細胞膜上に存在して、複数の分子が集まることにより「穴」状の構造を作っていて、膜の電位変化などの刺激に応答して陽イオンを透過させることが示唆されている(電位依存性陽イオンチャネル)。2012年に濱田研究室によって、Pkd2タンパク質がノードの不動繊毛に存在し、不動繊毛のPkd2チャネルが左右軸決定に関与していることが明らかになった。
共同研究グループ
理化学研究所 生命機能科学研究センター
個体パターニング研究チーム
チームリーダー 濱田 博司(ハマダ・ヒロシ)
基礎科学特別研究員 加藤 孝信(カトウ・タカノブ)
研究員(研究当時)水野 克俊(ミズノ・カツトシ)
(現 客員研究員、福井大学 学術研究院医学系部門医学領域 助教)
研究員(研究当時)峰岸 かつら(ミネギシ・カツラ)
(現 客員研究員、国立精神・神経医療研究センター 神経研究所 遺伝子疾患治療研究部 室長)
テクニカルスタッフⅠ サイ・ショウレイ(Sai Xiaorei)
テクニカルスタッフⅠ 井川 弥生(イカワ・ヤヨイ)
テクニカルスタッフⅠ 西村 博美(ニシムラ・ヒロミ)
テクニカルスタッフⅠ 梶川 絵理子(カジカワ・エリコ)
テクニカルスタッフⅡ イベル・シルバン・ジャン・ビクトール(Hiver Sylvain Jean Victor)
細胞極性統御研究チーム
チームリーダー 岡田 康志(オカダ・ヤスシ)
細胞場構造研究チーム
チームリーダー 岩根 敦子(イワネ・アツコ)
客員研究員 板橋 岳志(イタバシ・タケシ)
東北大学
大学院医工学研究科 医工学専攻
教授 石川 拓司(イシカワ・タクジ)
大学院工学研究科 ファインメカニクス専攻
助教 大森 俊宏(オオモリ・トシヒロ)
学習院大学 理学部 物理学科
教授 西坂 崇之(ニシザカ・タカユキ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、基礎科学特別研究員研究費(加藤孝信)、同科技ハブ産連本部(RCSTI)(岩根敦子))で実施し、科学技術振興機構(JST)戦略的創造研究推進事業CREST「生命動態の理解と制御のための基盤技術の創出(研究総括:山本雅)」「細胞機能を担う超分子複合体の原子分解能ダイナミクス(研究代表者:濡木理)」「超解像3次元ライブイメージングによるゲノムDNAの構造、エピゲノム状態、転写因子動態の経時的計測と操作(研究代表者:岡田康志)」「オールオプティカルメカノバイオロジーの創出に向けた技術開発と発生生物学への応用(研究代表者:倉永英里奈)」、同戦略的創造研究推進事業さきがけ「体の左右非対称を形成する力学的な機構の解明(研究代表者:大森俊宏)」、同ムーンショット型研究開発事業「ウイルス-人体相互作用ネットワークの理解と制御(研究代表者:松浦善治)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「形態の非対称性の起源(研究代表者:濱田博司)」、同若手研究「一次繊毛における新規機構「分子コンバータ」システムの解明(研究代表者:加藤孝信)」、同基盤研究(S)「生物系アクティブマターの予測と制御を目指した移動現象論の構築(研究代表者:石川拓司)」、同学術変革領域研究(A)「環境連成力学を基盤とした微生物行動シミュレータの開発(研究代表者:石川拓司)」、同新学術領域研究「情報物理学でひもとく生命の秩序と設計原理(領域代表者:岡田康志)」「先端バイオイメージング支援プラットフォーム(領域代表者:狩野方伸)」による助成を受けて行われました。
原論文情報
Takanobu A. Katoh, Toshihiro Omori, Katsutoshi Mizuno, Xiaorei Sai, Katsura Minegishi, Yayoi Ikawa, Hiromi Nishimura, Takeshi Itabashi, Eriko Kajikawa, Sylvain Hiver, Atsuko H. Iwane, Takuji Ishikawa, Yasushi Okada, Takayuki Nishizaka, Hiroshi Hamada, “Immotile cilia mechanically sense the direction of fluid flow for left-right determination”, Science, 10.1126/science.abq8148
発表者
理化学研究所
生命機能科学研究センター 個体パターニング研究チーム
チームリーダー 濱田 博司(ハマダ・ヒロシ)
基礎科学特別研究員 加藤 孝信(カトウ・タカノブ)
細胞極性統御研究チーム
チームリーダー 岡田 康志(オカダ・ヤスシ)
細胞場構造研究チーム
チームリーダー 岩根 敦子(イワネ・アツコ)
報道担当
理化学研究所 広報室 報道担当
東北大学大学院 工学研究科 情報広報室
学習院大学 学長室広報センター