2023-02-16 アストロバイオロジーセンター,高エネルギー加速研究機構,東北大学,基礎生物学研究所,兵庫県立大学,国立極地研究所,中央大学
発表のポイント
- 植物や藻類は一般的に、太陽光にふくまれる光の中でも可視光しか光合成に利用することができない。南極に繁殖するある藻類は赤外線を光合成に利用することができるが、その仕組みはわかっていなかった。
- その藻類が赤外線で光合成をするために使われるタンパク質の構造を、クライオ電子顕微鏡と呼ばれる装置で明らかにした。
- 太陽系外で見つかっている惑星の多くは、太陽より温度が低く主に赤外線を出す恒星の周りにあり、赤外線を光合成に利用する生命の可能性が示唆されている。今回の成果は、そうした生命の可能性を探る手掛かりかもしれない。
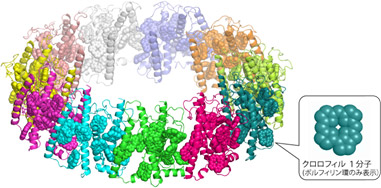
図1:Pc-frLHCの立体構造分子モデル
ひとつひとつのタンパク質を異なる色で示した。それぞれのタンパク質に11個のクロロフィル分子(球体で示した分子)が結合している。タンパク質部分は、リボン図で表している。(クレジット:アストロバイオロジーセンター)
研究の概要
アストロバイオロジーセンターの小杉真貴子特任研究員(現、基礎生物学研究所 特任助教、および中央大学共同研究員)、国立極地研究所の工藤栄教授らの研究チームは、赤外線の一部である遠赤色光(700〜800nm)で酸素発生型の光合成を行うことが知られている緑藻ナンキョクカワノリにおいて、遠赤色光を吸収するための光捕集アンテナタンパク質(Pc-frLHC)を同定し、KEKにあるクライオ電子顕微鏡による単粒子解析(注釈1)によりその分子の立体構造を明らかにしました。Pc-frLHCは11個の同じタンパク質がリング状に結合した大きな複合体を作っていました(図1)。1つのタンパク質にそれぞれ11個のクロロフィルが結合しており、このうちの5つのクロロフィルが遠赤色光の吸収に関わる特別なクロロフィルであると示唆されました。分光学的な解析から、この特別なクロロフィルに吸収された遠赤色光のエネルギーの一部がPc-frLHC内で可視光と同等のエネルギーに変換されて光合成利用されていることを示しました。この結果は、英国の科学誌『Nature Communications』に2023年2月15日付で掲載されました(Kosugi et al., 2023, “Uphill energy transfer mechanism for photosynthesis in an Antarctic alga”)。
研究の背景
植物や藻類が行う光合成は、太陽光に含まれる可視光(350~700nm)のエネルギーを使って水を酸素と水素と電子とに分解し、そこで得られた還元力が二酸化炭素の同化に利用されます。700nmより長波長の光は赤外線と呼ばれますが、赤外線は可視光に比べてエネルギーが低いため通常は水の分解に利用されることがありません。これまでに一部のシアノバクテリア(注釈2)で赤外線を利用した光合成を行うことが知られており解析が進められて来ましたが、植物や藻類などの真核の光合成生物(注釈2)では解析が進んでいませんでした。
アストロバイオロジーセンターの小杉(現、基礎生物学研究所)らは南極の陸上に生育する真核光合成生物である緑藻のナンキョクカワノリが赤外線の一部である遠赤色光(700~800nm)を使って可視光と同じくらいエネルギー変換効率のよい光合成を行っていることを最近明らかにしていました(Kosugi et al. 2020)。南極の陸上環境は気温が低く頻繁に凍結し、極めて乾燥しています。それに加えて夏の間は非常に強い紫外線が降り注ぐため生物の多くは生存することができません。ナンキョクカワノリは乾燥や凍結に非常に強く、カラカラに乾燥しても長期冷凍しても水をかけるとすぐに代謝活性を回復させることができます。こうした性質により、南極の陸上環境で生育できる数少ない光合成生物のひとつとなっています。ナンキョクカワノリは細胞が何層にも重なったコロニー(集合体)を形成しています(図2)。

図2:南極・昭和基地周辺(右図☆印)の露岩に形成されたナンキョクカワノリのコロニー。現地の夏の時期、第54次南極地域観測隊の活動中に撮影、比較用の物差しは23cm。(クレジット:アストロバイオロジーセンター)
コロニーの表層付近では太陽光が十分に届くため可視光を光合成に使うことができますが、太陽光に含まれる紫外線により細胞がダメージを受けるデメリットもあります。一方でコロニーの下層側では紫外線のダメージを受ける可能性が減りますが、可視光は表層側の藻が吸収して光合成に利用するためほとんど届かず、表層側の藻が利用しない赤外線の割合が多い環境となります。ナンキョクカワノリは赤外線を光合成に利用するシステムを進化の過程で獲得し、コロニー下層の光合成量を増加させることで、南極という非常に厳しい環境でも繁殖することができたと考えられます(図3)。
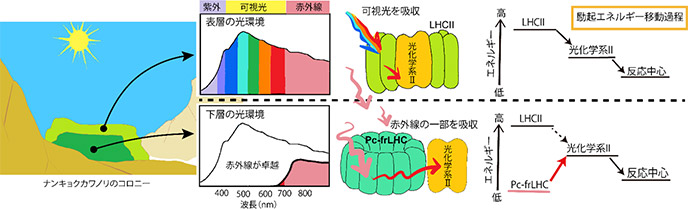
図3:ナンキョクカワノリコロニーの表層と下層における光環境と光合成システムの違い。(クレジット:アストロバイオロジーセンター)
赤外線を光合成に利用できる生物の存在は、アストロバイオロジー(宇宙生物学)の分野でも注目されています。それは、これまでに発見された系外惑星の多くが、太陽よりも暗く可視光より赤外線の割合が多い低温度星の周りにあるためです(注釈3)。光合成生物が大気中に放出する酸素は、系外惑星に生物が存在するかどうかを調べる際に地球からも観測が可能な生命の痕跡のひとつと考えられています。地球における赤外線を利用する光合成のメカニズムや進化のプロセスを明らかにすることは、低温度星周りの系外惑星における酸素の検出可能性を議論する上で重要です。また、ナンキョクカワノリの赤外線利用型光合成は低いエネルギーで高いエネルギーレベルにある分子を励起するアップヒル型のエネルギー移動(注釈4)を含んでいることが示唆されており、高い光利用効率を実現するメカニズムにはこれまでに知られていない量子生物学的反応が含まれている可能性があります。そこで、ナンキョクカワノリから赤外線捕集アンテナタンパク質を精製して同定し、その分子構造を明らかにすることで赤外線利用型光合成のメカニズムを解明することを目指しました。
研究の成果
実験に用いたナンキョクカワノリは第49次および第54次南極地域観測隊の活動中に採集されました。ナンキョクカワノリの細胞を破砕し、タンパク質のサイズや電荷の違いで分けることにより、遠赤色光に顕著な吸収帯を持つタンパク質を精製しPc-frLHC(Prasiola crispa far-red light harvesting Chl-binding protein complex)と名前を付けました。タンパク質を構成するアミノ酸の並び方を解析した結果、Pc-frLHCは植物や緑藻が持つ光捕集アンテナタンパク質の中でも一部の緑藻の光化学系I(注釈5)に結合する4回膜貫通型(注釈6)のLHCI(Light harvesting chlorophyll a/b binding complex of photosystem I)に最も似ていることが分かりました。この4回膜貫通型LHCIは緑藻のクラミドモナスにおいて最も長波長の可視光を吸収することが報告されていますが、遠赤色光はほとんど吸収できません(Mozzo et al. 2010)。更にPc-frLHCは光化学系Iではなく水分解を行う光化学系II(注釈5)のアンテナとして機能していることから、緑藻がもともと持っている長波長吸収型のLHCの吸収帯が更に長波長へ移動し光化学系IIのアンテナとして進化したものと考えられました。
クライオ電子顕微鏡による単粒子解析では、Pc-frLHCの3次元立体構造分子モデルを高い分解能で得ることに成功しました。緑藻の一般的な光化学系IIアンテナタンパク質は3つのタンパク質が結合した構造ですが、今回解析を行ったPc-frLHCは11個のタンパク質がリング状に結合しており、新規の複合体構造です(図4)。1つのタンパク質に11個のクロロフィルが結合し、リング内のすべてのクロロフィルがエネルギーの受け渡しが可能な距離に存在し、エネルギー的に繋がったネットワークを形成していることが分かりました。通常、クロロフィルは可視光を吸収しますが、複数のクロロフィル分子が互いに近づいて相互作用すると、吸収帯の一部が長波長側へ移動することが知られています。比較的長波長の光を吸収できるクラミドモナスの4回膜貫通型LHCIでは2つのクロロフィルが接近していることが報告されていますが(Mozzo et al. 2010)、Pc-frLHCではこの2つのクロロフィルに更に別のクロロフィルが接近し、5つのクロロフィルが強く相互作用していることが分かりました。このクロロフィル構造がPc-frLHCの遠赤色光吸収を起こしていると考えられました。
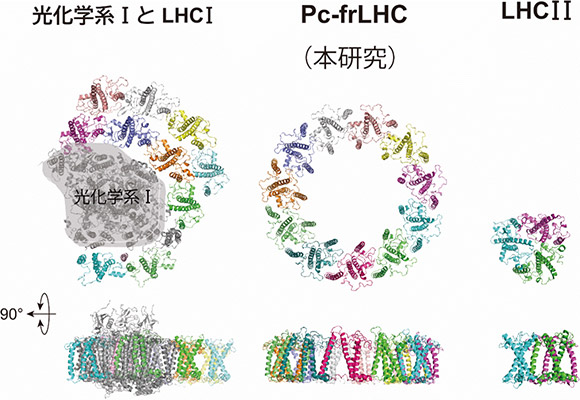
図4:緑藻における光合成光捕集アンテナタンパク質の構造の比較
光化学系Iとその周りに結合するLHCI(左、プロテインデータバンクID:6jo5、Suga et al. 2019 Nature Plants 5: 626-636)、本研究で明らかになった遠赤色光捕集タンパク質(中央)および光化学系IIの可視光捕集タンパク質であるLHCII(右、プロテインデータバンクID:1rwt、Liu et al. 2004. Nature 428: 287-292)。(クレジット:アストロバイオロジーセンター)
Pc-frLHCに吸収された遠赤色光エネルギーの移動過程を理解するため、遠赤色光の超短パルスレーザーでPc-frLHCの長波長吸収型のクロロフィルを励起し、クロロフィル蛍光(注釈7)がどのように時間とともに変化するかを調べました。この時、長波長吸収型クロロフィルからの蛍光は713nm、通常のクロロフィルからの蛍光は680nmに検出されます。680nmの蛍光が時間とともにどのように増加するかを調べることで、長波長吸収型クロロフィルと通常のクロロフィルの間でエネルギーが25ピコ秒(=0.000000025秒)以内に行ったり来たりしていることがわかってきました。この結果から、長波長吸収型クロロフィルから通常のクロロフィルへのアップヒル型の励起エネルギー移動がPc-frLHC内で確かに起きていることが示されました。この過程で遠赤色光のエネルギーの一部が可視光のエネルギーに変換され、その後の光合成反応が可視光を吸収した場合と同様に進むと考えられます。
今後の展望
- アップヒル型励起エネルギー移動の詳細を解明
遠赤色光による光化学系IIの高い励起効率の全容を明らかにするためには、Pc-frLHCから光化学系IIへのエネルギー移動の詳細を解析する必要があります。そこでPc-frLHCと光化学系IIが結合した状態の超複合体をナンキョクカワノリの細胞から精製し、その励起エネルギー移動過程の解明を目指します。 - 遠赤色光利用型の酸素発生型光合成生物の進化学的側面
タンパク質の同定や構造解析はなされていないものの、ナンキョクカワノリの他にも顕著な遠赤色光吸収帯を持つ真核の藻類が複数報告されていることから、今回ナンキョクカワノリに見つかったPc-frLHCと同様の遠赤色光吸収型光捕集タンパク質が、他の真核藻類にも存在している可能性があります。様々な藻類における遠赤色光利用型の光捕集タンパク質のアミノ酸配列を取得し、その進化系統を明らかにするとともに、遠赤色光利用のメカニズムの相同性や多様性について解析します。 - アストロバイオロジー的側面
太陽系外惑星をターゲットとした生命探査は、次世代超大型望遠鏡の開発と共に今後大きく進展すると期待されています。観測可能な生物の痕跡(バイオシグニチャー)として有力視されている酸素ですが、低温度星周りの系外惑星に『光合成由来の』酸素が検出される可能性はあるのでしょうか。地球上に存在する赤外線による酸素発生型光合成の詳細を明らかにすることで、低温度星周りの系外惑星における光合成生物進化の可能性を探ります。
脚注
1)クライオ電子顕微鏡による単粒子解析:近年急速に発展を遂げた、タンパク質の構造解析技術。従来のX線によるタンパク質構造解析はタンパク質の結晶が必要だがクライオ電子顕微鏡ではその必要が無く、結晶化が難しいサンプルや今回の南極由来生物のように少量しか得られないサンプルでも解析が容易になった。
2)シアノバクテリアと真核の光合成生物:シアノバクテリアは最も原始的な酸素発生型光合成生物で葉緑体の祖先と考えられている。シアノバクテリアが細胞内共生し、進化したものが真核の光合成生物である藻類や植物である。遠赤色光で光合成を行うメカニズムは、シアノバクテリアと真核光合成生物では異なっており、その両方を明らかにすることが重要である。
3)低温度星:太陽(G型)より軽く温度の低い恒星でM型矮星とも言われる。宇宙に存在する恒星の中で割合が圧倒的に多いことから生命探査の重要な対象とされている。可視光より赤外線の割合が多いため、周りの系外惑星の環境も赤外線が卓越する。
4)アップヒル型励起エネルギー移動:クロロフィル分子間の励起エネルギー移動は、通常高いエネルギーレベルの分子から低いエネルギーレベルの分子へ渡されるが、この逆反応をアップヒル型励起エネルギー移動と呼ぶ。アップヒル型励起エネルギー移動は熱エネルギーによって分子間のエネルギー差が補填された場合に起こるとされている。
5)光化学系Iおよび光化学系II:葉緑体のチラコイド膜に存在する電子伝達系に関わるタンパク質。光エネルギーで電荷分離を起こす特別なクロロフィル反応中心を持つ。光化学系IIは水を分解し、光化学系Iは光化学系IIから受け取った電子のエネルギーレベルを二酸化炭素の固定に必要となる電子伝達体を還元できるレベルにまで高める。光化学系IIの励起には、光化学系Iより短波長の高い光エネルギーが必要とされる。
6)4回膜貫通型LHC:藻類の光捕集アンテナタンパク質の多くは葉緑体の中にあるチラコイド膜と呼ばれる脂質2重層に折りたたまれて埋め込まれた形で存在する。折りたたまれた数により膜を貫通する回数が変わる。
7)クロロフィル蛍光:光を受けて電子励起したクロロフィルがエネルギーの低い状態になるときに発する光。
論文情報
掲載誌:Nature Communications
タイトル:Uphill energy transfer mechanism for photosynthesis in an Antarctic alga
著者:
小杉 真貴子、川崎 政人、柴田 穣、原 光二郎、高市 真一、守屋 俊夫、安達 成彦、亀井 保博、菓子野 康浩、工藤 栄、小池 裕幸、千田 俊哉
DOI:10.1038/s41467-023-36245-1
URL:https://www.nature.com/articles/s41467-023-36245-1
お問い合わせ先
(研究成果について)
自然科学研究機構基礎生物学研究所 特任助教 小杉 真貴子(こすぎ まきこ)
(報道について)
自然科学研究機構アストロバイオロジーセンター 特任専門員 日下部 展彦(くさかべ のぶひこ)