LMUの研究者は、Mot1酵素による転写因子TBPのDNAからの置換過程を詳細に示した。 LMU researchers show detailed displacement process of TBP transcription factor from DNA by Mot1 enzyme.
2023-04-27 ミュンヘン大学(LMU)
LMUのミュンヘン遺伝子センター所長であるカール・ペーター・ホプフナー教授が率いる科学者たちは、これまで正確に理解されていなかったこの置換プロセスの詳細を解明した。研究チームは、極低温電子顕微鏡を用いて、リモデリング反応のさまざまな「スナップショット」を作成した。これにより、TBPの置換過程の構造的な詳細を3次元構造モデルで可視化することができた。Mot1は、TBPの近くに位置するDNAを1回または複数回に分けて掴み、TBPが変位するまで曲げたりねじったりしながら、DNAへの再結合を防いでいる。
<関連情報>
- https://www.lmu.de/en/newsroom/news-overview/news/structural-insight-into-process-of-gene-regulation.html
- https://www.nature.com/articles/s41594-023-00966-0
Swi2/Snf2 ATPase Mot1によるTATAボックスDNAからのTBPの置換の構造的基礎 Structural basis for TBP displacement from TATA box DNA by the Swi2/Snf2 ATPase Mot1
Stephan Woike,Sebastian Eustermann,James Jung,Simon Josef Wenzl,Götz Hagemann,Joseph Bartho,Katja Lammens,Agata Butryn,Franz Herzog & Karl-Peter Hopfner
Nature Structural & Molecular Biology Published:27 April 2023
DOI:https://doi.org/10.1038/s41594-023-00966-0
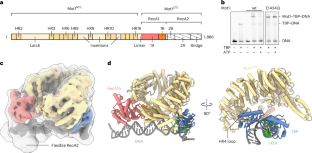
Abstract
The Swi2/Snf2 family transcription regulator Modifier of Transcription 1 (Mot1) uses adenosine triphosphate (ATP) to dissociate and reallocate the TATA box-binding protein (TBP) from and between promoters. To reveal how Mot1 removes TBP from TATA box DNA, we determined cryogenic electron microscopy structures that capture different states of the remodeling reaction. The resulting molecular video reveals how Mot1 dissociates TBP in a process that, intriguingly, does not require DNA groove tracking. Instead, the motor grips DNA in the presence of ATP and swings back after ATP hydrolysis, moving TBP to a thermodynamically less stable position on DNA. Dislodged TBP is trapped by a chaperone element that blocks TBP’s DNA binding site. Our results show how Swi2/Snf2 proteins can remodel protein–DNA complexes through DNA bending without processive DNA tracking and reveal mechanistic similarities to RNA gripping DEAD box helicases and RIG-I-like immune sensors.

