2023-06-08 東京大学
小林 和弘(大学院総合文化研究科 特任研究員/研究当時:生物科学専攻 博士課程)
川上 耕季(日本学術振興会特別研究員/研究当時:東北大学 助教)
草木迫 司(生物科学専攻 助教)
井上 飛鳥(東北大学 教授)
村田 武士(千葉大学 教授)
濡木 理(生物科学専攻 教授)
発表のポイント
- クライオ電子顕微鏡を用いた構造研究により、副甲状腺ホルモン1型受容体(PTH1R)作動薬のPCO371が結合するユニークな部位を見出しました。
- PCO371はGタンパク質共役型受容体(GPCR)に共通した細胞外領域を起点とした活性化様式を誘導せず、細胞内領域を直接活性化構造に誘導するとともに、受容体と三量体Gタンパク質を接着させるという新規の受容体活性化様式を持っていることが明らかになりました。
- PCO371結合型PTH1Rはβアレスチンと結合しないことから、細胞内ポケットの形状を制御することで異なる種類のシグナル伝達を切り分けることが可能であることが明らかになりました。
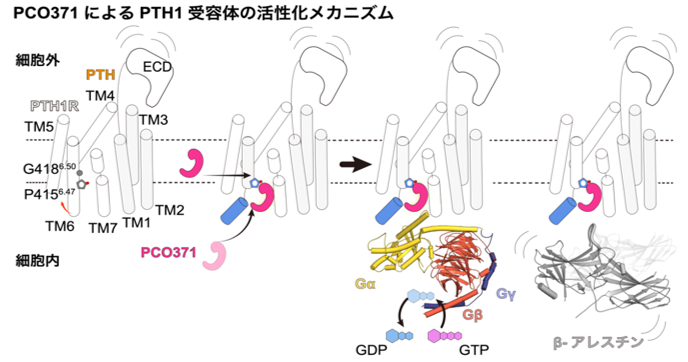
PCO371によるPTH1Rの活性化メカニズム
発表概要
東京大学大学院理学系研究科の小林和弘博士課程学生(当時)、草木迫司助教、濡木理教授らの研究グループは、クライオ電子顕微鏡を用いた単粒子解析(注1)により、PCO371(注2)と結合したPTH1R及び三量体Gsタンパク質の立体構造を明らかにしました。Gタンパク質共役型受容体(GPCR)(注3)は生物の細胞膜に存在する7回膜貫通型の受容体タンパク質であり、最大の創薬標的となるタンパク質群です。一般にGPCRは、その細胞外領域にリガンド(注4)が結合することで、活性化型構造へと変化し、その構造変化を感知して細胞内に三量体Gタンパク質(注5)及びβアレスチンを結合させシグナル(注6)を伝達します。近年、特定のシグナル伝達のみを誘導できる“バイアス型作動薬”(注7)が開発され、薬剤の主作用と副作用を分離する方法論が期待されています。本研究の対象である副甲状腺ホルモン1型受容体(PTH1R)(注8)では、Gsタンパク質は薬効に関わる一方で、βアレスチンは副作用を生み出すことが知られており、Gsタンパク質選択的作動薬の開発が期待されています。本研究では低分子作動薬PCO371と結合したPTH1R及びGsタンパク質からなるシグナル伝達複合体の立体構造解析を行いました。その結果、PCO371がこれまでGPCRで報告されていない細胞内の薬剤ポケットに結合していることがわかりました(図1)。また、PCO371はPTH1Rに加えてGsタンパク質とも結合しており、2つのタンパク質をノリのように接合させる結合様式を持つことが明らかになりました(図1)。得られた構造に基づいて変異体機能解析を行ったところ、PCO371はGPCRに保存された細胞外の構造変化を起点とする共通の活性化メカニズムを介さず、細胞内に進入し、PTH1Rの細胞内ポケットを直接開口させるという新規の受容体活性化メカニズムを持つことを見出しました。これは、低分子薬物を用いてGPCRの細胞内領域を直接制御して、特定の下流のシグナルタンパク質を活性化するという手法論が可能であることを示します(図2)。また、PTH1Rのシグナル解析から、PCO371は三量体Gタンパク質のみを選択的に活性化する一方で、βアレスチンは全く活性化しないことを見出しました(図3)。PTH1Rがβアレスチンを介して副作用を生み出すことを踏まえると、このPCO371の薬剤プロファイルはPTH1Rを介した薬剤開発に適したものであり、細胞内領域に着目して薬剤を開発することにより、直接的バイアス型作動薬を開発することが可能であることが示唆されました。
この研究成果により、細胞内の新規薬剤ポケット領域を狙った薬剤開発及びバイアス型作動薬機構の分子基盤が提供されたため、細胞内領域を狙った薬剤開発及び副作用を軽減した薬剤開発への全く異なる創薬アプローチが可能になると期待されます。
発表内容
<研究の背景>
GPCRは生物の細胞膜に存在するシグナル伝達タンパク質であり、ヒトにおいては約800種と最大の遺伝子ファミリーを形成することで多様な生命現象を制御しています。このような側面から、既存の医薬品の約30%がGPCRの活性化状態を調節するものであり、GPCRを標的とした医薬品の改良・新規医薬品の開発が注目されています。GPCRは細胞外に特定のリガンドを結合させることで活性化し、細胞内領域へと連続した構造変化を惹起し、細胞内の三量体Gタンパク質及びβアレスチンへとシグナルを伝達する共通のメカニズムが存在します。これまでに数多の薬剤が開発され、構造解析を介してその共通した細胞外領域から細胞内領域へのシグナル変換メカニズムが明らかになってきました。天然のリガンドはこれら2つのシグナルそれぞれを強く活性化する一方で、薬効に関わるシグナルは通常一部であることから、それ以外のシグナルの活性化は副作用につながります。逆に、特定のシグナルを活性化するリガンド“バイアス型作動薬”は副作用のリスクを抑えて薬効を発揮できることが期待されています。このようなバイアス型作動薬の創薬については、低分子の内因性リガンドを受容するGPCRにおいては成功例がありましたが、class B1 GPCR(注9)を始めとした比較的大きなリガンド(主にペプチドリガンド)を受容するGPCRでは薬剤の改良が難しいことから有用なバイアス型作動薬の開発方針は存在しておりませんでした。また、GPCRのリガンドは細胞外に結合しており間接的に細胞内領域の立体構造を制御するため、直観的に解釈可能なバイアスドリガンドの薬剤設計方針は存在しませんでした。
<研究の内容>
当研究グループは、非ペプチド性作動薬PCO371とその標的受容体であるPTH1R、そしてPTH1Rの生理的結合パートナーであるGsタンパク質に着目し、クライオ電子顕微鏡を用いた単粒子解析により、PCO371と結合したPTH1R及び三量体Gsタンパク質の立体構造を明らかにしました(図1)。過去の研究では、PCO371はPTH1Rの細胞外領域に結合するものと推定されていましたが、今回の構造解析からはPCO371は細胞内領域に結合していることがわかりました。さらに、このPCO371はPTH1R及びGsタンパク質を接着させるような結合様式を持つことが明らかになりました(図1)。
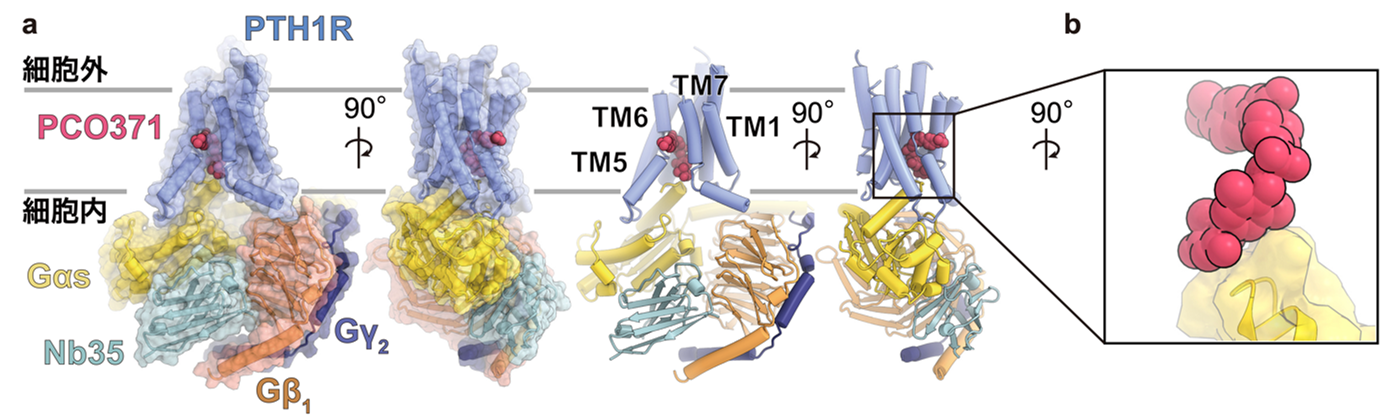
図1:PCO371受容体のシグナル伝達複合体の全体構造
(a) PCO371結合型PTH1RとGsタンパク質のシグナル伝達複合体の全体構造を表している。Gsタンパク質はGαs, Gβ1, Gγ2の三量体から構成されており、今回の研究ではPCO371がPTH1Rに加えGαsと共結合する新規の結合様式が示された。
(b) 受容体に加えGタンパク質とも直接結合する新規の結合様式を表している。
このPCO371結合ポケットは、これまで他のGPCRにおいて相同な部位は報告されておらず、極めてユニークな位置であることがわかりました。PCO371は細胞膜を透過し直接このポケットに結合することで、細胞内領域のみを活性化構造に遷移させることが考えられます(図2)。

図2:PCO371の持つ新規の受容体活性化様式
申請者らがこれまでに明らかにした内在性作動薬PTH及び本研究により明らかになったPCO371によるPTH1Rの活性化様式を比較している。PTHは細胞外領域に結合し、GPCRに保存された細胞外領域から細胞内領域に向かった連続した構造変化を誘導し、Gタンパク質及びβ-アレスチンを活性化する。その一方で、PCO371はPTH1Rの細胞内領域に直接侵入し、受容体の細胞内領域のみを直接活性化構造に変化させる。
すなわち、PCO371はこれまで全てのGPCR作動薬が利用していた細胞外領域から細胞内領域への保存された活性化機構ではなく、細胞内領域のみを直接的に活性化構造へと遷移させるという新規の活性化様式を持つことが示唆されました。また、PCO371はTM6を大きく開口させ三量体Gタンパク質選択的な受容体の立体構造を保持していました(図3)。これまでの研究から、GPCRはその第6膜貫通ヘリックス(TM6)が大きく開口することで三量体Gタンパク質を選択的に結合させ、TM6が小さく開口することでβアレスチンを選択的に結合させることが知られています。東北大学大学院薬学研究科の川上耕季助教(研究当時)、井上飛鳥教授らは、これらの構造に基づく変異体PTH1Rの機能解析を実施し、PCO371は細胞外領域に依存せず直接的に細胞内領域を活性化させることを実証するとともに、三量体Gタンパク質に対して選択的な活性化能を持つバイアスドリガンドであることを明らかにしました(図3)。

図3:PCO371によるバイアスドシグナリングメカニズム
(a) 同一受容体に対するGsタンパク質結合型構造及びβ-アレスチン結合型構造とPCO371結合型PTH1Rの構造比較を表している。PCO371結合型PTH1Rの第6膜貫通ヘリックス(TM6)は、受容体外向きに向かって大きく開口した状態で固定されており、Gタンパク質結合に適した大きなポケットを作り出している。このPCO371の結合様式は受容体がβ-アレスチンに適した小さなポケットを形成することを妨げており、β-アレスチンと親密な結合を作り出すことができない。
(b) PTH及びPCO371によるGsタンパク質(左図)及びβ-アレスチン(右図)の活性評価を表している。PCO371はGsタンパク質を活性化する一方で、β-アレスチンは全く活性化しない。
さらに、研究グループはPCO371の結合ポケットを構成するアミノ酸残基が多くのclass B1 GPCRに保存されていることを見出し、機能解析の結果、PCO371は15個中7個のclass B1 GPCRに対して作動活性を示すことを明らかにしました(図4)。class B1 GPCRは一般的にβアレスチンを介して副作用を生じること、このような多数の受容体に保存された共通のポケットはこれまで発見されていなかったことを踏まえると、本研究によって明らかになった薬剤ポケットは大半のclass B1 GPCRに対して副作用のない薬剤開発に役立つものであると考えられます。
本研究はGPCRの長い歴史に新たな1ページを記すものであり、GPCRの薬剤開発において、新しい可能性を提案するものであります。

図4:PCO371により活性化されるclass B1 GPCR
PCO371の結合していた新規細胞内ポケットはclass B1 GPCRに広く保存されていることが明らかとなった(左図)。そこで、全class B1 GPCRに対しPCO371によるGsタンパク質の活性機能評価を行ったところ、約半数のclass B1 GPCRがPCO371により活性化され、Gsタンパク質へとシグナル伝達が可能であることが明らかになった(右図)。
<今後の展望>
本研究は、立体構造解析、計算機シミュレーション、培養細胞の機能解析を組み合わせることで、細胞内領域の構造変化が引き金となる新規のGPCR活性化機構を明らかにしたものです。本研究によって明らかになったユニークなGPCR活性化様式から、class B1 GPCRの細胞内ポケットを標的とすることで副作用を低減した薬剤の合理的設計が可能であることが期待されます。
論文情報
- 雑誌名
Nature論文タイトル
class B1 GPCR activation by an intracellular agonist著者
Kazuhiro Kobayashi1‡, Kouki Kawakami2‡, Tsukasa Kusakizako1, Atsuhiro Tomita1, Michihiro Nishimura1, Kazuhiro Sawada1, Hiroyuki H. Okamoto1, Suzune Hiratsuka2, Gaku Nakamura2, Riku Kuwabara2, Hiroshi Noda4, Hiroyasu Muramatsu3, Masaru Shimizu3, Tomohiko Taguchi4, Asuka Inoue2*, Takeshi Murata5*, Osamu Nureki1*
‡共同筆頭著者 *共同責任著者 (1)東京大学大学院理学系研究科生物科学専攻 (2)東北大学大学院薬学研究科分子細胞生化学分野 (3)中外製薬株式会社(4)東北大学大学院薬学研究科細胞小器官疾患学 (5)千葉大学大学院理学研究院DOI番号
10.1038/s41586-023-06169-3
研究助成
本研究は、日本学術振興会(JSPS)科学研究費助成事業の「クライオ電子顕微鏡を用いたclass B1 GPCRの構造解析」(課題番号:20J21820 研究代表者:小林和弘)、「生態環境でのGPCRの構造ダイナミクス」(課題番号:21H05037 研究代表者:濡木理)をはじめとする科学研究費助成事業(課題番号:19H03163, 21H05142, 21H04791, 21H05113, JPJSBP120213501, JPJSBP120218801)、および、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)(課題番号:JP20am0101095)、革新的先端研究開発支援事業ソロタイプ(PRIME)(課題番号:JP19gm5910013)、革新的先端研究開発支援事業インキュベートタイプ(LEAP)(課題番号:JP20gm0010004)、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業さきがけ(課題番号:JPMJPR1331)およびムーンショット型研究開発事業(課題番号:JPMJMS2023)、武田科学振興財団、アステラス病態代謝研究会、花王芸術科学財団、持田記念医学薬学振興財団、東京生化学研究会、第一三共生命科学研究振興財団、上原記念生命科学財団、中外製薬株式会社など多くの支援を受けて行われました。
用語解説
注1 クライオ電子顕微鏡を用いた単粒子解析
電子顕微鏡を用いてタンパク質を始めとした多数の生体高分子の像を撮影し、これらの画像を重ね合わせることによりその立体構造を再構成、生体高分子の立体構造を決定する手法である。この手法では液体窒素(-196℃)等により極低温に冷却された試料に対して電子線を照射し、資料を透過した電子線を検出することにより試料の観察を行う。ここ10年間で試料の測定方法や検出器などが目覚ましい技術革新を遂げており、タンパク質の立体構造を高分解能で決定する手法として広く知られてきた。この技術革新の功績から、その開発に貢献した海外の研究者3名に対し、2017年度のノーベル化学賞が贈られた 。
注2 PCO371
中外製薬の開発した非ペプチド性の経口投与可能なPTH1R作動薬のこと。注射による投与が必要であったこれまでのPTH1R作動薬と異なり経口投与により患者の身体的負担を低減した薬剤となることが期待されている。PTH1Rはペプチド性作動薬による活性化機構のみが明らかになっており、非ペプチド性作動薬による活性化機構は明らかになっていなかった。
注3 Gタンパク質共役型受容体(GPCR)
GPCRは細胞膜に発現する7回膜貫通型タンパク質であり、最大のファミリー(ヒトでは約800種)を形成するタンパク質として知られている。GPCRは細胞外の特定のリガンドのみにより活性化し、膜貫通部位の構造変化により細胞内の三量体Gタンパク質を活性化可能な状態になる。特定の細胞外刺激物質(リガンド)のみが結合できるように進化した各受容体により、実質的にヒトのほぼ全ての生命現象が制御されることが知られており、GPCRを標的とした薬剤は既承認医薬品の30%以上を占めている。本研究の対象であるクラスB1のGPCRは細胞外ドメインと膜貫通ドメインの2つのドメインから構成され、ペプチドホルモンを受容するグループである。
注4 リガンド
リガンドとは機能をもつタンパク質に特異的に結合する物質であり、標的タンパク質に結合することで標的タンパク質の立体構造を変化させる。リガンドと標的タンパク質はいわば鍵穴と鍵の関係にあり、鍵であるリガンドが標的の鍵穴へと特異的に結合する。
注5 三量体Gタンパク質
細胞内情報伝達に関わるGTP結合タンパク質であり、Gα、G β、Gγサブユニットの三量体により構成されている。三量体Gタンパク質はアゴニストの結合したGPCRによって活性化され、活性化されたGタンパク質はGDP-GTP交換反応を伴ってGαとGβ-Gγの2つに解離する。解離した各サブユニットはそれぞれ異なる下流のシグナル伝達因子と結合し、そのシグナル伝達因子を活性化することで、細胞内において様々なシグナル応答を生じる。
注6 シグナル
GPCRを介した細胞プロセスを表し、Gタンパク質やβ-アレスチンによって担われている。このプロセスの種類により生じる生理応答が異なることから、特定のシグナルのみを惹起するリガンド開発が注目されている。
注7 バイアス型作動薬
複数存在するGPCRを介した生理プロセスのうち、特定の生理活性経路のみを選択して活性化させる薬剤。近年、GPCRの特定の経路が副作用を惹起する例が複数報告され、薬理作用経路のみを活性化するバイアスドリガンドが注目を集めている。
注8 副甲状腺ホルモン1型受容体(PTH1R)
PTH1Rは2つの内在性ホルモンであるPTHとPTHrPにより活性化し、骨の形成から維持までに必須の役割を果たすGタンパク質共役型受容体である。PTH1Rは骨の形成と破壊、そしてそれに伴う体内のカルシウム恒常性を制御していることから、PTH1Rを標的とした医薬品開発は急性カルシウム血症、副甲状腺機能低下症、骨粗しょう症といった様々な疾患の治療が可能となることが期待されている。特に、PTH投与によるPTH1Rの活性化は骨粗しょう症を有意に回復させることから、PTHやPTHrPを改変した骨粗しょう症治療薬開発が進められてきた。
注9 class B1 GPCR
GPCR全体に保存されている7回膜貫通タンパク質ドメインに加え、N末端領域に共通した120〜160アミノ酸で構成される細胞外ドメインを持つ受容体群。30残基を超える生理活性ペプチドホルモンを受容することにより活性化し、主に三量体Gsタンパク質とβアレスチンを活性化することにより生理機能を発揮する。class B1 GPCRの多くの受容体がβアレスチンを介して副作用を生じることからGタンパク質バイアスドリガンド開発が重視されているものの、結合するリガンドが大きく複雑であることから、バイアスドリガンド開発が難しい受容体群として知られている。