2023-11-01 東京大学
発表のポイント
- タンパク質を合成する装置「リボソーム」を作る遺伝子の発現スイッチが、栄養状態によって制御される新しい仕組みを見出しました。
- 細胞が飢餓状態になると、栄養状態を感知するTOR経路が不活性化し、リボソーム遺伝子領域に、RNA干渉に依存してヘテロクロマチンが形成されることを発見しました。
- TOR経路は、がんの発生や老化と密接に関連しており、今回明らかにした仕組みを応用することで、がん治療や寿命の延伸に貢献できる可能性があります。
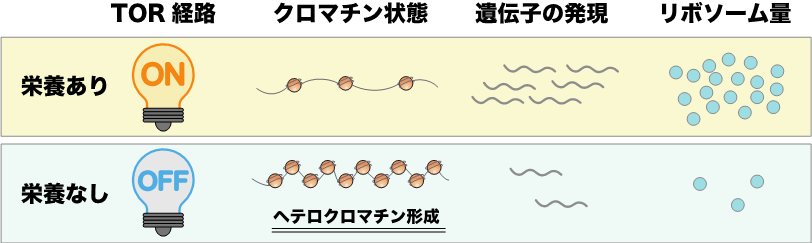
TOR経路の不活性化によってリボソーム遺伝子領域にヘテロクロマチンが形成されることを発見
発表概要
東京大学大学院総合文化研究科の平井隼人特任研究員、太田邦史教授らの研究グループは、分裂酵母細胞が栄養飢餓に直面すると、リボソーム(注1)に関連する遺伝子領域に、RNA干渉(注2)に依存したヘテロクロマチン(注3)と呼ばれる高度なクロマチン凝集体が形成され、遺伝子発現が抑制されることを発見しました。本研究グループはさらに、飢餓がどのようにしてヘテロクロマチン形成を引き起こすのか解析したところ、外部の栄養を感知するTOR(Target of Rapamycin: 注4)と呼ばれる経路の不活性化が契機となることを明らかにしました。
TORは免疫抑制作用、抗がん作用、寿命延長作用のあるラパマイシンの標的分子として知られているほか、リボソームの機能欠損はダイアモンド・ブラックファン貧血などのリボソーム病 (注5)をもたらし、ヒトのがんや造血異常に密接に関連しています。今後ヒト細胞においても解析を進めることで、がん治療や寿命の延伸に貢献できることが期待されます。
本研究成果は、米国Cell Press社が出版するCell Reports誌に掲載されました。
発表内容
〈研究の背景〉
生命が誕生して以来、すべての生物はあらゆるストレス環境に直面しながらも、その環境に適応するすべを進化の過程で獲得してきました。特に食物・栄養の枯渇はすべての生物にとって死活問題であり、栄養が枯渇した環境をいかに耐え凌ぐかが生存の鍵になるといえます。多くの生物では、飢餓に直面するとエネルギー消費を抑えるために細胞内活動が停止することが知られていますが、その具体的なメカニズムの全貌は解明されていません。そこで研究グループはメカニズムの一端を解明すべく、細胞内エネルギーを大量に消費する活動の一つであるリボソーム生合成が、飢餓によって抑制される機構の解明に取り組みました。
〈研究内容〉
タンパク質を合成する装置であるリボソームは、約80種類のタンパク質と4種類のrRNA(注6)から構成されています。研究グループはこれまでに、rRNAが転写されるゲノム領域(rDNA領域:注7)が飢餓によって高度に凝集された状態(ヘテロクロマチン状態)となり、転写が抑制されることを発見していました。しかしながら、細胞が飢餓を認識した後、どのような司令を出してrDNA領域をヘテロクロマチン化するのか依然として不明でした。
研究グループは、栄養シグナル伝達の司令塔の一つであるTOR経路に着目しました。TOR経路は外部環境の栄養が不足すると不活性化します。そこで、TOR経路を人為的に不活性化できる変異体を用いて、十分な栄養があるときに強制的にTOR経路を不活性化しました。すると本来転写が活発であるrDNA領域がRNA干渉を介してヘテロクロマチン化され、転写が抑制される結果が得られました(図1)。また、同様の結果がrDNA領域だけでなくリボソームタンパク質をコードする遺伝子領域においても確認されました。
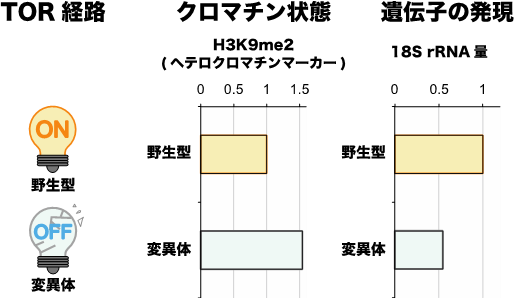
図1. 変異体を用いてTOR経路を強制的に不活性化すると、富栄養下でもrDNA領域がヘテロクロマチン化し、転写が抑制される。
これらの結果をまとめると、細胞は栄養不足に陥ったとき速やかにTOR経路を不活性化することで、リボソームに関連する遺伝子領域にヘテロクロマチンを形成します。これにより、エネルギー消費の激しいリボソーム遺伝子の転写が抑制され、細胞内資源の枯渇を防ぐことができると考えられます。
TOR経路の不活性化がリボソームに関連する遺伝子の発現を抑制することは、昔からよく研究されていましたが、その研究のほとんどは出芽酵母をモデル生物としたものでした。しかしながら、出芽酵母にはヒトや分裂酵母が持っているヘテロクロマチン形成やRNA干渉に必須な因子が存在しないため、遺伝子の抑制機構がこれら生物種間で異なることが示唆されていました。本研究で見出された、TOR経路の不活性化によるヘテロクロマチン形成を介した遺伝子発現の抑制機構は、これまでに出芽酵母で明らかにされてきた仕組みとは異なる機構でした。分裂酵母の仕組みは、ヒトなどの動物細胞に近い機構であることが予想されるため、栄養飢餓に適応し生き抜くための一つの普遍性のあるメカニズムを見出したことになります。
〈影響・波及効果〉
我が国では年間40万人弱が、がんによって死亡しています。一部のがん細胞ではヒトTOR (mTOR)経路が過剰に活性化していることや、リボソーム生合成が促進されていることが知られています。これまでにmTORを標的としたラパマイシンなどの阻害薬が、がん治療薬として開発されてきていますが、副作用やがん細胞の薬剤耐性の問題から、引き続き新しい治療薬の開発が望まれています。今回研究グループによって、TOR経路とリボソームの生合成に関わる新たな制御メカニズムが解明されたことで、新しいタイプのがん治療薬の開発が進展する可能性があります。
また、適度なカロリー制限は寿命の延伸につながることが示唆されています。さらには、rRNAが転写されるrDNA遺伝子は複数のコピーが連続して並んでいますが、コピー数の不安定化が老化の原因となることが指摘されています。これらのことから、カロリー制限下ではrDNA領域がヘテロクロマチン化されることでコピー数が安定化し、細胞の寿命ひいては個体の寿命を延伸させるのかもしれません。
〇関連情報:
「プレスリリース 細胞が無駄なエネルギーを消費しないための遺伝子スイッチ停止機構の解明-ブドウ糖飢餓時におけるリボソーム遺伝子の発現抑制機構-」(2022/03/28)
https://www.u-tokyo.ac.jp/focus/ja/press/z0109_00037.html
発表者
東京大学 大学院総合文化研究科・教養学部
平井 隼人 特任研究員
太田 邦史 教授
教養学部 統合自然科学科
銭 優希 学部生
論文情報
雑誌:Cell Reports
題名:TOR Inactivation Triggers Heterochromatin Formation in rDNA during Glucose Starvation
著者:Hayato Hirai*, Yuki Sen, Miki Tamura, Kunihiro Ohta*(*共責任著者)
DOI:10.1016/j.celrep.2023.113320
URL:https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01332-3
研究助成
本研究は、科学技術振興機構(JPMJCR18S3)、日本医療研究開発機構 (JP20wm0325003, JP22gm1610007)、日本学術振興会 若手研究(JP23K14175)、NPO法人酵母細胞研究会 地神芳文記念研究助成金の支援により実施されました。
用語説明
(注1)リボソーム
生命の設計図であるDNAから転写されたメッセンジャーRNAをタンパク質へと変換する装置。様々なタンパク質を絶え間なく合成するため、細胞内には大量のリボソームが存在する。酵母では全RNAのうち約8割がリボソームを構成するrRNAが占めている。
(注2)RNA干渉
非コードRNAに由来する低分子二本鎖RNA(siRNA)が、相補的な配列をもつ領域にヘテロクロマチン関連因子を呼び込んで転写を抑制する仕組み。モデル生物として用いられる出芽酵母Saccharomyces cerevisiaeにはRNA干渉に関する因子が存在しない。
(注3)ヘテロクロマチン
DNAを細胞内の核にコンパクトに格納するため、DNAはヒストンとよばれるタンパク質に巻き付いてヌクレオソームを形成している。ヌクレオソームはさらに規則正しく折りたたまれることでクロマチン構造を形成する。ヘテロクロマチンは、クロマチンが高度に凝集して転写が抑制された状態を指す。
(注4)TOR
TOR(Target of Rapamycin)は抗腫瘍・免疫抑制剤であるラパマイシンの標的分子で、細胞成長や栄養シグナル伝達にとって重要な働きを持つ。TORには2種類の複合体が存在し、それぞれTORC1とTORC2がある。研究グループは今回、TORC1の不活性化がrDNA領域のヘテロクロマチン化を引き起こすことを明らかにした。
(注5)リボソーム病
ヒトの疾患のいくつかは、リボソームに関連する遺伝子に傷が入ることで発症する。このような疾患には、ダイアモンド・ブラックファン貧血や先天性角化不全症、T細胞急性リンパ性白血病などが含まれる。
(注6)rRNA
リボソームは約80種類のリボソームタンパク質と4種類のリボソームRNA(rRNA)から構成される。分裂酵母において、rRNAは3番染色体の末端に位置するrDNA領域から転写される。
(注7)rDNA領域
rRNAが転写される遺伝子領域を指す。多くの生物では複数のユニットがタンデムに並んでいる。これにより大量のrRNAを産生することが可能であるが、ゲノム不安定性を引き起こしやすく、老化の原因となることが指摘されている。