2023-10-31 国立精神・神経医療研究センター,山口東京理科大学
国立精神医療研究センター(NCNP)精神保健研究所精神薬理研究部、山口東京理科大学薬学部、武蔵野大学薬学部、大阪大学医学部、東京大学医科学研究所、理化学研究所らの共同研究グループは、脳内硫化水素とポリサルファイドが神経伝達物質放出を制御することで記憶形成に関与し、その不足によって統合失調症様行動を誘発することを発見しました。
今回、共同研究グループは、硫化水素とポリサルファイドが、脳内における主要な神経伝達物質であるガンマアミノ酪酸(GABA)、グルタミン酸、そして、記憶にかかわるN-メチルーD-アスパラギン酸(NMDA)受容体の活性を亢進するコアゴニストD-セリン等の放出促進を行うことを見出しました。これまで毒性を示す高濃度硫化水素によってこれら伝達物質放出が抑制されることが知られていましたが、生理的濃度での伝達物質放出促進という新しい作用機構を発見しました。また、硫化水素/ポリサルファイドの脳内主要生合成酵素3-メルカプトピルビン酸イオウ転移酵素(3MST)と標的分子トランジェントレセプターポテンシャルアンキリン1(TRPA1)チャネルそれぞれの欠損動物を作成し、記憶の形成には3MSTによって生合成される硫化水素/ポリサルファイドおよびポリサルファイドの標的分子TRPA1チャネルが関わっていることが明らかとなりました。さらに、3MST欠損動物では、統合失調症様行動が認められ、これら分子の不足が統合失調症に繋がることを示唆しました。本研究成果は、硫化水素/ポリサルファイド、その生合成酵素と標的分子が、統合失調症の新たな創薬開発に繋がることが期待されます。
本研究は、2023年10月31日(火)午後7時(日本時間)にSpringer Natureの科学誌「Scientific Reports」(オンライン版)に掲載されました。
研究背景
硫化水素(H2S)は、生体内で生合成(注1)され、神経伝達調節、細胞保護、抗炎症等、様々な活性を持っていることが分かっています。脳では主に3メルカプトピルビン酸イオウ転移酵素(3MST)によって生合成され、ポリサルファイド(H2Sn, n>2)(注2)も同酵素により生合成されます。H2Snの標的分子としては、記憶形成にもかかわることが報告されているトランジェントレセプターポテンシャルアンキリン1(TRPA1)チャネル(注3)があります。これまで、H2SやH2Snによる神経伝達物質(注4)放出制御や、それらの生産酵素や標的分子が記憶形成や精神疾患様行動に関わるとの研究はありませんでした。本研究では、H2SやH2Snの生産酵素と標的分子の欠損動物を使用して検討を行いました。
研究手法と成果
これまで、毒性レベルのH2Sによって、脳内神経伝達物質量が減少することが知られていましたが、生体内レベルでの作用については知られていませんでした。今回、培養液に浮遊させた脳細胞では、生理的濃度のH2SやH2Snによって、抑制性伝達物質ガンマアミノ酪酸(GABA)が放出されることが判明しました。さらに成体ラットを使って、マイクロダイアリシス(注5)による検討を進めました。本方法では、投与局所(脳に埋め込んだプローブの出口)におけるH2S/H2Sn濃度が注入口濃度の1/50以下になるため、投与濃度を生理的濃度の50倍以上で検討しました。その結果、GABA、グルタミン酸、D-セリン(注6)等の放出が増加しました (図1)。
図1.硫化水素とポリサルファイドによる神経伝達物質の放出
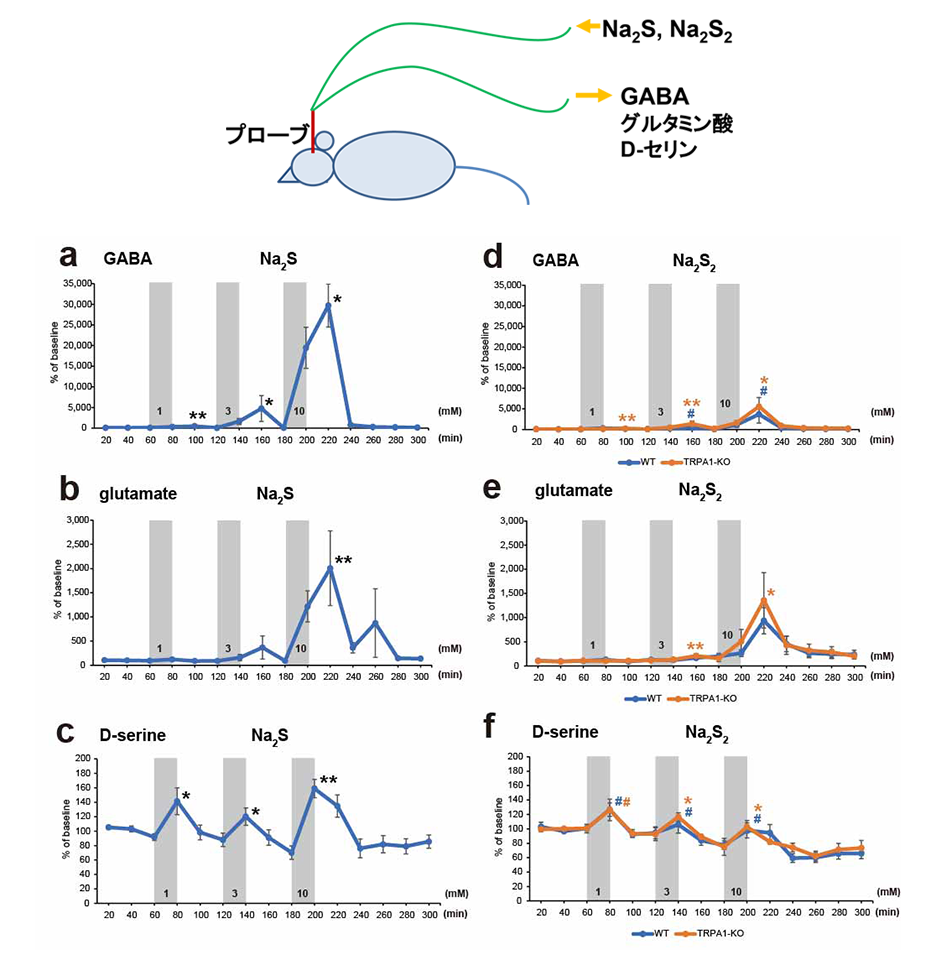 ラット海馬にマイクロダイアリシスプローブを埋め込み、H2SとH2S2のナトリウム塩(Na2S, Na2S2)リンゲル液を還流し、GABA, グルタミン酸、D-セリン等が放出されることが分かりました。
ラット海馬にマイクロダイアリシスプローブを埋め込み、H2SとH2S2のナトリウム塩(Na2S, Na2S2)リンゲル液を還流し、GABA, グルタミン酸、D-セリン等が放出されることが分かりました。
次に、記憶形成について、記憶形成モデルと考えられている海馬長期増強(LTP)に対する3MSTとTRPA1チャネルの影響について検討しました。3MST欠損ラット海馬スライス標本では、LTPが誘導されず、H2S2を補充することで、LTP誘導が回復しました。このことは、LTPの誘導には3MSTの生合成産物H2S2が必要であることを示しています。TRPA1チャネル欠損ラット海馬では、LTPは誘導されず、H2S2を補充してもLTPは誘導されませんでした。これは、H2S2がTRPA1チャネルを標的としていることを示しています。3MST/TRPA1チャネル両欠損ラットでも、LTPは誘導されず、H2S2補充でも誘導されず、D-セリン補充によって、誘導されました。これらの結果から、記憶形成には、H2SやH2S2を生合成する3MSTとその標的分子TRPA1チャネルが必要であることが明らかになりました。
図2、ポリサルファイドによる海馬スライス標本における長期増強(LTP)の誘導
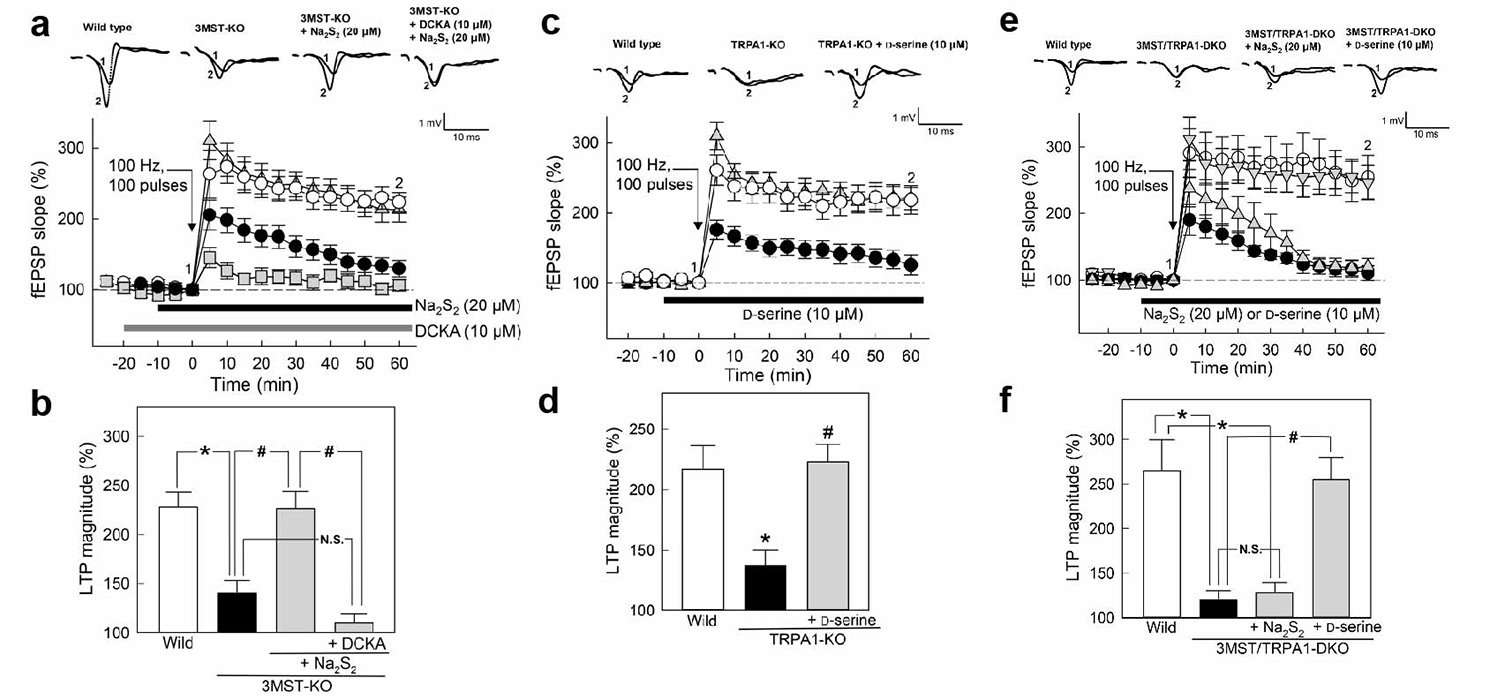 a.b. 3MST欠損ラット海馬では、LTPが誘導されません。Na2S2の補充により、誘導されます。
a.b. 3MST欠損ラット海馬では、LTPが誘導されません。Na2S2の補充により、誘導されます。
c.d. TRPA1チャネル欠損ラット海馬では、LTPが誘導されません。D-セリンの補充により、誘導されます。
e.f. 3MST/TRPA1チャネル両欠損ラット海馬では、LTPが誘導されません。D-セリンの補充により誘導されます。
また、グルタミン酸系神経とGABA系神経のバランスの乱れが統合失調症の病態生理に関わっていると考えられています。D-セリン濃度はGABA受容体によって制御されており、L-セリンをD-セリンに変換するセリンラセマーゼは統合失調症脆弱性に関わっています。幼少期におけるMK-801(注7)などのNMDA受容体(注8)アンタゴニスト投与によって青年期に認知機能低下や過活動などの統合失調症様症状が出現することが知られています。3MST欠損ラットではH2SやH2S2の生合成が低下しており、グルタミン酸やD-セリンの放出も低下することから、幼少期からNMDA受容体の活動が抑えられていると考えられます。そこで、3MST欠損ラットとTRPA1チャネル欠損ラットにMK-801を投与し、過活動を野生型ラットと比較しました。MK-801投与によって全てのラットに過活動が認められましたが、3MST欠損ラットでは、野生型に比較し有意に亢進しました。この結果から、H2S/H2S2不足によって統合失調症様行動が引き起こされることが示唆されました。
図3.NMDA受容体アンタゴニストMK-801による過活動の誘発
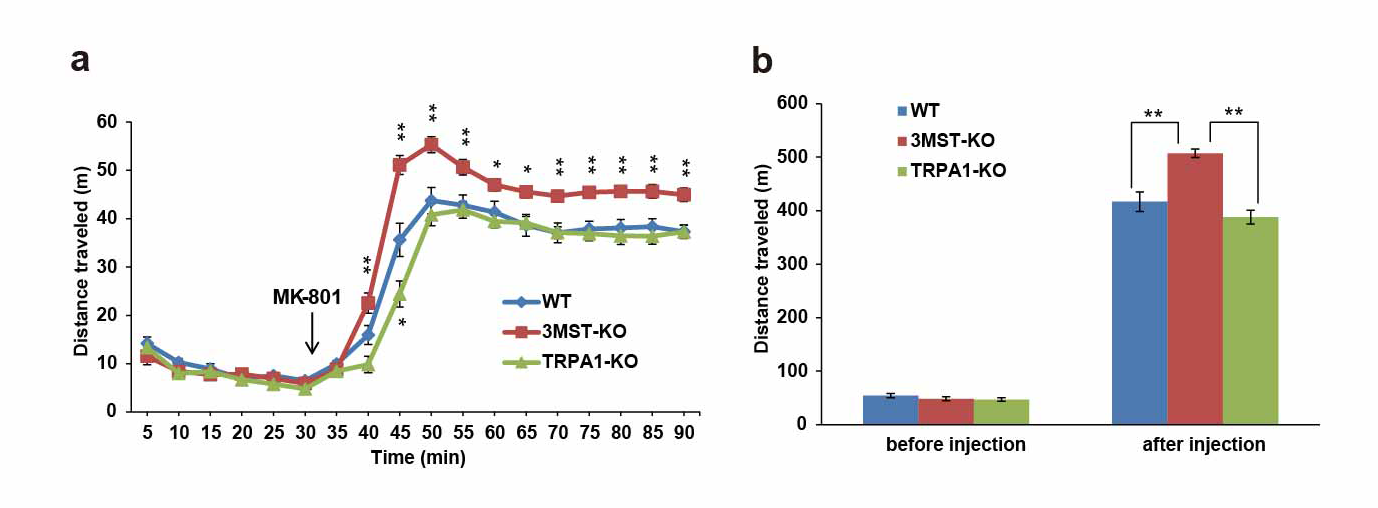 a.b. MK-801投与により、3MST欠損ラット、TRPA1チャネル欠損ラット、野生型ラット全てに活動増加が見られるが、3MST欠損ラットでは、野生型ラットに比較して、有意に過活動を示します。
a.b. MK-801投与により、3MST欠損ラット、TRPA1チャネル欠損ラット、野生型ラット全てに活動増加が見られるが、3MST欠損ラットでは、野生型ラットに比較して、有意に過活動を示します。
以上のことから、3MSTによって生合成されたH2S/H2Snが、神経伝達物質放出を亢進し、さらに標的分子TRPA1受容体を活性化することで、記憶形成にかかわり、一方、その不足が統合失調症様行動に繋がっていると考えられます。
今後の展望
これまで、H2S/H2Snによる神経伝達亢進についてはわかっていましたが、神経伝達物質そのものの放出を制御していることは本研究で初めて明らかになりました。H2S/H2Snが記憶形成に関わっていること、さらにその不足が統合失調症様行動に関わっていることが明らかとなり、統合失調症等精神疾患の診断・治療の切り口になることが期待されます。
原著論文情報
タイトル:Hydrogen sulfide and polysulfides induce GABA/glutamate/D-serine release, facilitate hippocampal LTP, and regulate behavioral hyperactivity
著者名:Hiroki Furuie, Yuka Kimura, Tatsuhiro Akaishi, Misa Yamada1, Yoshiki Miyasaka, Akiyoshi Saitoh, Norihiro Shibuya, Akiko Watanabe, Naoki Kusunose, Tomoji Mashimo, Takeo Yoshikawa, Mitsuhiko Yamada, Kazuho Abe, Hideo Kimura
雑誌:Scientific Reports
DOI:10.1038/S41598-023-44877-Y
用語説明
注1)硫化水素の生合成:生体内では3MSTに加えて、シスタチオニンベータシンテース(CBS)、シスタチオニンガンマリアーゼ(CSE)の3種の酵素によって生合成されます。脳では3MSTが主ですが、CBSも生合成します。
注2)ポリサルファイド:H2SよりもS原子の数が多い過硫化物。3MSTはポリサルファイドも生合成します。
注3)TRPA1チャネル:化学物質刺激、温度変化、圧変化、張力変化、浸透圧変化など各種刺激に対するセンサーとして感覚・知覚神経を中心に、神経系に分布し、Ca2+、Na+、K+を透過するTRPチャネルの一つです。主に痛みの伝搬に関わることが知られています。
注4)神経伝達物質:神経細胞間には神経活動を伝える接合部位であるシナプスがあります。神経伝達物質はシナプスにおいて、情報伝達を介在する物質です。GABA、グルタミン酸、グリシンは代表的な神経伝達物質です。
注5)マイクロダイアリシス:本研究で使用したものは、分子量50,000以上の分子を通さないフィルターを含む直径0.3mm、長さ1mmのプローブです。H2S/H2S2のナトリウム塩をリンゲル液に溶解して脳に投与し、放出された神経伝達物質等をプローブを介して回収します。
注6)D-セリン:NMDA受容体のグリシン(D-セリン)結合部位に結合するコアゴニストで、NMDA受容体の活性を亢進します。
注7)MK-801 :非競合的NMDA 受容体アンタゴニストで、げっ歯類で精神障害動物モデルを作成するのに使用されています。
注8)NMDA受容体:グルタミン酸をアゴニストとし、D-セリンをコアゴニストとする興奮性神経伝達物質受容体で、記憶形成に重要な役割を果たしています。
共同研究グループ一覧
山陽小野田市立山口東京理科大学 薬学部 薬学科
教授 木村英雄
准教授 渋谷典広
客員研究員 木村由佳
国立精神・神経医療研究センター精神保健研究所 精神薬理研究部
室長 古家宏樹
研究員 山田美佐
武蔵野大学 薬学研究所・薬学部 薬学科
教授 阿部和穂
准教授 赤石樹泰
大阪大学 医学部 付属動物実験施設
助教 宮坂佳樹
東京大学 医科学研究所 実験動物研究施設
教授 真下知士
東京理科大学 薬学部 薬学科
教授 斎藤顕宜
九州大学 薬学研究院
特任助教 楠瀬直喜
理化学研究所 脳神経科学研究センター
室長 吉川武男
研究員 渡邊明子
東京家政学院大学 人間栄養学部
教授 山田光彦
研究支援
本研究成果は、以下の事業・研究領域・研究課題、研究助成金によって行われました。
・科学研究費助成事業
・テルモ生命科学振興財団助成金
・喫煙科学研究財団助成金
・武田科学振興財団助成金
・AMED
・NCNP研究運営費
お問い合わせ先
【研究に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター
精神保健研究所精神薬理研究部 古家宏樹
公立大学法人 山陽小野田市立山口東京理科大学
山口東京理科大学薬学部薬理学教室 木村英雄
【報道に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター 総務課広報室
公立大学法人 山陽小野田市立山口東京理科大学 入試広報課