2023-12-05 理化学研究所,東京大学
理化学研究所(理研)生命機能科学研究センター 栄養応答研究チームの小坂元 陽奈 基礎科学特別研究員、小幡 史明 チームリーダー、東京大学大学院 薬学系研究科 遺伝学教室の三浦 正幸 教授らの国際共同研究グループは、食餌(食事)制限[1]による寿命延長効果が加齢によって弱まることを、ショウジョウバエ[2]を用いた研究で明らかにしました。
本研究成果は、健康長寿に向けた栄養介入法の構築・改良に貢献すると期待できます。
食餌制限が寿命延長効果を示すことはさまざまな生物で確認されており、ヒトについてもさまざまな食事制限による健康増進法が提唱されています。中でも、アミノ酸であるメチオニン[3]は寿命に大きな影響を与えることが知られています。今回、国際共同研究グループは、メチオニン制限を行う時期と寿命延長効果の関係を、ショウジョウバエを用いて詳しく解析しました。その結果、中年期以降にメチオニン制限を行っても寿命は延長せず、逆に若年期だけメチオニン制限を行えば寿命が延長したことから、メチオニン制限による寿命延長効果は加齢によって大きく低下することを発見しました。詳細な遺伝子発現解析から、若い時期のメチオニン制限では、抗老化能を持つ多くの遺伝子が発現増加する一方、老化してからではそれが機能しないことが明らかとなりました。
本研究は、科学雑誌『Nature Communications』オンライン版(12月5日付:日本時間12月5日)に掲載されました。

完全合成餌を摂食するショウジョウバエ
背景
超高齢化社会に突入した日本においては、健康寿命の延伸や医療費の削減が喫緊の課題となっています。モデル生物を用いた生命科学研究から、食事(食餌)制限が寿命延長効果を示すことが知られており、また疫学的な研究からヒトに対してもその有効性が示唆されています。
現在までにさまざまな食事制限による健康増進法が提唱されています。その一つがタンパク質摂取制限です。タンパク質は20種類のアミノ酸により構成されており、その中でもメチオニンは寿命への影響が大きいことが知られています。すなわち、食餌からメチオニンだけを制限することで、酵母から線虫、ショウジョウバエ、マウスやラットまで幅広い生物の寿命を延長することが証明されており、ヒトでもその健康増進効果が期待されています。
小幡チームリーダーと三浦教授の先行研究において、メチオニン代謝を遺伝学的に操作することでショウジョウバエの寿命が延長すること注1)や、老化に伴う腸の恒常性破綻がメチオニン制限によって抑制できること注2)を発見していました。しかし、なぜメチオニン摂取を制限すると健康寿命が延長されるのかについては不明な点が多いのが現状です。
食事と健康寿命の関係については、複雑な要因が絡み合うため一概に語ることはできません。例えば、食事を取る人の元々の摂食量や運動、遺伝的背景、腸内細菌など、多くの要素を加味する必要があります。中でも年齢は重要で、疫学的には65歳を境目にしてタンパク質制限の影響が逆転する(高齢になってからはタンパク質を多く摂取した方が、がんによる死亡率やフレイルの危険性が低い)とも報告されています注3, 4)。
そこで本研究では、ショウジョウバエをモデル生物として、老化するまでのある時期に限定した食餌制限、特にメチオニン制限の効果を検証し、その分子機構を解明することを試みました。
注1)Obata, F. & Miura, M. Enhancing S-adenosyl-methionine catabolism extends Drosophila lifespan. Nat. Commun. 6, 8332 (2015).
注2)Obata, F. et al. Nutritional Control of Stem Cell Division through SAdenosylmethionine in Drosophila Intestine. Dev. Cell 44, 741-751.e3 (2018).
注3)Levine ME. et al. Low protein intake is associated with a major reduction in IGF-1, cancer, and overall mortality in the 65 and younger but not older population. Cell Metab. 4;19(3):407-17 (2014).
注4)佐々木 敏 『日本人の食事摂取基準(2020年版)』からみた高齢者の食と栄養. 日老医誌58:541-549 (2021).
研究手法と成果
ショウジョウバエでは、メチオニン制限が雌個体の寿命を延ばすことが報告されています。本研究ではまず、メチオニン量のみを10分の1に制限した合成餌を用いることで、研究室内で再現性よく寿命延長が観察できるメチオニン制限条件を決定しました。この餌条件では、寿命延長、メチオニン代謝物量の低下、脂質代謝変動と飢餓耐性の向上、生殖能力の低下(トレードオフ効果[4])などが認められ、これまで報告があった食餌制限の効果の多くが再現されることを確認しました(図1左、通期メチオニン制限)。
次にこの餌条件を用いて、メチオニン制限による寿命延長効果が、ショウジョウバエのライフステージによって変化するかを解析しました。ショウジョウバエ雌の寿命が成虫羽化後8~12週であることから、およそ4週間までの若齢期(羽化後5~32日)とそれ以降の後期(羽化後32日以降)に分けてメチオニン制限を行いました。その結果、メチオニン制限を若齢期に限定した個体の寿命が延長した一方、後期のみにメチオニン制限を行っても寿命延長は認められませんでした(図1左)。この現象は異なる野生型系統を用いても同様に見られ、若齢期の4週間においてメチオニンを制限する方が、中年期(羽化後32~58日)の4週間に行うよりも強い寿命延長効果がありました(図1右)。従って若齢期のメチオニン制限が寿命延長に十分に効果があること、逆に中年期以後に同じ食餌制限をかけても寿命延長効果が大きく弱まることが明らかとなりました。
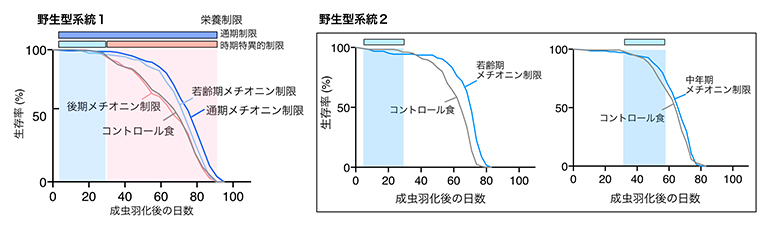
図1 若齢期メチオニン制限による寿命延長
左)完全合成餌を用いたメチオニン制限をショウジョウバエ雌(野生型系統1(Canton-S))に対して行った結果。成虫羽化後5日以降の通期にわたってメチオニン制限した個体の生存率は、通常摂食(コントロール食)群に比べて上昇している。この生存率の上昇は、若齢期の4週間(羽化後5~32日)の時期に限定したメチオニン制限でも同様に見られたが、後期(羽化後32日以降)に行った場合はコントロール食群と変わらない生存率となった。
右)別の野生型系統2(wiso31)雌について、若齢期(羽化後5~32日)と中年期(羽化後32~58日)それぞれでメチオニン制限を行った場合の個体寿命。野生型系統1(Canton-S)と同じ傾向を示しており、若齢期の4週間のみメチオニン制限を行った場合に寿命延長効果が認められた。
腸は食べたものが直接作用する臓器であり、食餌制限による寿命延長には腸が重要な役割を果たしていることが分かっています。加齢に伴うメチオニン制限の効果の違いをさらに深く解析するため、次世代シーケンサーを用いて腸で発現する遺伝子の網羅的な発現解析(RNAseq[5])を行いました(図2)。24時間だけメチオニンを完全に除去した餌を摂食させた個体の腸を摘出し解析を行った結果、若齢個体(羽化後1週目)では800以上の遺伝子で発現変動があったのに対し、老齢個体(羽化後8週目)では50以下に減少していました(図2中)。このことは、加齢に伴って餌中メチオニンに対する腸の応答が低下することを示唆しています。さらに、若齢個体で発現変動が見られた遺伝子を詳しく見ると、寿命を延長する機能が知られる遺伝子の発現が多数誘導されていました。その一つに、抗酸化タンパク質であるメチオニンスルホキシド還元酵素A(MsrA)[6]の遺伝子がありました。
メチオニンは日々酸化によるダメージを受け、酸化型メチオニン(メチオニンスルホキシド)を生成します。MsrAは酸化してしまったメチオニンを還元して元に戻す酵素であり、細菌からヒトまで進化的に保存された抗酸化タンパク質です。メチオニン制限と酸化型メチオニンの関係を調べたところ、メチオニン除去餌を食べた若齢個体では体内のメチオニンに対する酸化型メチオニンの割合が大きく低下している一方、老齢個体ではそのような効果が認められませんでした(図2右)。従って、メチオニン低下によって誘導されたMsrAが、酸化したメチオニンを回復させることで健康寿命を促進している可能性が考えられました。この遺伝子機能が完全に破壊された変異体を用いて、その効果を検証したところ、MsrA変異体ショウジョウバエでは、酸化型メチオニンが増加していました。また、同変異体では、若齢期のメチオニン制限による寿命延長が見られなくなることが明らかとなりました。
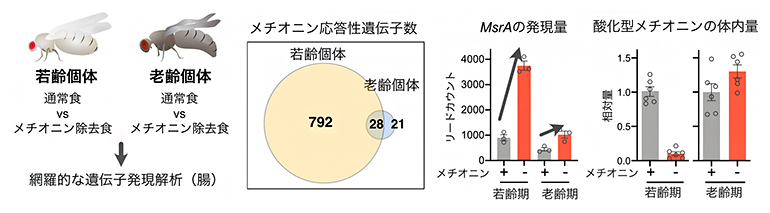
図2 メチオニン除去餌でのMsrA発現解析と酸化メチオニン量
左)実験の概要。通常食とメチオニン除去食のそれぞれを与えた個体の腸を用いて、遺伝子発現を網羅的に解析し、比較した。
中)若齢個体では800以上の遺伝子がメチオニン制限に応答して発現変動するのに対し、老齢個体では50以下にとどまった。なお両者で共通して変動した遺伝子は28個あった。
右)若齢個体では、抗酸化遺伝子であるMsrAの発現量がメチオニン摂取制限(メチオニン-)により大幅に増加していた。これにより体内のメチオニンに対する酸化型メチオニンの相対量が低下するが、老齢個体では起きなくなる。
メチオニン制限とMsrAの関係をさらに解析した結果、MsrA遺伝子の誘導は
1)腸だけでなく全身で起こっている
2)メチオニン以外のアミノ酸制限には応答しない
3)若齢期にメチオニン制限を行った後、通常食に戻しても継続して発現が増加している
4)寿命延長転写因子として知られるFoxOにより誘導される
ことなどが明らかとなりました。
以上の結果から、メチオニン制限によって誘導されるMsrAが個体寿命を延長させること、その効果が加齢によって減弱するため老齢個体ではメチオニン制限の寿命延長効果が消失することが明らかとなりました(図3)。
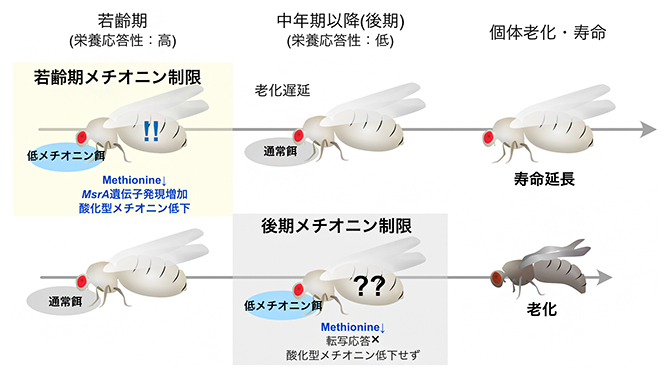
図3 メチオニン制限による寿命延長は加齢依存的
上)若齢期に低メチオニン餌を与えられた個体ではMsrA遺伝子の発現が上昇し、体内の酸化型メチオニンが低下する。このメチオニン制限による寿命延長効果は若齢期に限定的であり、しかもその効果は中年期以降に通常餌に戻した場合でも持続する。
下)中年期(後期)以降にメチオニン制限を行った個体においても体内メチオニンは同様に低下するが、MsrA遺伝子の誘導やそれによる酸化型メチオニンの低下は見られず、個体寿命は延びない。
今後の期待
「腹八分目」が身体に良いことは古くから知られています。しかし、ヒトを含めた動物は本能的に栄養、特にタンパク質を摂食しようとする欲求が強く、常に食餌制限をして生きるのは現実的に難しいと考えられます。従って、制限すべき栄養素や時期を狭めることは、食事を介した健康増進の実現としてより応用の可能性が高まると期待されます。
今回の発見から、少なくともショウジョウバエでは、若齢期のみメチオニンを制限するだけで寿命が延長できることが分かりました。これは、老化制御における栄養感受性の臨界期の存在を示唆します。ライフステージ依存的な単一栄養素制限の効果の記述と、その機構解明はこれまであまりなされていません。本研究は栄養-老化研究における先駆的な成果であると考えられます。
今後は、ショウジョウバエでの発見がヒトを含め動物一般にどの程度当てはまるかを解析した上で、メチオニン含有量の少ない食事を取ることによって、ヒトの健康寿命延伸が可能であるかを検証することが必要となります。さらに、メチオニンを代謝する酵素の機能を高めたり、体内でメチオニン制限状態を模倣できるような生理活性物質を探索したりすることなどにより、食事制限をせずとも健康寿命延伸に資する新規方法論の開発が期待されます。
補足説明
1.食餌(食事)制限
酵母、線虫、ショウジョウバエ、マウスなどのモデル生物において、培地の栄養分や食事の量を制限することで寿命が延長することが確認されている。食餌制限には、摂取カロリーを制限するカロリー制限、自由に餌を食べられる状態と餌を与えない状態を繰り返す断続的飢餓、餌の総カロリーを変えずに特定の栄養素を制限する方法などがある。
2.ショウジョウバエ
ショウジョウバエは、体長2~3mm前後の大きさで、飼育が容易であり、遺伝学的な解析に優れていることから、さまざまな研究分野でモデル生物として用いられている。合成餌の利用が可能であり、栄養代謝生理学のモデルとしても重宝されている。
3.メチオニン
タンパク質を構成する20種類のアミノ酸のうち、動物が合成できない必須アミノ酸の一つ。メチオニンはタンパク質合成の開始に使われ、またほとんどのメチル化反応の基質であるS-アデノシルメチオニン(SAM)の前駆体であるため、さまざまな生体プロセスに影響する。その制限により寿命が延長することがラットで報告されたことを皮切りに、多くのモデル動物を用いてその影響が解析されている。
4.トレードオフ効果
食事制限や寿命遺伝子の変異により寿命が延長した個体で、生殖能力が低下する現象をトレードオフ効果と呼ぶ。これは、生殖細胞の維持に有利な遺伝子が体細胞の維持に対しては不利に働く場合や、生殖年齢を過ぎてから個体の生存率を下げるような有害な変異に自然選択が働きにくい、などの理由が考えられている。
5.RNAseq
細胞や組織から抽出したRNAからcDNA(逆転写の結果得られたDNA)を合成し、次世代シーケンサーを用いてその細胞・組織で存在しているRNAの配列や量の情報を網羅的に解析する手法。
6.メチオニンスルホキシド還元酵素A(MsrA)
メチオニンは側鎖に硫黄原子(S)を含み、酸化を受けるとこの硫黄に1原子の酸素が結合したメチオニンスルホキシドとなり、さらに1原子の酸素が結合すると最終酸化物であるメチオニンスルホンとなる。メチオニンスルホキシドにはS体とR体の立体異性体があり、メチオニンスルホキシド還元酵素AはS体を還元し、メチオニンに戻す酵素。
国際共同研究グループ
理化学研究所 生命機能科学研究センター 栄養応答研究チーム
基礎科学特別研究員 小坂元 陽奈(コサカモト・ヒナ)
テクニカルスタッフⅠ 岡田 莉奈(オカダ・リナ)
チームリーダー 小幡 史明(オバタ・フミアキ)
(京都大学 大学院生命科学研究科 客員准教授)
東京大学 大学院薬学系研究科 遺伝学教室
教授 三浦 正幸(ミウラ・マサユキ)
大学院生 倉石 淳平(クライシ・ジュンペイ)
大学院生 相川 英(アイカワ・ヒデ)
大学院生 大沼 太郎(オオヌマ・タロウ)
モナッシュ大学(オーストラリア)School of Biological Sciences
准教授 マシュー・パイパー(Matthew D.W. Piper)
大学院生 ジョシュア・ジョンストン(Joshua N. Johnstone)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、主に日本医療研究開発機構(AMED)の革新的先端研究開発支援事業研究開発領域「健康・医療の向上に向けた早期ライフステージにおける生命現象の解明」における「発生期環境による寿命制御機構の解明(研究代表者:小幡史明)」、同老化メカニズムの解明・制御プロジェクト「老化機構・制御研究拠点(研究代表者:原英二)」、および日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(B)「革新的多重イメージングによる組織複雑化過程の可視化(研究代表者:小幡史明)」、同基盤研究(B)「排出を起点とした代謝恒常性制御機構の遺伝学的解析(研究代表者:小幡史明)」の支援により行われました。また、同基盤研究(S)「細胞死を起点とした細胞外コミュニケーションの発動と生理機能(研究代表者:三浦正幸)」、同基盤研究(A)「個体ごとの表現型を決める非細胞死カスパーゼ活性化機構の解明(研究代表者:三浦正幸)」、同挑戦的萌芽研究「遺伝情報を拡大する翻訳時のタンパク質多様性産生のメカニズムと生理機能(研究代表者:三浦正幸)」、同学術変革領域研究(A)「無脊椎動物免疫センサーTollによる自己免疫応答の分子機構と生理機能(研究代表者:三浦正幸)」による助成を受けて行われました。
原論文情報
Hina Kosakamoto, Fumiaki Obata, Junpei Kuraishi, Hide Aikawa, Rina Okada, Joshua N. Johnstone, Taro Onuma, Matthew D. W. Piper, and Masayuki Miura, “Early-adult methionine restriction reduces methionine sulfoxide and extends lifespan in Drosophila”, Nature Communications, 10.1038/s41467-023-43550-2
発表者
理化学研究所
生命機能科学研究センター 栄養応答研究チーム
基礎科学特別研究員 小坂元 陽奈(コサカモト・ヒナ)
チームリーダー 小幡 史明(オバタ・フミアキ)
東京大学 大学院薬学系研究科 遺伝学教室
教授 三浦 正幸(ミウラ・マサユキ)
報道担当
理化学研究所 広報室 報道担当
東京大学 大学院薬学系研究科 庶務チーム