2023-12-25 生命創成探究センター,基礎生物学研究所,名古屋工業大学
発表の概要
今回、自然科学研究機構 生命創成探究センター(ExCELLS:エクセルズ)/基礎生物学研究所 定量生物学研究グループの中村彰伸 研究員、杉山博紀 研究員、後藤祐平 助教、青木一洋 教授らは、名古屋工業大学大学院工学研究科の築地真也 教授との共同研究により、分裂酵母の細胞内で核や細胞膜に自発的に集積(局在化)する有機小分子「自己局在性リガンド」を開発し、分裂酵母の細胞内タンパク質の局在を強制的に移行誘導することで細胞機能を制御する化学遺伝学ツール(SLIPTシステム)を確立することに成功しました。
本成果は、米国の学術誌「ACS Chemical Biology」に2023年11月22日付けで発表されました。
1.研究の背景
分裂酵母(Schizosaccharomyces pombe)は、真核単細胞生物であり、哺乳類細胞に類似する細胞分裂の様式を示すことから、さまざまな細胞機能の制御メカニズムを解明するための有用なモデル生物として広く用いられています。これまでに、分裂酵母では特定の遺伝子を欠失させる遺伝子ノックアウトにより、その遺伝子がコードするタンパク質と細胞機能の関係が研究されてきました。しかし、遺伝子ノックアウトによるアプローチでは、致死性遺伝子の研究が困難であることや、時間分解能が低いという問題がありました。
そこで、まず本研究グループは、細胞内のタンパク質が特定の細胞内小器官(オルガネラ:例えば核、微小管、ゴルジ体、スピンドル極体など)に局在化することで、細胞機能を精密に制御していることに着目しました。この細胞内タンパク質の局在を、有機小分子を用いて、任意のタイミングで強制的に変えること(局在移行誘導)が可能になれば、高い時間分解能で細胞機能を制御するための強力なアプローチになるものと考えました。
これまでに、有機小分子を用いた細胞内タンパク質の局在制御の従来法として、2種類のタンパク質の二量体化を誘導するCID法(Chemically-Induced Dimerization:二量体誘導化合物)が報告されています。しかし、このCID法を分裂酵母で用いるためには、特定の遺伝子をノックアウトする必要があることや、分裂酵母の細胞機能が阻害されるという問題があります。また、1種類の標的タンパク質の局在移行を誘導するために、2つのタンパク質タグの発現を必要とします。
これらの問題を解決するために、本研究グループは、分裂酵母の細胞機能を阻害することなく、1つのタンパク質タグで標的タンパク質の局在を迅速に移行誘導することが可能な有機小分子ツールの新規開発に取組みました。
2.研究の成果
本研究グループは、以前の研究注1で、ミリスチン酸にD体システインを連結した化合物(mDcモチーフ)が、細胞膜に自発的に局在化することを見出しました。このmDcモチーフに、大腸菌由来ジヒドロ葉酸還元酵素(eDHFR)に特異的に結合するリガンドのトリメトプリム(TMP)を連結することで、細胞膜局在性TMP(mDcTMP)を開発しました。このmDcTMPを、哺乳類細胞の培養液に添加すると、細胞膜を透過して細胞質に入り、ゴルジ体でD体システイン側鎖にパルミトイル基が修飾(パルミトイル化)され、小胞輸送により細胞膜に局在化します。この細胞膜に局在化したmDcTMPにeDHFRが結合することで、eDHFRの細胞質から細胞膜への局在移行を誘導することが可能です。さらに、eDHFRのリガンド結合ポケットの近傍にリジン残基を6つ挿入することで開発したiK6DHFRタグによって細胞膜に局在する性質をさらに高めています。本研究グループは、mDcTMPのように化合物単独で特定のオルガネラに局在化する有機小分子を「自己局在性リガンド」(self-localizing ligand; SL)と名付け、この自己局在性リガンドを用いた細胞内タンパク質の移行誘導系をSLIPT(SL-Induced Protein Translocation)システムと名付けました。
本研究では、哺乳類細胞用に開発したこのSLIPTシステムが、分裂酵母にも適用できるかを評価するところから始めました(図1A)。まず、システイン残基のパルミトイル化機構が分裂酵母で保存されていること、および分裂酵母がTMP非感受性であることに着目し、mDcTMPにより、細胞機能を阻害することなく分裂酵母でiK6DHFRの細胞膜局在化を誘導できるものと考えました。そこで、実際にiK6DHFRに緑色蛍光タンパク質mNeonGreen(mNG)を連結した人工タンパク質(iK6DHFR-mNG)を安定発現する分裂酵母株を樹立し、共焦点レーザー顕微鏡を用いた同一視野のタイムラプスイメージングにより、mDcTMP添加前後のiK6DHFR-mNGの細胞内局在の変化を観察しました。mDcTMP添加前は、iK6DHFR-mNGは核内を含め細胞全体に拡散していますが、mDcTMPを添加すると、iK6DHFR-mNGは細胞膜へと局在化しました。
しかし、長時間のイメージングの結果、このmDcTMPによるiK6DHFR-mNGの細胞膜局在化は1〜2時間後には解消し、細胞質へと戻ってしまうことが判明しました。本研究グループは、mDcTMPのアミド結合が、分裂酵母のプロテアーゼ(タンパク質分解酵素)により切断されたことで、iK6DHFRの細胞膜局在化が解消したものと推測し、mDcTMPのプロテアーゼ耐性を高めたmDcTMP4Meを新たに設計・合成しました(図1B)。このmDcTMP4Meを用いることで、分裂酵母でiK6DHFR-mNGの細胞膜局在化を12時間以上持続させることが可能となりました(図1C)。また、核局在化モチーフとして機能する蛍光色素HoechstヘキストをTMPに連結することで開発した、核局在性TMP(hoeTMP)を用いることで、iK6DHFR-mNGを細胞質から核内に移行誘導することにも成功しました(図1D,E)。
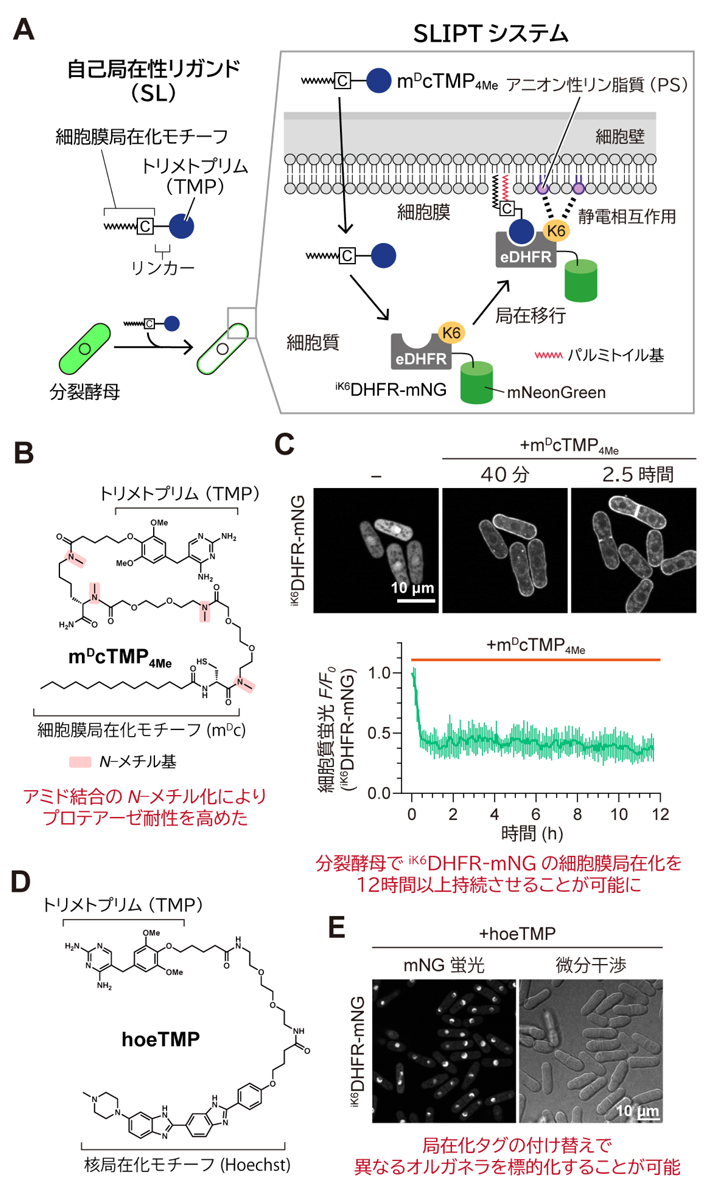
図1.分裂酵母用に最適化したSLIPTシステム
(A)細胞膜局在性の自己局在性リガンドを用いたiK6DHFR融合タンパク質の細胞質から細胞膜への局在移行誘導の概略図。(B)リンカー部位の4箇所のアミド結合をN-メチル化することによりプロテアーゼ耐性を高めた細胞膜局在性TMP(mDcTMP4Me)の分子構造。(C)プロテアーゼ耐性を高めたmDcTMP4Meを用いることでiK6DHFR-mNGの細胞膜局在化を12時間以上持続させることが可能。(D)核局在性TMP(hoeTMP)の分子構造。(E) hoeTMPを用いることでiK6DHFR-mNGを細胞質から核内に移行誘導することが可能。
次に、分裂酵母の内在性タンパク質の細胞膜局在化による細胞機能制御に取組みました。細胞周期の進行を制御する重要なキナーゼタンパク質であるCdc2を最初の標的タンパク質として選択し、cdc2遺伝子の3’末端にiK6DHFR-mNG遺伝子を導入(ノックイン)した分裂酵母株を樹立しました。iK6DHFR-mNG を連結した内在性Cdc2(Cdc2-iK6DHFR-mNG)の局在および細胞株の細胞周期は、野生型株とほぼ同一に保たれていました(図2A,B)。この細胞株にmDcTMP4Meを添加すると、Cdc2-iK6DHFR-mNGが、核内から細胞膜に徐々に局在化し、分裂酵母の細胞長が非常に長くなる様子が観察されました(図2C,D)。本結果は、核内で細胞周期の進行を制御していた核内Cdc2を強制的に細胞膜に局在化させたことで、Cdc2の機能が阻害され、細胞周期の進行も阻害されたと考えられます。
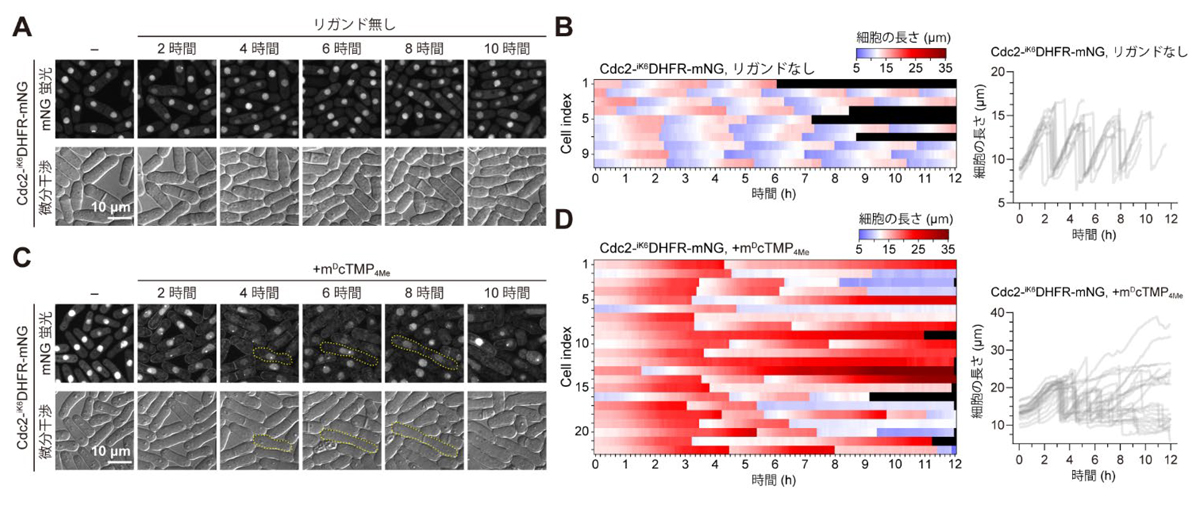 図2.SLIPTによる細胞周期の進行の阻害(A,B)mDcTMP4Meなしのときのタイムラプスイメージングと細胞長の経時変化。(C,D)mDcTMP4Me添加時のタイムラプスイメージングと細胞長の経時変化。
図2.SLIPTによる細胞周期の進行の阻害(A,B)mDcTMP4Meなしのときのタイムラプスイメージングと細胞長の経時変化。(C,D)mDcTMP4Me添加時のタイムラプスイメージングと細胞長の経時変化。
さらに、他の細胞周期の進行に関与する内在性タンパク質にiK6DHFR-mNGをノックインした16細胞株を新たに樹立しました。これら細胞株にmDcTMP4Meを添加すると、そのうち12個の細胞株でiK6DHFR-mNG連結タンパク質の細胞膜局在化を誘導することができました。さらに、培養を継続することで様々な表現型(細胞形態の変化、細胞死など)を誘導することに成功しました。また、mDcTMP4Me添加前後の分裂酵母をタイムラプスイメージングで観察することで、表現型が現れるまでの過程を高い時間解像度で捉えることに成功しました。以上の結果より、mDcTMP4Meを用いた分裂酵母の内在性タンパク質の局在制御法が、さまざまな内在性タンパク質に起因する細胞機能を制御・解析するための汎用性の高いツールになるものと期待できます。
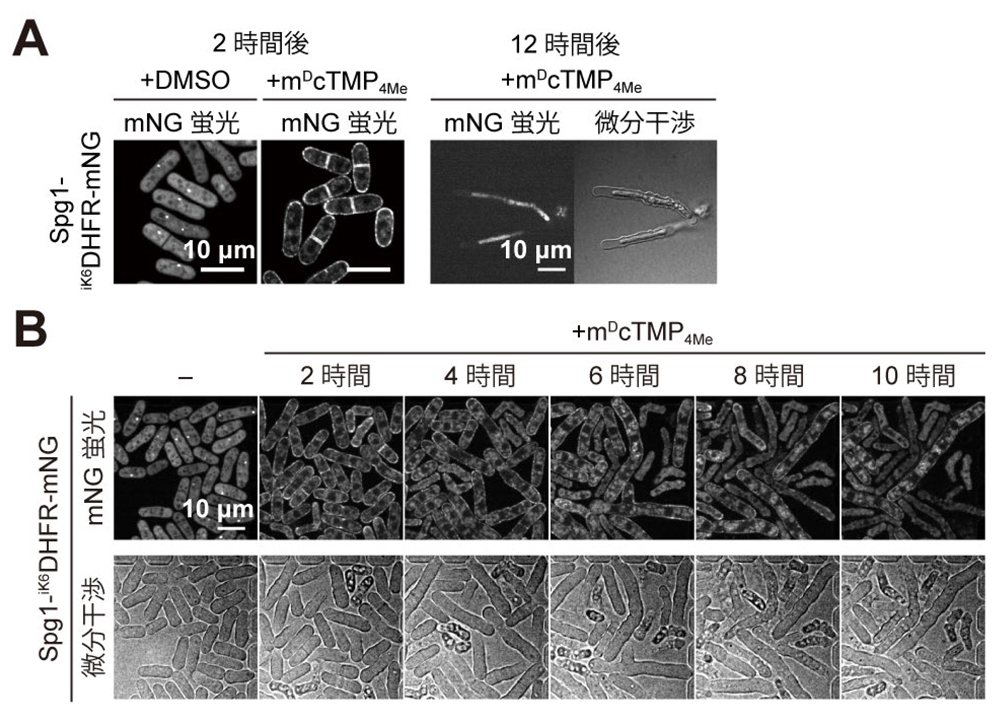 図3. 致死性遺伝子spg1の働きをSLIPTにより高い時間解像度で観察する。(A)Spg1の細胞膜への局在変化(左)と、Spg1の機能が阻害され12時間後に形態以上を示した細胞(右)。(B)Spg1の細胞質/スピンドル極体の局在が、細胞膜に強制的に移行誘導されることで、分裂酵母の細胞分裂が阻害され、多核化が起こり、細胞長が伸長し続けた後に細胞死に至る一連のプロセスをタイムラプスイメージングで観察することに成功した。
図3. 致死性遺伝子spg1の働きをSLIPTにより高い時間解像度で観察する。(A)Spg1の細胞膜への局在変化(左)と、Spg1の機能が阻害され12時間後に形態以上を示した細胞(右)。(B)Spg1の細胞質/スピンドル極体の局在が、細胞膜に強制的に移行誘導されることで、分裂酵母の細胞分裂が阻害され、多核化が起こり、細胞長が伸長し続けた後に細胞死に至る一連のプロセスをタイムラプスイメージングで観察することに成功した。
3.本研究の課題と今後の展望
本研究では、分裂酵母の細胞内タンパク質の局在を、自己局在性リガンド(mDcTMP4Me, hoeTMP)を用いて化学遺伝学的に細胞膜や核内に移行誘導するSLIPTシステムを確立することに成功しました。このSLIPTシステムを用いることで、分裂酵母内のさまざまな内在性タンパク質の局在を、1リガンド・1タンパク質の様式で移行誘導することが可能となり、また内在性タンパク質の強制的な局在移行を起点とする細胞機能制御に成功しました。
しかし、より迅速にタンパク質局在や細胞機能の制御を行うためには、さらなる改良が必要です。mDcTMP4MeによるiK6DHFR-mNGの細胞膜局在化は、哺乳類細胞では5分で完了しますが、分裂酵母では30分掛かってしまいます。これは、分裂酵母が細胞壁を持つ生物であり、細胞外から細胞質への分子透過に時間が掛かっている可能性、あるいは分裂酵母に発現する薬剤トランスポーターによる有機小分子の排出の可能性が考えられます。この問題を解決するためには、mDcTMP4Meの細胞壁/細胞膜透過性をさらに高める必要があると考えられます。これにより、より早い時間スケールで進行する細胞機能の制御が可能になり、分裂酵母の細胞機能をより詳細に解析することが可能になると期待できます。また、本研究では、細胞膜と核を標的オルガネラとしましたが、原理的に局在化モチーフの交換により他のオルガネラを標的化することも可能になるものと考えられます。本研究グループは、先行研究で哺乳類細胞の微小管、ゴルジ体、小胞体といったオルガネラを標的化するための局在化モチーフを開発しています。今後は、分裂酵母用に局在化モチーフを最適化し、さまざまなオルガネラへのタンパク質局在化を制御することで細胞機能のオン/オフを緻密に制御するための基盤技術として展開したいと考えています。
注1)https://doi.org/10.1021/acschembio.0c00014
4.用語解説
CID法:Chemically-Induced Dimerization法、有機小分子化合物を用いたタンパク質二量体化技術。小分子化合物を添加する任意のタイミングでタンパク質の二量体化を誘導することができ、タンパク質の局在変化や活性を制御することができる。
モチーフ:有機小分子化合物内で特定の機能を持つ構造。mDcモチーフは細胞膜への局在化能をもつ。
リガンド:生体分子と結合して機能する小分子化合物。
5.発表雑誌
雑誌名 ACS Chemical Biology
掲載日 2023年11月22日
論文タイトル:Chemogenetic Manipulation of Endogenous Proteins in Fission Yeast Using a Self-Localizing Ligand-Induced Protein Translocation
著者:Akinobu Nakamura, Yuhei Goto*, Hironori Sugiyama, Shinya Tsukiji, Kazuhiro Aoki*
(*co-corresponding authors)
DOI: https://doi.org/10.1021/acschembio.3c00478
6.研究グループ
本研究は、生命創成探究センター/基礎生物学研究所の青木 一洋教授のグループ、名古屋工業大学の築地 真也教授との共同研究で行われました。
7.研究サポート
本研究は、下記の補助金による支援を受けて実施されました。
- 日本学術振興会科研費・特別研究奨励費(19J01341:中村彰伸)
- 日本学術振興会科研費・若手研究(19K16050:後藤祐平)
- 日本学術振興会科研費・若手研究(22K15110:後藤祐平)
- 科学技術振興機構・ACT-X(JPMJAX22B8:後藤祐平)
- 住友財団・基礎科学研究助成(後藤祐平)
- 日本学術振興会科研費・特別研究奨励費(21J01354:杉山博紀)
- 日本学術振興会科研費・若手研究(22K15115:杉山博紀)
- 特定非営利活動法人酵母細胞研究会・地神芳文記念研究助成金(杉山博紀)
- 日本学術振興会科研費・新学術領域研究「分子夾雑の生命化学」(18H04546, 20H04706:築地真也)
- 日本学術振興会科研費・学術変革領域研究(A)「生物を陵駕する無細胞分子システムのボトムアップ構築学」(21H05226:築地真也)
- 生命創成探究センター共同利用研究(ExCELLSプロジェクト研究)(23EXC601-1:築地真也、青木一洋)
- 日本学術振興会科研費・基盤研究(B)(22H02625:青木一洋)
- 日本学術振興会科研費・新学術領域研究「情報物理学でひもとく生命の秩序と設計原理」(19H05798:青木一洋)
- 科学技術振興機構・CREST(JPMJCR1654:青木一洋)
本研究に関するお問い合わせ先
生命創成探究センター 定量生物学研究グループ
基礎生物学研究所 定量生物学研究部門
教授 青木 一洋 (あおき かずひろ)
名古屋工業大学大学院工学研究科 工学専攻(生命・応用化学領域)
教授 築地 真也(つきじ しんや)
<報道担当>
自然科学研究機構 生命創成探究センター 研究戦略室
基礎生物学研究所 広報室
名古屋工業大学 企画広報課