2019-04-19 東京大学,科学技術振興機構
ポイント
- 細胞内の分解メカニズムであるオートファジーの生理的意義の解明に向け、哺乳類細胞を用いてオートファゴソーム膜たんぱく質LC3Bに結合するたんぱく質を網羅的に解析し、選択的に分解されるものを探索しました。
- その結果、細胞小器官の1つである小胞体に存在する膜貫通たんぱく質TEX264を同定し、これがオートファジーによる小胞体の選択的分解に寄与していることを明らかにしました。
- 今回同定したTEX264の今後の研究により、オートファジーによる小胞体の品質管理の生理的重要性や細胞内の恒常性維持機構への関与、さらにはオートファジーによる小胞体品質管理の破綻と疾患との関連の解明につながることが期待されます。
マクロオートファジー注1)(以後、オートファジー)とは、オートファゴソーム注2)が細胞質の一部を取り囲み、リソソーム(多数の分解酵素を含む細胞小器官)と融合することで分解する細胞内分解システムの1つです(図1)。従来オートファジーは非選択的な分解機構(非選択的オートファジー)と考えられてきましたが、最近になって傷ついた細胞小器官や変性たんぱく質、細胞内病原体などを選択的に識別して分解できること(選択的オートファジー)も分かってきました(図2)。また、これらの選択的に分解されるターゲットのほとんどは、オートファゴソーム膜上のたんぱく質LC3と結合する性質を持っていることも明らかにされてきています。
東京大学 大学院医学系研究科の水島 昇 教授らの研究グループは、産業技術総合研究所 創薬分子プロファイリング研究センターの夏目 徹 研究センター長らのグループと共同で、オートファジーによって選択的に分解される分子の同定を目的とし、LC3分子種の1つであるLC3Bに結合するたんぱく質を網羅的に探索しました(図3)。その結果、細胞小器官の1つである小胞体注3)に存在する膜貫通たんぱく質TEX264の同定に成功しました。TEX264を欠損させた細胞ではオートファジーによる小胞体の分解(小胞体オートファジー)が顕著に抑制されたため、TEX264は小胞体オートファジーに関与する主要な受容体として機能していると考えました。さらに、TEX264に存在する長く柔軟な天然変性領域注4)が、リボソーム注5)(直径約20ナノメートル)により隔てられている小胞体とオートファゴソームの間を連結していることが明らかになりました(図4)。本研究成果は、オートファジーによって小胞体の品質を保つことの生理的重要性や細胞内の恒常性維持機構への関与、その破綻と疾患との関連の解明につながると考えられます。
本研究成果は、2019年4月18日(米国東部夏時間)に「Molecular Cell」オンライン版で公開されます。
本研究は科学技術振興機構(JST) 戦略的創造研究推進事業 総括実施型研究(ERATO)「水島細胞内分解ダイナミクスプロジェクト」(研究総括:水島 昇)、日本学術振興会 新学術領域研究「オートファジーの集学的研究」(領域代表:水島 昇)の計画研究「オートファジーの生理・病態生理学的意義とその分子基盤」として行われました。
<発表内容>
(1)研究の背景
オートファジーは細胞内の主要な分解系であり、飢餓などのストレスに対する応答や細胞内の品質の管理に重要な役割を果たします。オートファジーは、オートファゴソームという膜構造体によって担われる細胞内分解システムの1つです(図1)。細胞質の一部がオートファゴソームに取り囲まれ、リソソームと呼ばれる細胞小器官と融合し、リソソームに含まれる多数の酵素で分解されます。この過程でオートファゴソームによって細胞質内の直径約1マイクロメートルの領域がランダムに包み込まれるため、オートファジーは非選択的な分解機構と考えられてきました。しかし、最近になって、傷ついたオルガネラや特定のたんぱく質、細胞内の病原体が選択的にオートファジーにより分解されていることが明らかになってきました(図2)。また、これまでの選択的に分解されるターゲット(選択的基質)の多くは、オートファゴソーム膜上のたんぱく質の1つであるLC3と結合することでオートファゴソームに取り込まれることも分かってきました。オートファジーによって選択的基質をさらに見つけることは、オートファジーの役割を理解する上で大変重要です。
(2)研究内容
本研究では、哺乳類細胞を用いて今まで知られていない新規の選択的オートファジーの基質を同定し、哺乳類におけるオートファジーの生理的意義への理解につなげることを目的としました。
まず、選択的基質の多くがLC3と結合する性質を利用して、LC3分子種の1つであるLC3Bと結合するたんぱく質を網羅的に探索するという大規模スクリーニングを実施しました。選択的基質を精度良く同定するため、LC3Bに結合するたんぱく質群と、選択的基質を認識する部位に変異を導入したLC3B変異体に結合するたんぱく質群を質量分析によって同定し、それらを差分解析しました(図3)。基質認識部位依存的にLC3Bと結合するたんぱく質として同定されたものの中には、既知の選択的基質であるp62などが含まれており、本方法が有効であることが確認されました。さらに、新規の選択的基質として小胞体膜貫通たんぱく質TEX264を同定することに成功しました。
TEX264はオートファゴソームの膜たんぱく質群であるLC3Bと結合することで小胞体をオートファゴソームに誘導することが分かりました(図4)。また、CRISPR/Cas9法によってTEX264を欠損させた細胞では、小胞体オートファジーが顕著に抑制されており、TEX264が小胞体オートファジーに必要であることが明らかとなりました。これまでにいくつかの小胞体オートファジーの受容体が見つかっていますが、今回の詳細な解析によってTEX264はその中でも飢餓時の小胞体オートファジーに最も寄与する特に重要な分子であることが示唆されました。一方、小胞体オートファジーにおいては、分解される小胞体がオートファゴソーム膜と近接している必要があります。通常、小胞体の表面にはリボソームという直径約20ナノメートルの大きな複合体が結合しており(このような小胞体部分は粗面小胞体と呼ばれます)、小胞体膜とオートファゴソーム膜は20ナノメートル以上隔てられています。今回、TEX264は長い天然変性領域を持ち、この小胞体膜とオートファゴソーム膜の間をアンカーのようにつなぎ止め、小胞体膜とオートファゴソームの結合に関与していることが分かりました(図4)。以上のことから、TEX264が小胞体オートファジーの主要な受容体として機能することで、小胞体の選択的オートファジーに寄与していることが明らかになりました。
(3)社会的意義
近年、オートファジーとヒト疾患の関わりが注目されています。特に、オートファジー不能モデル動物は神経変性疾患様の症状を示し、いくつかのヒト神経変性疾患ではオートファジー関連遺伝子の変異が見つかっていることから、オートファジーと神経変性疾患との関わりは深いと考えられています。しかし、オートファジーのどのような機能が疾患と結びついているかについてはまだほとんど分かっていません。小胞体はたんぱく質の分泌、脂質合成などの酵素反応、イオン貯蔵などの多くの重要な機能を持つ細胞小器官であり、その機能不全は細胞死につながります。そのため、オートファジーによる小胞体の品質管理は細胞にとって重要であると考えられます。今回発見したTEX264は小胞体オートファジーの主要な受容体であることから、本研究が端緒となりオートファジーによる小胞体の品質管理や細胞内の恒常性維持機構、その破綻と疾患との関連について研究が進むことが期待されます。
<参考図>
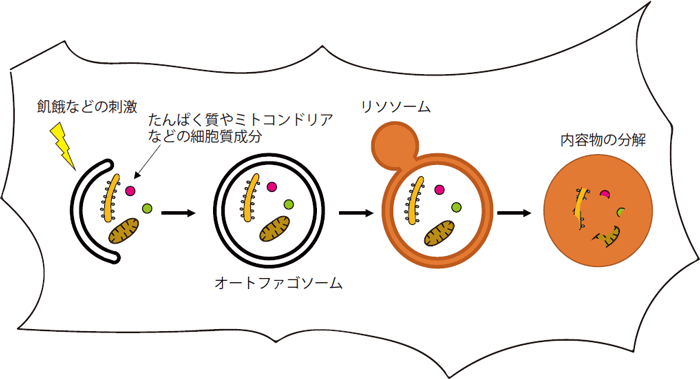
図1 オートファジーの仕組み
飢餓などのストレスでオートファジーが誘導されると、膜成分が細胞質成分を取り囲みながら伸長し、二重膜からなるオートファゴソームが形成される。続いて、オートファゴソームは分解酵素を含むリソソームと融合し、内容物が分解される。
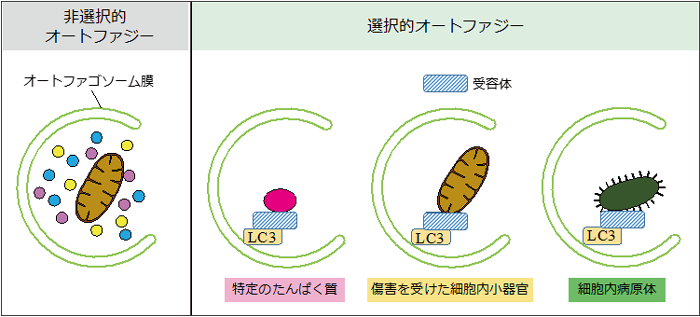
図2 非選択的オートファジーと選択的オートファジー
直径約1マイクロメートルの細胞質成分をランダムに取り囲み分解する非選択的オートファジー(左)と特定のたんぱく質や傷害を受けた細胞小器官、細胞内病原体などを選択的に分解する選択的オートファジー(右)の模式図。受容体は斜線の四角形で示した。
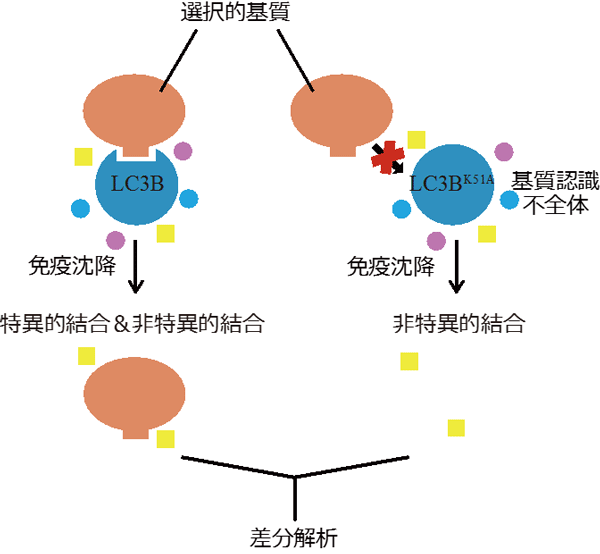
図3 新規選択的基質の網羅的探索のためのスクリーニング
野生型(正常)LC3Bと、LC3Bの選択的基質認識部位変異体(LC3BK51A)に結合するたんぱく質を質量分析法によって網羅的に同定し、両者の差分解析を行った。野生型LC3Bに結合し、変異体に結合しないたんぱく質を新規の選択的基質の候補とした。
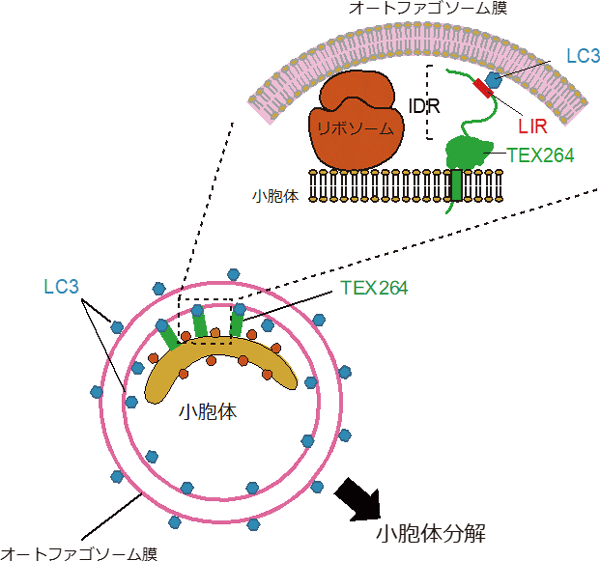
図4 小胞体オートファジーの新規受容体TEX264
TEX264は小胞体膜貫通たんぱく質でカルボキシ末端のLC3結合部位(LIR)を介してオートファゴソーム膜上のLC3と結合し、小胞体をオートファゴソーム上に誘導する受容体として機能する。長く柔軟な天然変性領域は、リボソームによって隔てられた小胞体膜とオートファゴソーム膜を連結するのに重要である。
<用語解説>
- 注1)(マクロ)オートファジー
- 細胞の主要な分解機能の1つ。オートファゴソームが細胞質基質やミトコンドリアなどの細胞小器官を取り囲み、リソソームと融合することで内容物を分解する仕組み(図1)。その生理的機能としては、飢餓への適応や細胞内の恒常性維持などが知られており、近年では特に神経変性疾患などとの関連が注目されている。
- 注2)オートファゴソーム
- オートファジー分解を仲介する細胞小器官で、細胞質に存在するたんぱく質やミトコンドリアなどを包み込む(図1)。オートファゴソームはリソソームと融合し、リソソーム内の分解酵素によって内容物が消化される。
- 注3)小胞体
- 細胞小器官の1つ。細胞内で合成されたたんぱく質の約3分の1は小胞体に挿入され、適切な折りたたみと修飾を受けてから分泌される。また、カルシウムなどのイオンの貯蔵や脂質合成、その他の代謝・解毒などの重要な役割を持つ。一般に、リボソームが付着している部分を粗面小胞体、付着していない部分を滑面小胞体と呼ぶ。
- 注4)天然変性領域
- たんぱく質が生体内で発現したときに特定の立体構造をとらない領域。折りたたまれて3次元構造体を形成する部位に比べると、長く柔軟である特徴を持つ。その生理的機能として、たんぱく質相互作用、液-液相分離、シグナル伝達などとの関連が知られている。
- 注5)リボソーム
- たんぱく質合成の場をなす細胞小器官。
<論文情報>
- タイトル:“Intrinsically disordered protein TEX264 mediates ER-phagy”
- 著者:Haruka Chino, Tomohisa Hatta, Tohru Natsume, Noboru Mizushima*
<お問い合わせ先>
<研究に関すること>
水島 昇(ミズシマ ノボル)
東京大学 大学院医学系研究科 分子細胞生物学専攻 分子生物学分野 教授
<JST事業に関すること>
内田 信裕(ウチダ ノブヒロ)
科学技術振興機構 研究プロジェクト推進部
<報道担当>
東京大学 大学院医学系研究科 総務係
科学技術振興機構 広報課


