2024-05-20 国立遺伝学研究所
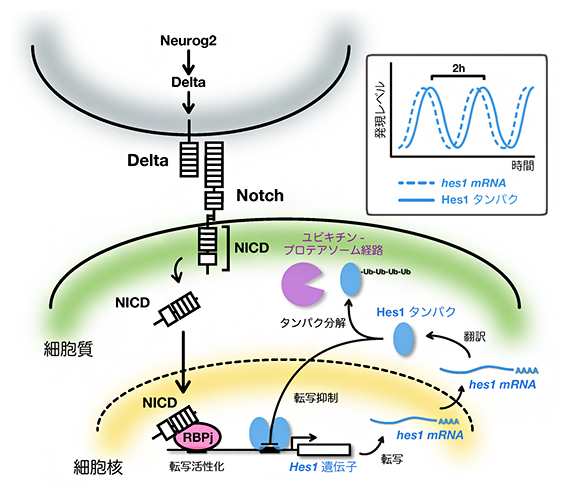
DNAは負に帯電したポリマーであり、正に帯電したコアヒストン八量体に巻き付き、ヌクレオソームを形成しています。コアヒストン八量体は、ヒストンH2A・H2B・H3・H4がそれぞれ二つずつ、合計8つのタンパク質で構成されています。それぞれのヒストンの末端には、特定の構造を持たず、さまざまな化学修飾を受ける「テール」と呼ばれる部分が存在します。ヒストンH2Aには2本のテールが存在するので、一つのヌクレオソームは合計で10本のヒストンテールを持っています。ヒストンテールの多数のリジン残基がアセチル化されると、その正電荷が中和され、DNAや隣接するヌクレオソームとの結合が弱まり、ヌクレオソーム間の相互作用が失われます。特に、ヒストンH4のテール上の特定のリジン残基のアセチル化は、試験管内でクロマチンの構造を劇的に変えることが知られていましたが、生きた細胞内で、特定のリジン残基のアセチル化が、そのアセチル化を持つヌクレオソームの動態にどのように影響するかは、これまで明らかではありませんでした。
今回、情報・システム研究機構 国立遺伝学研究所 ゲノムダイナミクス研究室のSemeigazin Adilgazy 総研大生 (国費外国人留学生)、飯田史織 総研大生 (元SOKENDAI特別研究員、学振特別研究員 DC2)、南克彦 総研大生(元SOKENDAI特別研究員、学振特別研究員 DC2)、田村佐知子 テクニカルスタッフ、井手聖 元助教(東京都医学総合研究所 研究員)、前島一博 教授のグループ、ゲノム進化研究室 東光一 助教、黒川顕 教授のグループ、比較ゲノム解析研究室 豊田敦 特任教授のグループは、ヒストンH4テールのアセチル化されるリジン残基を、脱アセチル化模倣型やアセチル化模倣型に変異させ、ユークロマチンにおけるその変異を含むヌクレオソームの局所的な動きを解析しました。その結果、変異体を含むヌクレオソームは、クロマチンドメイン(塊)に埋もれるため、変異によって動きは変化しないことが明らかになりました (図)。
本研究では、野生型(wt)または変異型ヒストンH4(H4K16の点変異、H4K5,8,12,16四重変異体、テールの欠失)をHaloTagと融合させ、HeLa細胞で異所的に発現させました。野生型およびH4-Halo変異型は、ユークロマチンに局在していました。また、wtH4-Haloヌクレオソームのゲノム領域は、ユークロマチンのHi-Cコンタクトドメインに対応していました。一分子ヌクレオソームイメージングを用い (動画)、H4の脱アセチル化やアセチル化を模倣したH4の変異のいずれも、その変異を含むヌクレオソームの平均の動きを変化させないことを発見しました。変異体を含むヌクレオソームは、多数の野生型が存在するクロマチンドメイン(塊)に埋もれるためと考えられます (図)。興味深いことに、H4の4 つのリジンをアルギニンに置換した変異型H4は、ヌクレオソームにあまり取り込まれず、大部分が核内を自由に拡散していました (図と動画)。さらに、テールを欠失した変異型H4は、ユークロマチンだけでなくヘテロクロマチンにも取り込まれていました (図)。本研究は、生きた細胞において、化学修飾の状態が異なる個々のヌクレオソームの挙動を理解するために、一分子ヌクレオソームイメージングが有効であることを示しています。
今年はRobert FeulgenによるDNA染色法発見100周年にあたります。本論文はそのことを記念した米国Histochemistry and Cell Biology誌の特集号” The Centennial of the Feulgen Reaction – Imaging the Genome”に掲載されました。
本研究は、日本学術振興会(JSPS) 科研費(24H00061, 21H02453, 23K17398, 22H05606, 21H02535, 23KJ0996、23KJ0998)、学術変革領域 A「ゲノムモダリティ」(20H05936)、科学技術振興機構(JST) JST 次世代研究者挑戦的研究プログラム(JPMJSP2104)、武田科学振興財団の支援を受けました。ゲノム解析については、先進ゲノム支援(22H04925(PAGS))の一環としておこなわれました。
動画: (左) 異所的に発現した野生型wtH4-Haloの動き。大部分がヌクレオソームに取り込まれ、その場でゆらいでいる。(右)脱アセチル化模倣型のH4四重変異体であるH4R-quadの動き。ヌクレオソームにあまり取り込まれず、大部分が自由に拡散する。
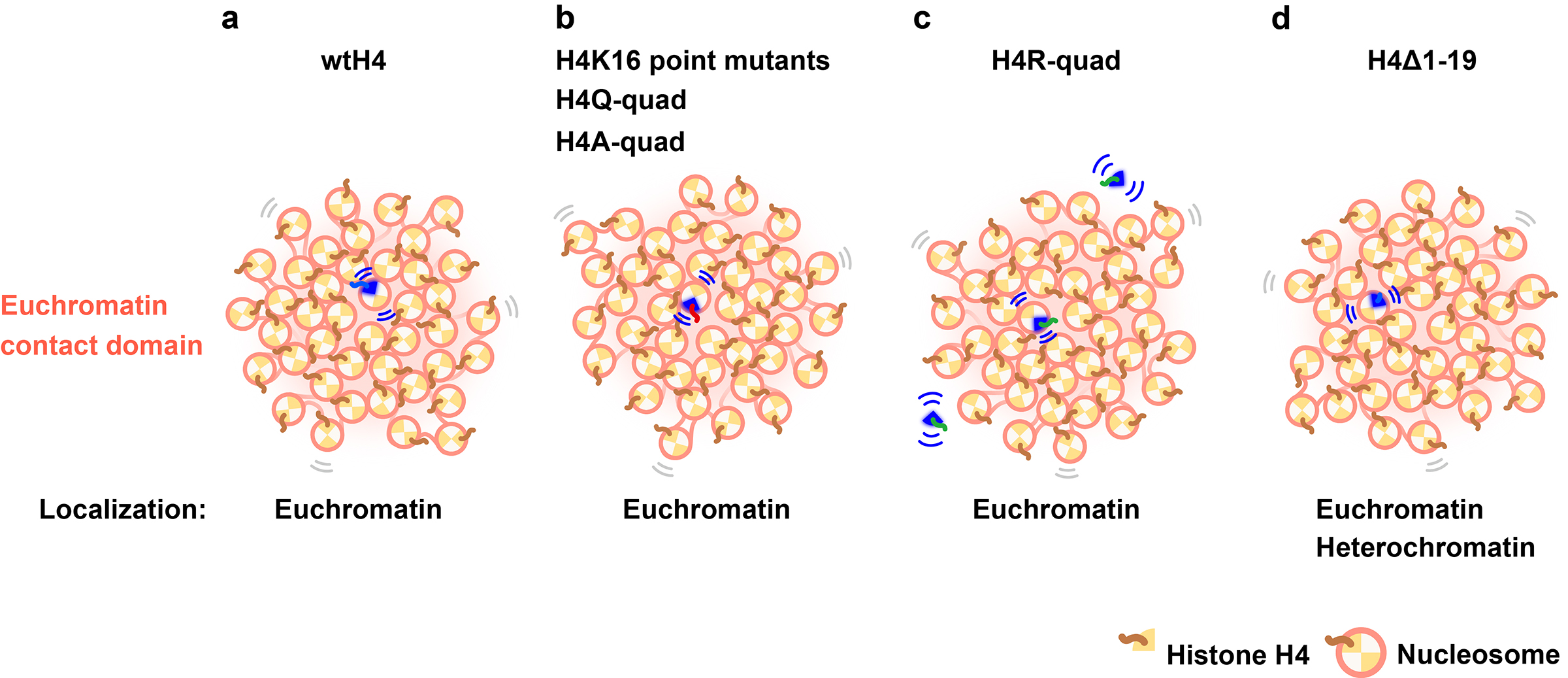
図:(a) 異所的に発現した野生型wtH4-Haloはユークロマチンのコンタクトドメインに局在し、H4テールを介して隣接するヌクレオソームと相互作用している。(b) H4テール上の変異(H4K16の点変異型、H4テールのリジンの四重変異型H4Q-quad、H4A-quad)は、局所的なヌクレオソームの動きには影響しなかった。これは、変異体を含むヌクレオソームが、凝縮したユークロマチンドメインに埋め込まれているためである。H4テール上の変異が隣のヌクレオソームとの相互作用を阻害したとしても、周囲の内在性 (野生型) H4を含む多数のヌクレオソームは、変異体を含むヌクレオソームとの接触を維持することができる。その結果、変異体を含むヌクレオソームの動きは変化しなかったと考えられた。(c) 脱アセチル化模倣型のH4四重変異型H4R-quadはヌクレオソームにあまり取り込まれず、大部分が自由に拡散する(動画参照)。しかし、取り込まれたものはwtH4-Haloと同様の動きを示す。(d)H4テール欠失変異体(H4Δ1-19)はユークロマチンとヘテロクロマチンの両方に取り込まれる。H4Δ1-19を含むヌクレオソームの平均の動きは、主にユークロマチンに局在するwtH4-Haloの平均の動きよりも小さかった。
Behaviors of nucleosomes with mutant histone H4s in euchromatic domains of living human cells.
Adilgazy Semeigazin, Shiori Iida, Katsuhiko Minami, Sachiko Tamura, Satoru Ide, Koichi Higashi, Atsushi Toyoda A, Ken Kurokawa, Kazuhiro Maeshima *
* 責任著者
Histochemistry and Cell Biology 2024 May 14 DOI:10.1007/s00418-024-02293-x