2024-05-29 国立がん研究センター,東海大学医学部,金沢大学,がん研究会,東北大学
発表のポイント
- テロメラーゼ逆転写酵素(hTERT)注1は、がんの発生や進展に広く関与していることが知られていますが、hTERTが新たな機序でがん化を促進することを明らかにしました。
- 元来、hTERTはテロメアと呼ばれる染色体末端を伸ばすことでがん化に関わるとされてきましたが、本研究は、hTERTが、がん細胞にとって有害なゲノム異常注2を排除し、がんの生存に有利に作用していることを発見しました。
- 多数のがん種を調べたところ、従来hTERTが存在しないとされていた肉腫注3でも、この機能が確認されました。
- 今回発見したhTERTの新たな機能を阻害したところ、がん細胞が死滅することも確認され、hTERTの新たな機能を標的にした治療法の開発につながることが期待されます。
概要
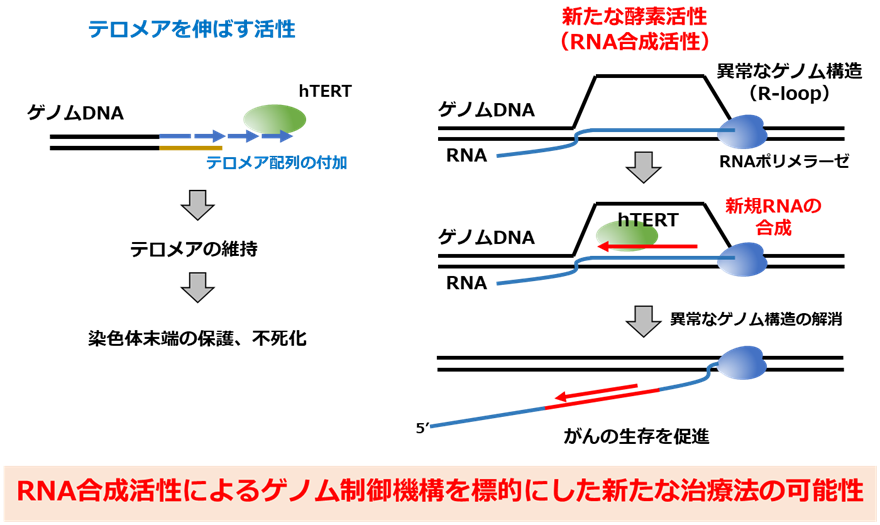
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)研究所(所長:間野博行)がん幹細胞研究分野の増富健吉 分野長、町谷充洋 研究員、野村祥 任意研修生(東海大学医学部医学科整形外科学 助教)を中心とする共同研究グループは、テロメア注4と呼ばれる染色体末端を伸ばすことでがん化に関わる(図1左)とされてきたテロメラーゼ逆転写酵素(hTERT)が、これまでとは異なる酵素活性によって、がん化を促進することを明らかにしました(図1右)。がん細胞は増殖する過程で、細胞死につながるゲノム異常が蓄積しますが、hTERTがRNAを合成することで、そのゲノム異常を排除することを見出しました(図1右)。すなわち、このhTERTの新たな機能は、ゲノムを修復して、がん細胞の生存を促進していました。
hTERTの存在を、さまざまながん細胞で調べたところ、この機能は、hTERTが存在しないと思われていた肉腫でも確認されました。さらに、このhTERTの新たな機能を阻害することで、がん細胞は生存できなくなり、死滅することが明らかになりました。これらの結果から、今後、hTERTのゲノム修復機能を標的にした新たながん治療法の開発につながることが期待されます。
本共同研究グループは、東海大学医学部医学科外科学系整形外科学の渡辺雅彦 教授、同・医学科基礎医学系分子生命科学の谷口俊恭 教授、金沢大学医薬保健研究域医学系消化器内科学の山下太郎 教授、がん研究会がん研究所がん生物部の斉藤典子 部長、東北大学大学院医学系研究科抗体創薬学分野の加藤幸成 教授らにより構成されたグループです。
本研究成果は、2024年5月28日に英国科学誌「Nature Cell Biology」に掲載されました。
図1 テロメラーゼ逆転写酵素によるゲノム制御機構の発見
左: テロメラーゼ逆転写酵素(hTERT)によりテロメアを維持する機能。
右: 新たな酵素活性(RNA合成活性)が、がん細胞にとって有害となる異常なゲノム構造を排除。
背景
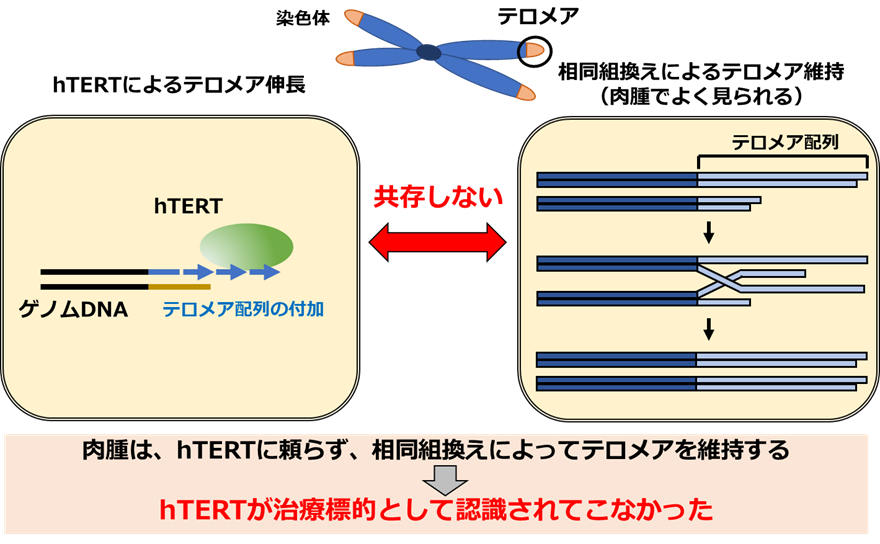
我々の遺伝情報が格納されているDNAの末端には、「テロメア」というDNAを保護するための配列が存在します。正常な細胞では、分裂のたびにテロメアDNAが少しずつ短くなるため、一定の回数しか細胞分裂することができませんが、がん細胞は独自にテロメアを維持する方法を持っていて、無制限に増殖することが可能です。これに関与しているのが、「テロメラーゼ」といわれる酵素です。テロメラーゼは、鋳型となるRNAとテロメラーゼ逆転写酵素(hTERT)というタンパク質の複合体で、DNA末端にテロメア配列を付加することができるため、がん細胞はテロメア配列を維持しながら増殖できます。これまでに、世界中のがん研究者が、テロメラーゼを阻害する抗がん剤の開発を進めてきましたが、有望な抗がん剤の開発には至っていません。一方で、骨や筋肉などにできる腫瘍である肉腫などは、このテロメラーゼに頼らず、隣り合うテロメア配列同士をコピーする相同組換えという機序で、テロメアを維持します(図2)。したがって、これまでの研究では、肉腫をはじめとする希少がんの治療において、テロメラーゼや、その酵素活性を示す構成因子であるhTERTは、治療標的として認識されてきませんでした(図2)。
本研究グループでは、これまでhTERTに、テロメアを伸長する機能とは異なる新たな機能があることを発見し、その分子機序の解明を進めてきました。本研究では、hTERTの新たな機能であるRNA合成活性について明らかにするとともに、肉腫を含む多様ながん種におけるhTERTの発現解析、また、その発現ががん化につながる機序の解明を目指しました。
図2 テロメアを維持する機序
左: テロメラーゼ逆転写酵素(hTERT)がテロメア配列を付加してテロメアを維持。
右: 隣り合うテロメア配列同士をコピーする相同組換えという機序でテロメアを維持。
2つのテロメア維持機構は共存しないことが知られている。
研究成果
1. テロメラーゼ逆転写酵素(hTERT)が肉腫でも発現していることを発見
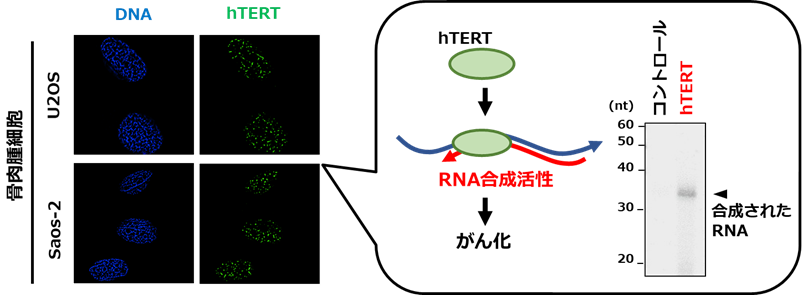
本研究グループは、独自に開発したhTERTの発現を調べる方法を用いて、さまざまながん細胞におけるhTERTの有無を調べました。その結果、hTERTに頼らずテロメアを維持する肉腫細胞でも、hTERTの発現が確認されました(図3左)。また、その理由を詳細に解析したところ、hTERTが特定のRNAを鋳型にしてRNAを合成することを発見しました(図3右)。
図3 肉腫におけるテロメラーゼ逆転写酵素(hTERT)の機能
左図:骨肉腫細胞を用いた解析で、hTERTの発現が確認された(緑色)。
右図:骨肉腫細胞から集めたhTERTのRNA合成活性を調べた実験。人工的に合成したRNAを鋳型にして、RNAが合成されたことを確認。
2. 新たな酵素活性を抑えることで腫瘍の形成を阻害
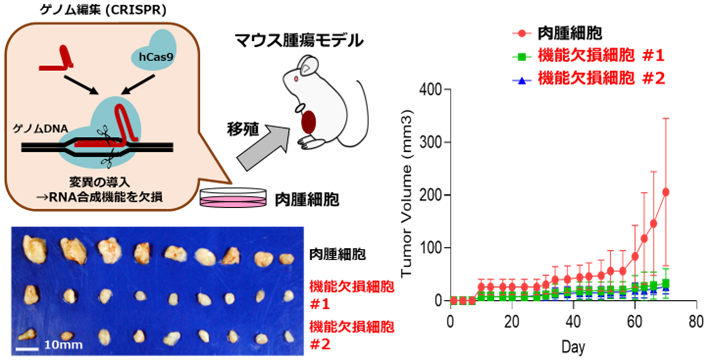
このhTERTのRNA合成活性が細胞のがん化に与える影響を調べるために、hTERTのRNA合成活性を抑えた肉腫細胞を作ることにしました。細胞内の特定の遺伝子を改変する技術であるゲノム編集注5法を用いて、hTERT遺伝子に変異を加えることで、hTERTによってRNAを合成できない細胞を作りました。この細胞を用いて、細胞のがん化する能力を調べたところ、hTERTによってRNAを合成できない肉腫細胞をマウスに移植しても、腫瘍は大きくなりませんでした(図4)。つまり、腫瘍が大きくなるには、hTERTのRNA合成活性が必要であることが明らかになりました。
図4 テロメラーゼ逆転写酵素(hTERT)の新たな機能を抑えた肉腫細胞の解析
ゲノム編集と呼ばれる遺伝子変異を誘導する方法で、hTERTのRNA合成活性を抑えた。
hTERTによってRNAを合成できない肉腫細胞を移植しても、腫瘍は大きくならない。
3. がん細胞にとって有害となるゲノム異常を排除していることを発見
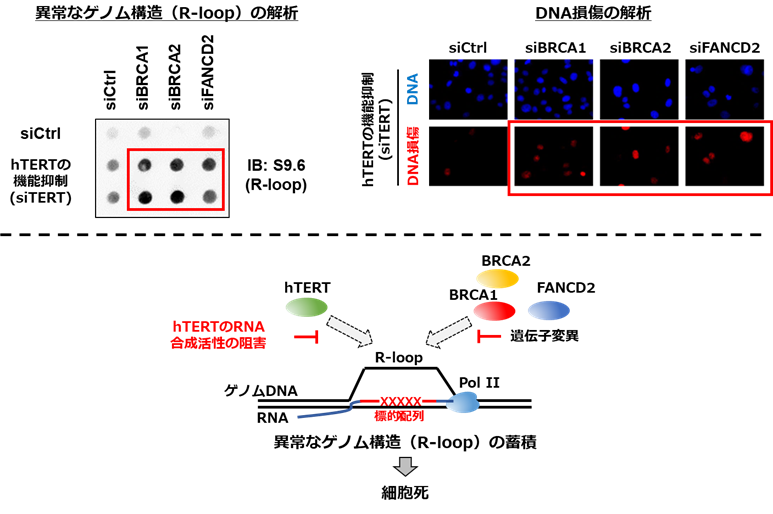
このhTERTのRNA合成活性が細胞のがん化をどのように促進しているのかを調べるために、がん細胞からhTERTが含まれる構造体を精製し、hTERTに結合する因子の解析を実施しました(図5)。その結果、hTERTが異常なゲノム構造(R-loop注6)に結合していることを発見しました(図5右下)。R-loop構造は、ゲノムDNAとそれに相補的なRNAが結合することで生じる核酸構造で、過剰なR-loop構造はDNA損傷や細胞死につながることが知られています。この異常なゲノム構造に対するhTERTの影響を調べたところ、hTERTの機能を抑えると、異常なゲノム構造が増えることが明らかになりました。特に、この異常なゲノム構造を解消すること知られている他の因子(BRCA1, BRCA2, FANC)と同時に機能を抑えると、異常なゲノム構造が顕著に蓄積しました(図6左上)。また、この異常なゲノム構造の増加に伴って、細胞死を誘導するDNA損傷注7が生じていました(図6右上)。以上の結果より、hTERTは、そのRNA合成活性によって、細胞内の異常なゲノム構造を排除していることが明らかになりました。また、hTERTと他のゲノム制御に関わる因子(BRCA1, BRCA2, FANC)を同時に抑えることで、がん細胞に対して、強い細胞死を誘導できることが明らかになりました。
図5 hTERTに結合する因子の解析
上: がん細胞からhTERTが含まれる「場所」を精製し、hTERTに対する抗体を用いて、hTERT複合体とそれに結合する因子を精製した。
左下: がん細胞から精製したサンプルにhTERTが含まれることを確認。最終精製サンプル(赤字)にhTERTが濃縮されていた。
右下: 精製したhTERTに結合する因子を解析。HeLa細胞(子宮頸がん細胞)とU2OS細胞(骨肉腫細胞)から回収したhTERTは、異常なゲノム構造(R-loop)に結合していた。
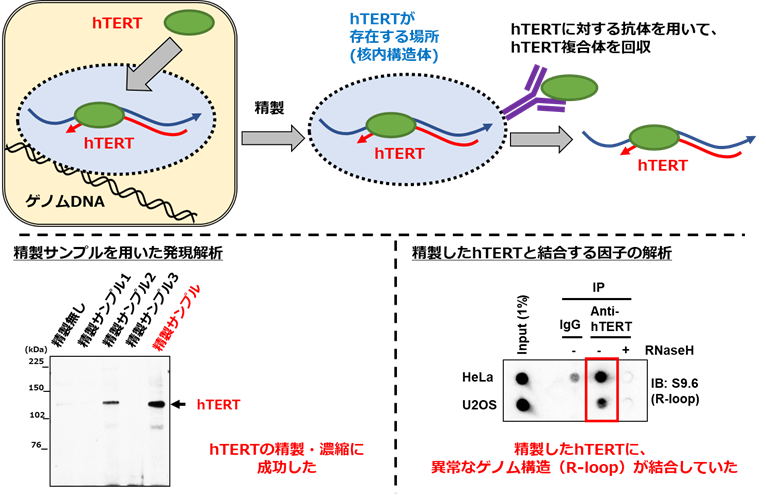
図6 テロメラーゼ逆転写酵素(hTERT)によるゲノム制御機構の検証
上: hTERTと他の因子(BRCA1, BRCA2, FANC)によるゲノム制御機能を抑えると異常なゲノム構造(左上)とDNA損傷(右上)が蓄積した(赤枠)。
下: hTERTは異常なゲノム構造(R-loop)を形成する配列(標的配列:赤字)に対して、RNAを合成することで、このR-loop構造を解消する。
一方で、このR-loop構造に対する、hTERTと他の因子(BRCA1, BRCA2, FANC)によるゲノム制御機能を抑えることで、R-loop構造が蓄積し、がん細胞死を誘導できる。
展望
本研究グループでは、多様ながん種におけるhTERTの発現解析、ならびに、機能解析を実施し、これまでにhTERTが見つかっているがんだけでなく、肉腫のようなhTERTが確認されていなかったがんでも、hTERTが発現していることを発見しました。また、hTERTの機能を抑制することで、がん細胞に対して、強い細胞死を誘導できることを明らかにしました。骨や軟部組織から発生する悪性腫瘍である肉腫は非常に多様性に富んだ希少がんで、治療法の開発が遅れています。本研究成果をもとに、hTERTの新規機能を標的とした、肉腫などの多様ながんに対する抗がん剤の開発に向けた研究が進むことが期待されます。
発表論文
雑誌名
Nature Cell Biology
タイトル
Maintenance of R-loop structures by phosphorylated hTERT preserves genome integrity
著者
Mitsuhiro Machitani†, Akira Nomura†, Taro Yamashita, Mami Yasukawa, Saori Ueki, Ken-Ichi Fujita, Toshihide Ueno, Akio Yamashita, Yoshikazu Tanzawa, Masahiko Watanabe, Toshiyasu Taniguchi, Noriko Saitoh, Shuichi Kaneko, Yukinari Kato, Hiroyuki Mano, Kenkichi Masutomi* (†筆頭著者 *責任著者)
掲載日
2024年5月28日10時(英国時間)
DOI
10.1038/s41556-024-01427-6
URL
https://www.nature.com/articles/s41556-024-01427-6
研究費
- 国立研究開発法人日本医療研究開発機構(AMED)
次世代がん医療加速化研究事業「hTERTのRdRP活性によるゲノム安定性制御機構の解明と希少がんへの治療応用」(研究代表者:町谷 充洋) - 国立研究開発法人日本医療研究開発機構(AMED)
次世代がん医療創生研究事業「TERT-RdRP阻害剤によるがん治療法の開発」(研究代表者:増富 健吉) - 国立研究開発法人日本医療研究開発機構(AMED)
革新的がん医療実用化研究事業「TERT関連バイオマーカーによる疾患横断的(バスケット型)診断法の確立に関する研究」(研究代表者:増富 健吉) - 国立研究開発法人日本医療研究開発機構(AMED)
肝炎等克服緊急対策研究事業「C型慢性肝炎治療後の肝発がんを予防する研究」(研究代表者: 水腰 英四郎) - 国立研究開発法人日本医療研究開発機構(AMED)
生命科学・創薬研究支援基盤事業(BINDS)「高難度糖タンパク質生産のための糖鎖細胞工学による支援と立体構造認識抗体作製の高度化」(研究代表者: 加藤 幸成) - 日本学術振興会
科学研究費助成事業「テロメラーゼ逆転写酵素による遺伝子発現制御が標的とする新規遺伝子の同定」(研究代表者:町谷 充洋) - 国立がん研究センター研究開発費
萌芽的研究課題「R-loop制御機構を標的とした治療法の開発」(研究代表者:町谷 充洋) - 公益財団法人上原記念生命科学財団
研究助成金「USP28によるファンコニ貧血BRCA経路の制御機序」(研究代表者:谷口 俊恭) - 研究費名:徳田記念がんゲノム研究基金
徳田記念がんゲノム研究基金・コアチーム「がんゲノムに関わる基礎研究の振興と人材育成」(研究代表者:谷口 俊恭)
用語解説
注1 テロメラーゼ逆転写酵素(hTERT)
テロメラーゼは、テロメアとよばれる染色体DNAの末端に特徴的な反復配列を付加する酵素であり、多くのがんで発現が上昇し、がん細胞の不死化につながる。テロメラーゼ逆転写酵素(hTERT)は、テロメラーゼの主要サブユニットの一つで、テロメアにTTAGGGを付加する活性を示す。近年、テロメラーゼに関連しないhTERTの新たな機能が明らかになり、分子機序などに関する解明が進められていた。
注2 ゲノム異常
我々の遺伝情報が格納されているゲノムDNAに生じる有害な変化。ゲノムDNAを構成する塩基の挿入、欠失、置換などの変異や特定のDNAが複数生じるコピー数異常が知られている。その他に、通常の二本鎖DNAの構造が変化する構造異常も含まれる。
注3 肉腫
全身の骨や軟部組織(筋肉、脂肪など)から発生する悪性腫瘍。代表的なものとして、骨肉腫、軟骨肉腫、脂肪肉腫、平滑筋肉腫などがある。発生頻度は、悪性腫瘍全体の1%以下であり、希少がんである。
注4 テロメア
染色体DNAの末端にある構造で、染色体末端を保護する機能を持つ。哺乳類ではTTAGGGの塩基の繰り返し配列とタンパク質から成る。正常細胞は分裂するたびにテロメアが少しずつ短くなり、細胞分裂の停止につながる。一方で、がん細胞は、テロメアを伸長させる酵素であるテロメラーゼの発現上昇や、隣り合うテロメア配列同士をコピーする相同組換えという機序でテロメアの短縮を防いでいる。
注5 ゲノム編集
核酸を切断する酵素(CRISPR/Cas9など)を用いて、細胞内の遺伝子の狙った部分を切断や他の遺伝子と置換する技術。この技術により、細胞の特定の遺伝子の機能を抑えることや、活性化させるなどの操作が可能となり、生命現象の検証に汎用されている。
注6 R-loop
二本鎖DNAから成るゲノムDNAに、RNAが挿入し、RNA:DNAのハイブリッドが形成されるゲノム構造。この3本の核酸で構成される構造がR-loopで、RNAの転写や相同組換えなどに関与する一方で、過剰なR-loop構造はDNA損傷を誘導し、細胞死につながる。細胞は、R-loop構造を制御するための因子を発現することで、R-loopの蓄積を防いでいる。
注7 DNA損傷
放射線や紫外線、活性酸素等、さまざまな要因により傷つけられたDNAの変化。DNA損傷により、DNAはDNA基の欠失や化学的な変化が起こり別のものに変わる。また、強いDNA損傷が誘導されると、ゲノムDNAが切断され、細胞死が誘導される。
問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター
研究所 がん幹細胞研究分野 分野長
増富 健吉
研究所 がん幹細胞研究分野 研究員
町谷 充洋
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
東海大学医学部付属病院
事務部事務課(広報)
金沢大学医薬保健系事務部
総務課総務係
公益財団法人がん研究会
社会連携部広報課
東北大学大学院医学系研究科・医学部
広報室