2024-06-04 国⽴国際医療研究センター,東京大学定量生命科学研究所
発表概要
【研究成果のポイント】
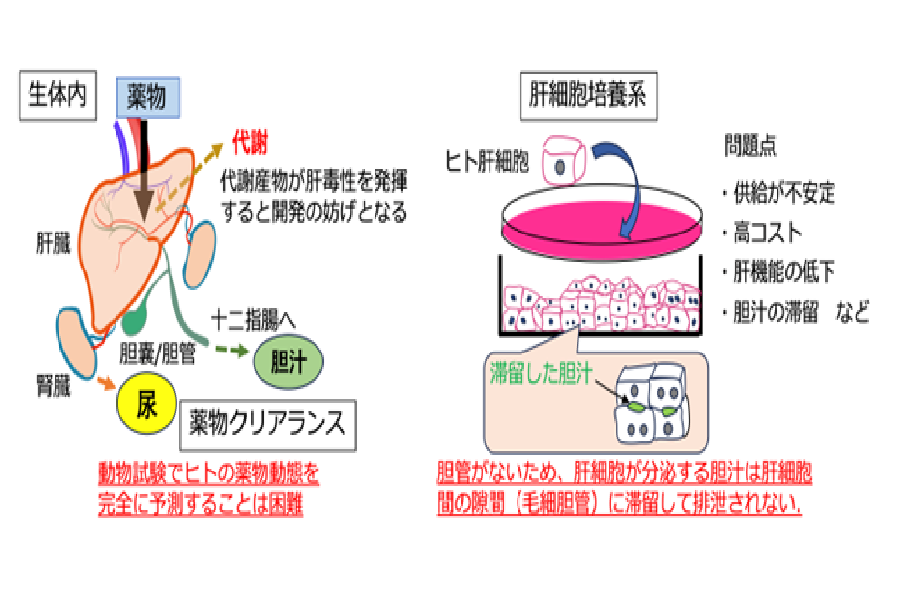
肝臓は薬物代謝の中枢を担う臓器であり、ADMET(薬物が体内に取り込まれてから排出されるまでの過程や肝毒性)に関する情報は製薬企業が新薬を開発する上で必要不可⽋な情報となります。それらの情報を得るために、これまでは動物試験やヒト肝細胞の初代培養系などが⽤いられてきましたが、動物試験では、ヒトの ADMET を完全に予測することはできないこと、ヒト肝細胞培養系では、胆管が備わっていないことから胆汁排泄の流れを再現できない等の問題がありました。
国⽴研究開発法⼈ 国⽴国際医療研究センター(略称︓NCGM)細胞組織再⽣医学研究部の⽥中稔室⻑と東京⼤学⼤学院新領域創成科学研究科 王路遥(ワン ルーヤウ)⼤学院⽣らの研究グループは、同⼤学定量⽣命科学研究所 ⽊⼾丈友特任講師、宮島篤特任教授、同⼤学⼤学院薬学系研究科 楠原洋之教授、同⼤学⼤学院⼯学系研究科 酒井康⾏教授らの研究グループとの共同研究により、胆汁排泄を再現することが可能なヒト肝組織平⾯培養系を作製することに初めて成功しました。本研究では、ヒト iPS 細胞から肝細胞と胆管細胞を同時に分化・融合させることにより、ヒト肝組織を模倣する肝胆オルガノイド(hHBO)を作製しました。さらに、既存薬を⽤いた解析から、胆汁排泄や肝毒性を予測できる可能性を⽰しました。今回開発された hHBO は、今後、創薬のための薬物動態試験や肝疾患研究に応⽤されることが期待されます。
【研究の背景】
肝臓は、薬物の代謝や解毒において重要な役割を果たしており、服⽤した医薬品の多くは肝臓内で毒性の低い⽔溶性物質に変換され、尿や胆汁の形で体外に排出されています。そのため、薬がどの程度の期間、体内に留まり、肝臓でどのように代謝され、どのような経路で最終的に体外に排出されるのか、といった ADME※1 に関する情報は薬の治療効果を予測する上で極めて重要な情報となります。⼀⽅、創薬において、薬が肝臓で代謝されることで毒性を発揮し、副作⽤が発現した場合、新薬の開発は中⽌に追い込まれるため、ADMET の予測は製薬企業にとっては必要不可⽋な情報となります。このような薬物の体内動態を調べるために、これまで主に動物試験が⾏われてきました。しかし、動物とヒトでは肝臓の代謝能⼒に種差があるため、ヒトでの薬物動態を完全に予測することは困難であるという問題がありました。
その代替法として、ヒト肝細胞を⽤いた培養系が利⽤されてきましたが、安定供給やコスト、機能⾯で問題があるだけでなく、胆汁排泄を担う胆管が備わっていないために、胆汁の流れを再現できないといっ
た問題がありました(下図)。
【研究内容と結果】
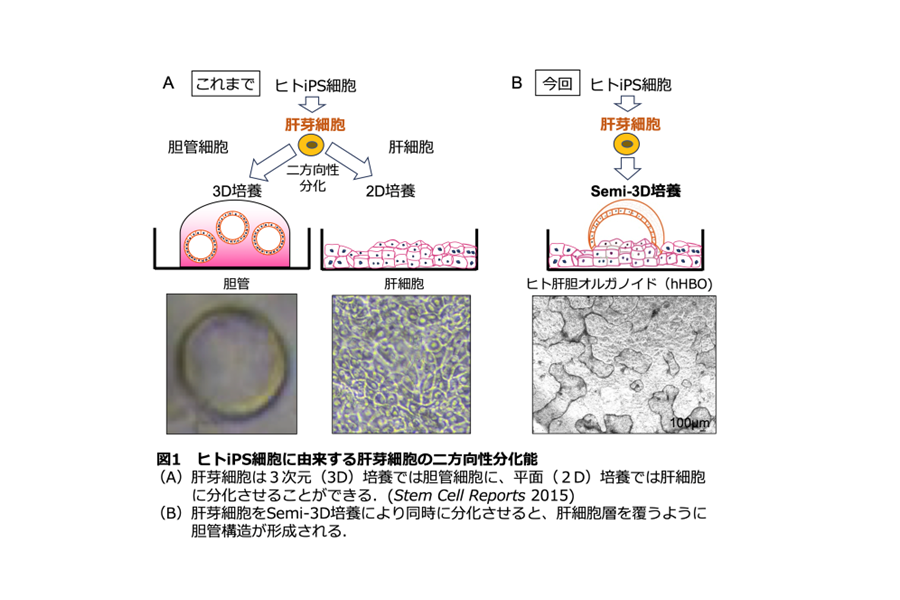
本研究では、前述した創薬研究における様々な問題点を解決することを⽬的とし、ヒト iPS 細胞から胆汁排泄を可能とする肝組織を作製することを⽬指しました。私たちは以前に肝臓の元となる肝芽細胞※2 を iPS 細胞から誘導することに成功していました(1)。この肝芽細胞は肝細胞と胆管にそれぞれ分化できることは分かっていましたが(図 1A)、今回、この細胞から肝細胞と胆管を同時に分化・融合させることにより、肝細胞層の上部に胆管構造が配置されたヒト肝胆オルガノイド(hHBO)を作製することに成功しました(図 1B)。
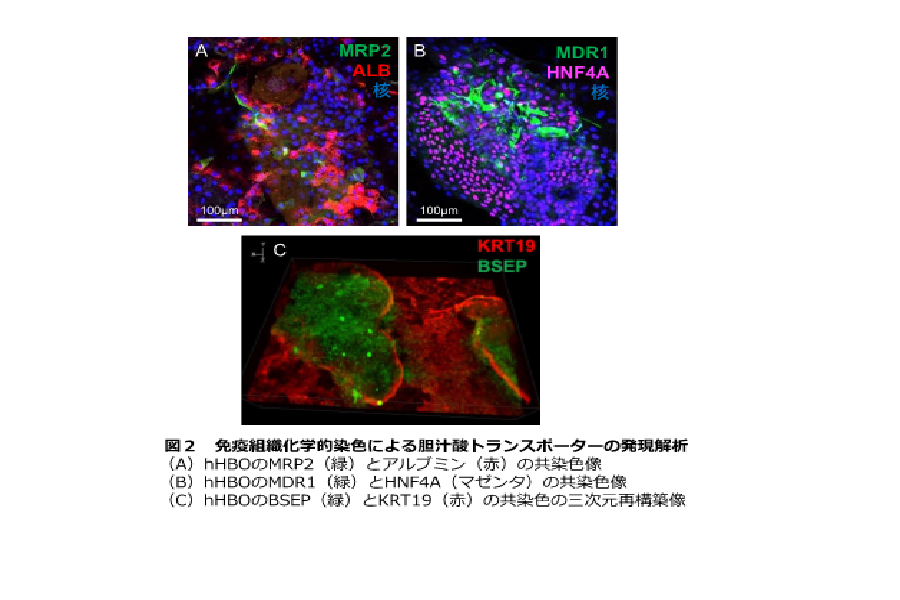
 さらに、hHBO が胆汁排泄能を有するのか調べるために、底部の肝細胞に胆汁排泄に働く分⼦が発現しているかを調べたところ、複数の胆汁酸トランスポーター※ 3が発現していることが確認されました(図2)。
さらに、hHBO が胆汁排泄能を有するのか調べるために、底部の肝細胞に胆汁排泄に働く分⼦が発現しているかを調べたところ、複数の胆汁酸トランスポーター※ 3が発現していることが確認されました(図2)。
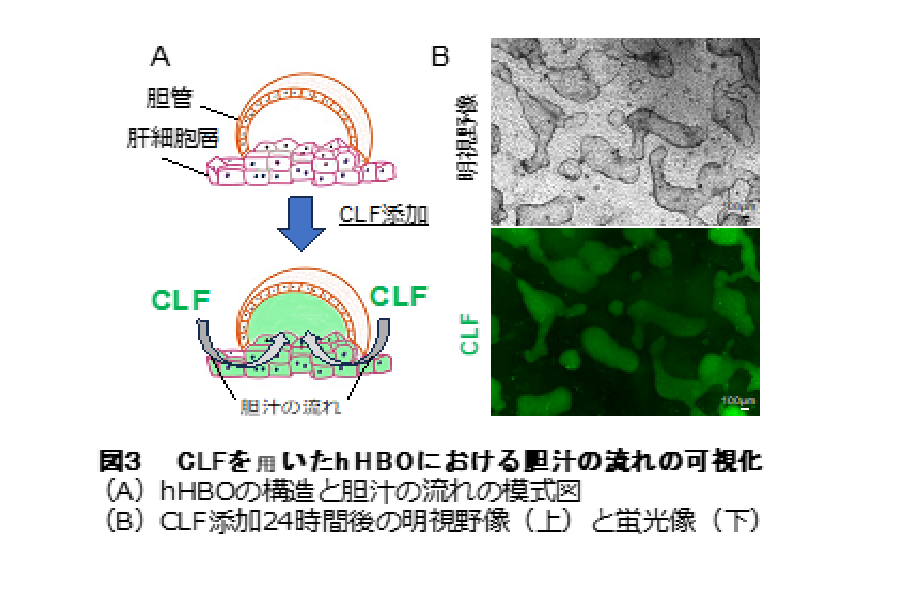
 さらに、蛍光胆汁酸アナログである CLF※ 4 を hHBO に添加すると、肝細胞に取り込まれた CLF が胆管内に蓄積していく様⼦が観察され、hHBO は胆汁の流れを再現できることがわかりました(図3)。
さらに、蛍光胆汁酸アナログである CLF※ 4 を hHBO に添加すると、肝細胞に取り込まれた CLF が胆管内に蓄積していく様⼦が観察され、hHBO は胆汁の流れを再現できることがわかりました(図3)。
最後に、hHBO がヒトの肝臓と同様の胆汁排泄を再現しているのかを調べました。胆汁中に排泄されることが分かっている実薬としてオルメサルタンとバルサルタンを hHBO に添加したところ、それらが胆管構造内に排泄されていることを⽰す結果が得られました。さらに、重篤な肝毒性の副作⽤を理由に販売中⽌となった2型糖尿病治療薬トログリタゾンを、hHBO に添加して肝毒性の評価を⾏ったところ、胆汁の流れが阻害される胆汁うっ滞とともに肝細胞が死ぬことが確認されました(図4)。トログリタゾンが実験動物を⽤いた安全性試験では肝毒性を⽰さなかったことを考えると、この結果は、hHBO がヒト肝臓としての応答性を発揮した結果と⾔えます。私たちは、iPS 細胞から胆汁排泄の流れを再現できるヒト肝組織平⾯培養系を作製し、肝代謝、薬物クリアランス、肝毒性を予測できる可能性を⽰しました。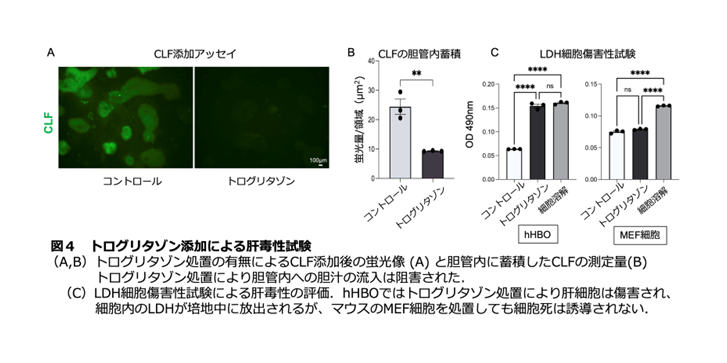
【コメント】
⽶国環境保護庁(EPA)は 2035 年までに動物実験を全廃することを提⾔しており、ヒト ADMET を正確に予測できる代替法の開発は喫緊の課題となっています。今回の成果は、ヒト iPS 細胞由来の肝組織を薬物動態試験に利⽤していくための第⼀歩と捉えており、⽣体模倣システム(MPS)への応⽤も⾒据え、創薬研究のためにさらなる改良を進めています。また、hHBO を基盤技術とし、慢性肝炎から肝硬変に⾄る過程を再現可能な「肝疾患モデル培養系」の確⽴にも取組んでおり、新規治療法開発のために役⽴てていきたいと考えています。
研究助成
本研究は、⽇本医療研究開発機構(AMED)「⾰新的先端研究開発⽀援事業」(AMED-CREST)(JP18gm1210002)、「再⽣医療・遺伝⼦治療の産業化に向けた基盤技術開発事業」(JP21be0304201)、「再⽣医療実⽤化研究事業」(JP21bk0104136)、国際医療研究センター開発費(23A1005)、創薬等先端技術⽀援基盤プラットフォーム(BINDS)(JP23ama121051)の⽀援を受けて実施されました。
用語解説
※1: ADME
薬物が投与されてから体外に排出されるまでの過程 “吸収(Absorbance)-分布(Distribution)-代謝(Metabolism)-排泄(Excretion)”の頭⽂字を並べた略語。毒性(Toxicity)の頭⽂字を加えて ADMETとも呼ばれる。薬の副作⽤を抑え、⼗分な効果を発揮させるためには、ADMET の最適化が重要な鍵となる。
※ 2 肝芽細胞
胎児で肝臓が発⽣する過程で出現する前駆細胞。肝芽細胞は肝機能の⼤部分を担う肝細胞と肝細胞が分泌する胆汁を⼗⼆指腸に排出するための胆管細胞のニ⽅向に分化することができる。
※ 3 胆汁酸トランスポーター
胆汁酸の輸送に関わるタンパク質。肝細胞では細胞膜上に Bile salt export pump (BSEP)などの胆汁酸トランスポーターが発現することが知られている。その機能を阻害する薬物は胆汁の流れを妨げるため、胆汁うっ滞を引き起こす可能性がある。
※ 4 CLF
Cholyl-Lysyl-Fluorescein (CLF)は蛍光物質が付加された胆汁酸の類縁体。培養肝細胞や動物実験において胆汁を可視化するために⽤いられている。
雑誌名等
雑誌名:Biomaterials
題 名:Establishment of human induced pluripotent stem cell-derived hepatobiliary
organoid with bile duct for pharmaceutical research use
著者名:Wang L, Koui Y, Kanegae K, Kido T, Tamura-Nakano M, Yabe S, Tai K, Nakajima Y, Kusuhara
H, Sakai Y, Miyajima A, Okochi H, Tanaka M*.(*責任著者)
DOI: 10.1016/j.biomaterials.2024.122621
URL: https://doi.org/10.1016/j.biomaterials.2024.122621
掲載日時:日本時間 2024 年 5 ⽉ 29 ⽇(⽔)
問い合わせ先
■研究に関すること
国⽴国際医療研究センター研究所 細胞組織再⽣医学研究部
細胞療法開発研究室⻑
(⽒名)⽥中 稔(たなか みのる)
■取材に関すること
国⽴研究開発法⼈ 国⽴国際医療研究センター 企画戦略局 広報企画室
国⽴⼤学法⼈ 東京⼤学 定量⽣命科学研究所 総務チーム
国⽴⼤学法⼈ 東京⼤学 ⼤学院薬学系研究科 庶務チーム