2024-09-04 京都大学iPS細胞研究所
ポイント
- 難治性の非定型3q26/MECOM 転座t(3;8)(q26.2;q24)を有する骨髄異形成症候群(MDS)注1)の患者さんの血液から疾患特異的iPS細胞(MDS-iPS細胞)を樹立、病態モデルを作製した。
- BET阻害剤注2)がt(3;8)(q26.2;q24)を有する骨髄性腫瘍の新規治療薬となる可能性が示唆された。
- MDS-iPS細胞を用いることで、十分量の腫瘍検体を採取することが困難なMDS症例のスーパーエンハンサー注3)の機能解析および治療標的評価が可能であることを示した。
1. 要旨
中村 桃子 研究員、蝶名林 和久 助教(京都大学大学院医学研究科血液内科学、CiRA増殖分化機構研究部門)、高折 晃史 教授(京都大学大学院医学研究科血液内科学)および吉田 善紀 准教授(CiRA増殖分化機構研究部門)らの研究グループは、治療抵抗性の非定型3q26/MECOM 転座t(3;8)(q26.2;q24)を有する骨髄異形成症候群(MDS)の患者さんからiPS細胞(MDS-iPS細胞)を作製することに成功しました。
樹立したMDS-iPS細胞は元の症例と同様の核型異常を保持しており、正常iPS細胞と同様に未分化性を維持したまま長期間増幅することが可能でした。MDS-iPS細胞から分化した造血前駆細胞は、コロニー形成能、血液分化能が著明に障害されており、MDSの病態を再現することが可能でした。さらにMDS-iPS細胞由来の造血前駆細胞に、スーパーエンハンサーを抑制するBET阻害剤であるJQ1を投与することによって、MECOM 遺伝子の過剰発現が抑制され、細胞死が誘導されました。このことから、BET阻害剤が非定型3q26/MECOM 再構成を有する骨髄性腫瘍注4)の新規治療薬となる可能性が示唆されました。
疾患特異的iPS細胞を用いた新しいプラットフォームは、MDSなどの骨髄性腫瘍のみならずエンハンサー・ハイジャッキング注5)が関与する腫瘍性疾患全体の病態解明や創薬研究において有用なツールとなることが期待されます。
この研究成果は2024年8月26日に国際科学誌「British Journal of Haematology」でオンライン公開されました。
2. 研究の背景
転座注6)などによって引き起こされる染色体構造異常注7)は、その切断点に位置する遺伝子の異常を引き起こし、さまざまな疾患の原因となります。染色体構造異常によりエンハンサーが本来の標的とは異なる遺伝子に結合することで、がん遺伝子が異常に活性化されることがあります。この現象は「エンハンサー・ハイジャッキング」と呼ばれ、骨髄異形成症候群(MDS)や急性骨髄性白血病(AML)注8)などの骨髄性腫瘍を含む悪性腫瘍全般で報告されています。代表的なエンハンサー・ハイジャッキングと関連した染色体構造異常としては、3番染色体逆位inv(3)(q21.3q26.2)および転座t(3;3)(q21.3;q26.2)があり、これらの構造異常はGATA2 遺伝子のエンハンサーが構造異常によってMECOM 遺伝子の転写開始点の近傍に移動しMECOM の高発現を誘導することで、MDSやAMLを引き起こします。これら以外にも数多くのMECOM 遺伝子の再構成を来す構造異常が報告されており、腫瘍化との関連が示唆されているものが数多く存在しますが、いずれもMECOMの高発現を引き起こし、非常に予後が不良であることが知られています。その中でも、t(3;8)(q26.2;q24)を伴う骨髄性腫瘍は、生存中央値が6か月未満と特に予後が不良です。これらの報告を受け、2022年のWHO分類注9)では、MECOM 遺伝子再構成を伴うAMLを一つのカテゴリーとして認めました。
MDSやAMLに高頻度に認める複雑な染色体構造異常を有する細胞株の作製は、CRISPRなどのゲノム編集技術では困難なことが多いです。近年、リプログラミング技術を用いることでMDSやAMLのような腫瘍性疾患からでもiPS細胞を作製することが可能であることが報告されています。そこで、研究グループは非定型MECOM 転座を有するMDS患者さんからiPS細胞を作製し造血前駆細胞へ分化させることで、病態モデルの構築を試みました。
3. 研究結果
1)MDS患者さんから二種類のiPS細胞を作製した
t(3;8)(q26.2;q24)を伴うMDS患者さんの末梢血単核細胞からiPS細胞を樹立しました。患者さんの染色体構造異常のないT細胞から正常iPS細胞を、染色体構造異常のある細胞(MDS細胞)からMDS-iPS細胞を作製しました(Fig. 1)。
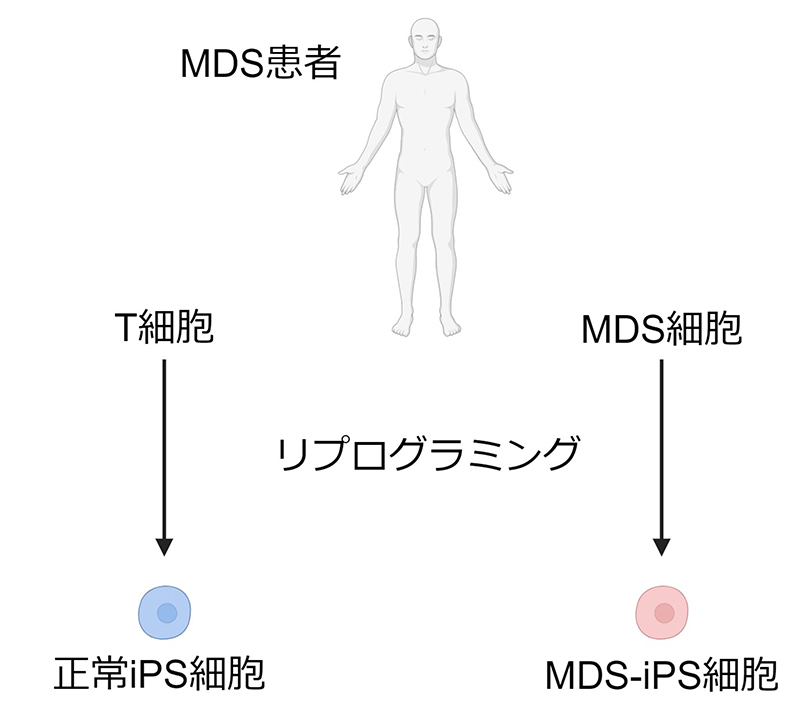
Fig. 1 患者さんから二種類のiPS細胞を作製する流れ
MDS:骨髄異形成症候群
2)MDS-iPS細胞は血液分化に障害があり、MDS細胞に類似した細胞が観察された
正常iPS細胞(N-25-A1、N-25-B1)は良好なコロニー形成能、骨髄球系および赤芽球系への血液分化能を認めましたが、MDS-iPS細胞(MDS-25-G1、MDS-25-J1、MDS-25-J4)は、著しくこれらが障害されていました(Fig. 2 左)。また、MDS-iPS細胞由来の血液細胞では、偽ペルゲル核異常などのMDS患者さんで高頻度にみられる異形成像が観察されました(Fig. 2 右)。
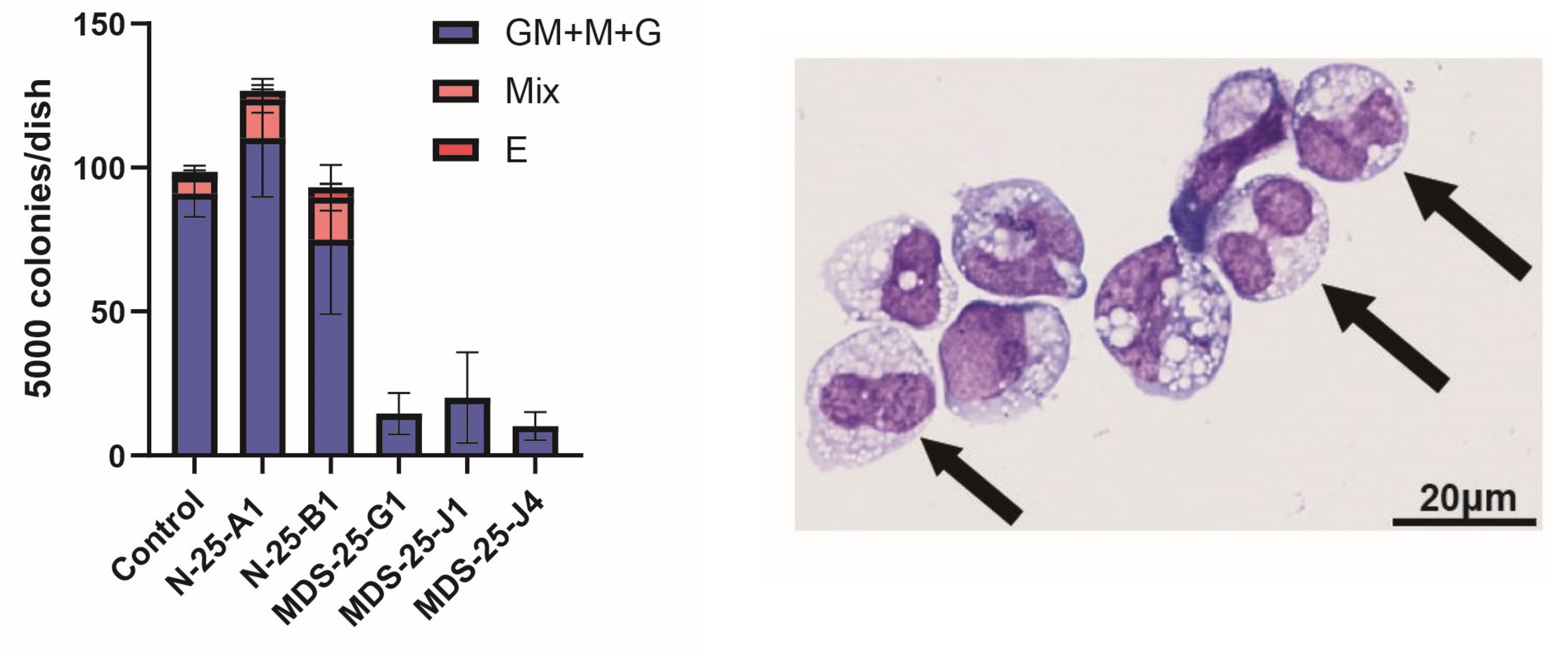
Fig. 2 MDS-iPS細胞由来造血前駆細胞のコロニーアッセイ(左)とギムザ染色(右)
N:正常、MDS:骨髄異形成症候群
GM:顆粒球・マクロファージコロニー、M:マクロファージコロニー、G:顆粒球コロニー、
Mix:混合コロニー、E:赤芽球コロニー
3)MDS-iPS細胞由来造血前駆細胞はMECOM 遺伝子の異常発現を認めた
定量PCR注10)により、MDS-iPS細胞由来の造血前駆細胞では、MDS1-EVI1注11)およびMECOM 遺伝子の発現が正常型iPS細胞由来の造血前駆細胞と比較して増加していることが分かり、患者さんのMDS細胞と同程度に高いMECOM 遺伝子活性を認めました(Fig. 3)。

Fig. 3 定量PCRでは、MDS-iPS細胞由来造血前駆細胞に
MDS1-EVI1 とMECOM の高い発現を認めた
Control:健常者コントロール、N:正常、MDS:骨髄異形成症候群、
Patient-CD34+:患者さんのMDS細胞、K562:白血病の細胞株
4)MDS-iPS細胞由来造血前駆細胞において、MYC のエンハンサーおよびMECOM プロモーター/エンハンサーの活性化が確認された
H3K27ac注12)のChIPシークエンス注13)では、MDS-iPS細胞由来の造血前駆細胞において、患者さんのMDS細胞(Patient CD34+)と同様に、MYC のエンハンサー(Fig. 4左)およびMECOM のプロモーター/エンハンサー(Fig. 4右)に一致したエンハンサーマークの増強を認めました。
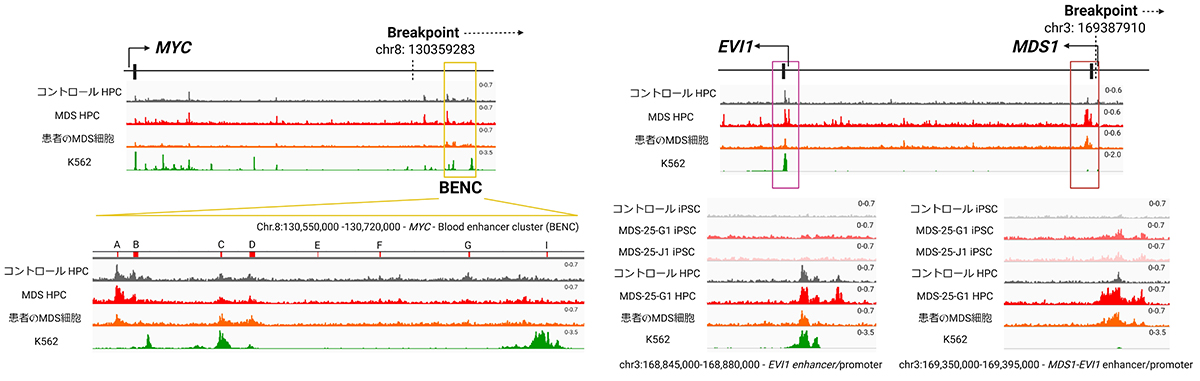
Fig. 4 H3K27acのChIPシークエンスでは、MYC のエンハンサーおよび
MECOM のプロモーター/エンハンサーに高い活性を認めた
MDS:骨髄異形成症候群、HPC:造血前駆細胞、K562:白血病の細胞株、iPSC:iPS細胞
5)MDS細胞はiPS細胞にもMDS1-EVI1の活性を認めた
リプログラミングに伴い、造血前駆細胞(HPC)で高い活性を認めるMDS1-EVI1の活性はコントロールiPS細胞では、認められませんでした。しかし、MDS細胞では、iPS細胞にも高いMDS1-EVI1活性を認めました(Fig. 4右)。
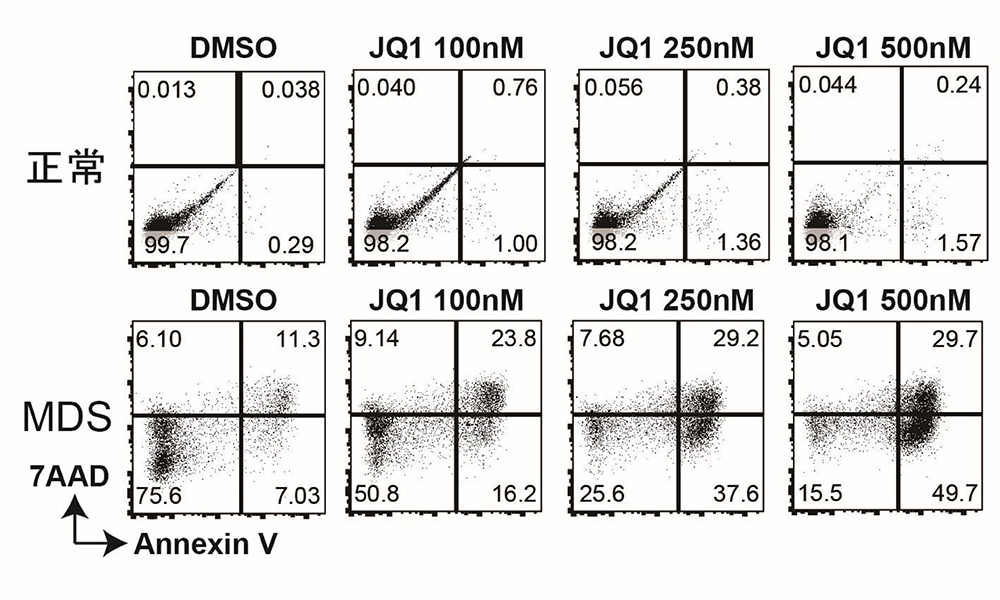
Fig. 5 BET阻害剤JQ1を投与すると、MDS-iPS細胞由来造血前駆細胞の
死細胞が用量依存的に増加した
MDS:骨髄異形成症候群
6)BET阻害剤JQ1の投与により、MDS-iPS細胞で用量依存的に死細胞の増加とMECOM 遺伝子の発現の低下を認めた
BET阻害剤であるJQ1を投与すると、MDS-iPS細胞由来造血前駆細胞において用量依存的にMECOM 遺伝子発現の低下と死細胞の増加とを認めました(Fig. 5)。これらの結果から、JQ1によるMYCエンハンサーの阻害は、異常に活性化したMECOM 遺伝子の活性を抑制し、t(3;8)MDS細胞の増殖を阻害することが示されました。
4. まとめ
本研究では、非定型3q26/MECOM 転座t(3;8)(q26.2;q24)を有するMDS患者さんから正常T細胞、MDS細胞由来のiPS細胞株を樹立しました。これらのiPS細胞を用いることで、MDS-iPS細胞由来の造血前駆細胞では元の症例に類似した血液細胞の異形成や分化・成熟障害が見られることを示しました。さらにBET阻害剤がスーパーエンハンサーを抑制することで、MDS細胞の増殖を抑制することを明らかにしました。BET阻害剤は様々な悪性腫瘍で臨床試験段階にあり、t(3;8)(q26.2;q24)を有する骨髄性腫瘍患者さんの新たな治療法として有望であると考えられます。
5. 論文名と著者
- 論文名
Modelling and drug targeting of a myeloid neoplasm with atypical 3q26/MECOM rearrangement using patient-specific iPSCs - ジャーナル名
British Journal of Haematology - 著者
Momoko Nakamura1,2, Kazuhisa Chonabayashi1,2*, Megumi Narita1, Yasuko Matsumura1, Misato Nishikawa1, Yotaro Ochi3, Yasuhito Nannya3,4, Masakatsu Hishizawa2,5, Daichi Inoue6, Ruud Delwel7,8, Seishi Ogawa3, Akifumi Takaori-Kondo2, Yoshinori Yoshida1*
*責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所
- 京都大学大学院医学研究科 血液内科
- 京都大学大学院医学研究科 腫瘍生物学講座
- 東京大学医科学研究所 先端医療研究センター 造血病態制御学分野
- 京都桂病院 血液内科
- 神戸医療産業都市推進機構 先端医療研究センター 血液・腫瘍研究部
- Department of Hematology, Erasmus MC Cancer Institute
- Oncode Institute
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会 科研費(JP21K08414)
- AMED再生医療実現拠点ネットワークプログラム(JP20bm0104001、JP20bm0804004)
- AMED次世代がん医療加速化研究事業(JP19cm0106235)
- AMED再生・細胞医療・遺伝子治療実現加速化プログラム(JP23bm1423011、JP23bm1323001)
- 公益財団法人持田記念医学薬学振興財団
- 公益財団法人安田記念医学財団
- 公益財団法人小林がん学術振興会
- 公益財団法人第一三共生命科学研究振興財団
- Leducq Foundation
- iPS細胞研究基金
7. 用語説明
注1)骨髄異形成症候群
未熟な造血細胞に生じたゲノム異常が原因と考えられる血液悪性腫瘍の一つ。
注2)BET阻害剤
エンハンサーに結合する複合体の構成因子であるBRD4などのプロモドメイン含有タンパク質(BET: Bromodomain and extraterminal)を標的とした薬剤。
注3)スーパーエンハンサー
複数のエンハンサー領域から構成された長い転写効率を強く高めるDNA領域。
注4)骨髄性腫瘍
骨髄異形成症候群や急性骨髄性白血病などの血液悪性腫瘍の総称。
注5)エンハンサー・ハイジャッキング
ゲノム中のエンハンサー(遺伝子発現を調節するDNA配列)が本来のターゲット遺伝子から離れて、異なる遺伝子の発現を誤って促進する現象。
注6)転座
染色体の一部が他の染色体に移動する異常。
注7)染色体構造異常
染色体の一部が失われたり、重複や移動したりすることで、染色体の構造が正常とは異なる状態。
注8)急性骨髄性白血病
分化・成熟能が障害された単一の細胞が自立して増殖することを特徴とする血液悪性腫瘍の一つ。
注9)WHO分類
ヒトの腫瘍の組織学および遺伝子型決定を扱う世界保健機関(WHO)の腫瘍分類シリーズ。
注10)定量PCR
ポリメラーゼ連鎖反応(PCR)を用いて、サンプルの中にある遺伝子の発現量を調べる方法。
注11)MDS1-EVI1
MDS1-EVI1は、MECOM 遺伝子のアイソフォームのひとつ。
注12)H3K27ac
ヒストンH3の27番目のリジンのアセチル化。転写活性化に重要。特定の遺伝子やエンハンサーの活性状態を評価する際に使用されている。
注13)ChIPシークエンス 転写因子やヒストンとDNAの複合体を抗体で免疫沈降し、濃縮精製されたDNA断片をシーケンスすることで、転写因子と相互作用していたDNA領域や、特定のヒストン修飾が濃縮されたDNA領域を明らかにする手法。