新規の超早期病態分子を標的にした治療法開発にむけて
2018-10-05 東京医科歯科大学,日本医療研究開発機構
ポイント
- アルツハイマー病の超早期においてSRRM2タンパク質の異常リン酸化が生じることを見出しました。
- SRRM2は核においてRNAスプライシング関連タンパク質を安定化させています。
- 異常リン酸化SRRM2は核に移行できずRNAスプライシング関連タンパク質が神経細胞から減少します。
- その標的の一つが、発達障害原因遺伝子PQBP1でした。
- PQBP1タンパク質減少はシナプス関連分子の発現量の大幅な変動を引き起こし、認知障害につながります。
- PQBP1を用いたアルツハイマー病の遺伝子治療の可能性を示しました。
概要
東京医科歯科大学・難治疾患研究所/脳統合機能研究センター・神経病理学分野の岡澤均教授の研究グループは、アルツハイマー病(注1)のモデルマウスを用いて、アルツハイマー病超早期に生じるSRRM2タンパク質リン酸化の病的意義を明らかにしました。SRRM2リン酸化は核内部のSRRM2減少につながり、更にRNAスプライシング関連タンパク質(特に発達障害原因タンパク質PQBP1(注2))の減少、シナプス関連タンパク質の発現低下、さらにシナプス障害を引き起こし、最終的に認知症状を引き起こしていることを明らかにしました。この研究は、東京医科歯科大学神経病理学分野の博士課程学生・田中ひかり、同・近藤和、助教・藤田慶太らが主に行ったもので、平成26年度から始まった文部科学省『革新的技術による脳機能ネットワークの全容解明プロジェクト』(平成27年度から日本医療研究開発機構:AMEDへ移管)で実施されました。また、一部は、脳科学研究戦略推進プログラム課題E、新学術領域研究『シナプス・ニューロサーキットパソロジーの創成』の支援を受けました。その研究成果は、国際科学誌Molecular Psychiatry(モレキュラー・サイキアトリー)に、2018年10月3日にオンライン版で発表されました。
研究の背景
アルツハイマー病、前頭側頭葉変性症、レヴィー小体型認知症の3大認知症は、高齢化社会の日本で大きな社会問題となっています。アルツハイマー病は、2025年には高齢者の5人に1人が罹患すると言われています。 これらの3大認知症については、根本的な治療法(病態修飾治療法(注3):Disease Modifying Therapy:DMTとも言う)は確立されていません。また、遺伝子変異によって引き起こされる病態についても、多くの知識が蓄積されてきているものの、どの時期からどのような病態が生じているのか、いつからどのような病態を標的に治療をすれば良いのか、については明確になっていません。例えば、アルツハイマー病では欧米の巨大製薬企業を中心にアミロイド凝集除去を目的としてアミロイド抗体を用いた多くの国際的臨床試験(日本を含む)が行われてきましたが、アミロイド除去には成功したものの、臨床症状の改善には至っていません。これらの事例は、症状としての発症以前、さらにはアミロイド凝集体出現以前(凝集前)の『超早期病態』を解明する必要性を示しています。
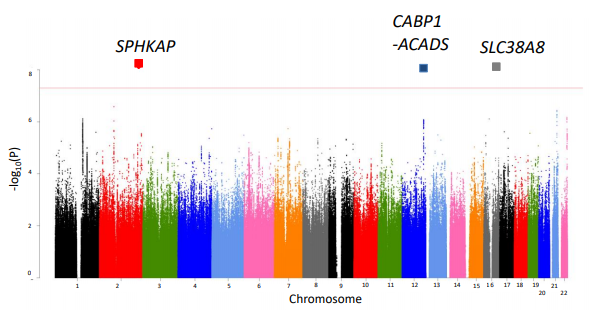
先行研究において、岡澤グループはアルツハイマー病モデルマウス4種類から、発症前・アミロイド凝集前の時期から発症時期までの期間に脳サンプルを採取し、これを網羅的リン酸化プロテオーム解析(注4)にかけました。 これにより、発症前・アミロイド凝集前にリン酸化を受けるタンパク質が3つあることを発見しました。その1つは、細胞膜形状の制御に関わる分子MARCKSであり、発症前・アミロイド凝集前のMARCKSリン酸化がシナプス変性・神経突起変性につながることを報告しました(Fujita et al, Sci Rep 2016; 平成28年8月25日プレス発表)。しかしながら、残りの2つのタンパク質(SRRM2、Marcksl1)のリン酸化のアルツハイマー病態における意義は十分に解明されていませんでした。
研究成果の概要
本研究において岡澤グループは、超早期アルツハイマー病態(発症前・アミロイド凝集前)におけるSRRM2タンパク質リン酸化の病的意義を明らかにしました。まず、発症前・アミロイド凝集前に観察されたSer1068のリン酸化はSRRM2のTCP1alphaに対する結合を弱めることを、発見しました。TCP1alphaはタンパク質の折りたたみを助けるシャペロンタンパク質(注5)のひとつですが、細胞質内の小胞体で作られたSRRM2と結合して、SRRM2の折りたたみを助けて正しい3次構造にする役割があると考えられます。Ser1068でリン酸化されたSRRM2(注6)は正しい3次構造を取ることができず、その後に核へ輸送されにくくなり、核内の量が減少します。SRRM2タンパク質は細胞の核内部で多くのRNA関連タンパク質と結合して、結合相手を安定化するスカフォールドタンパク質(注7)と考えられており、実際、アルツハイマー病態では、SC35, PQBP1などのRNA関連タンパク質が核内部で減少していることがわかりました。
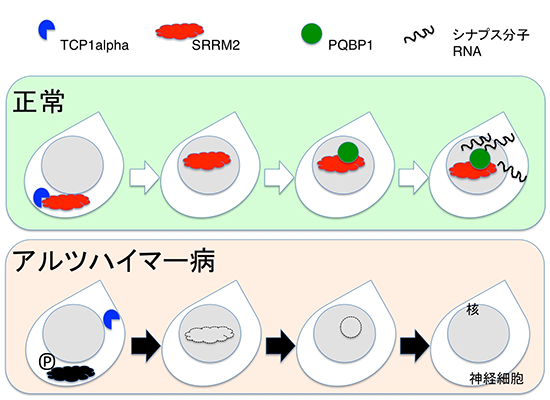
<図の説明>
正常状態では、SRRM2はTCP1alphaと結合し、正常な折りたたみをすることが出来て、核に移行します。核では、PQBP1などのRNAスプライシング関連因子を安定化して(タンパク質寿命を延ばして)、RNA成熟を介して、シナプス形成に必要なタンパク質を増やします。ところが、アルツハイマー病態ではSRRM2はSer1068でリン酸化してTCP1alphaと結合できなくなり、核への移行が減少し、PQBP1タンパク質も減少します。図中のPはリン酸化を示す。この結果、RNAスプライシングの効率が低下し、シナプス形成に必要な分子のRNAが作れなくなります。この現象はヒトでも生じていると考えられ、実際、アルツハイマー病のヒト脳においてもSRRM2リン酸化、PQBP1タンパク質減少が確認されました。
この中で、PQBP1はレンペニング症候群、ゴラビ・伊藤・ホール症候群など、多くの発達障害症候群の原因遺伝子であることが知られています。そこで岡澤教授らの研究グループは、新たにPQBP1が成熟神経細胞にのみ欠損している遺伝子組み換えマウス(PQBP1-Synapsin-Cre-cKOマウス)を作成して、アルツハイマー病モデルマウス(5xFADマウス)とのシナプス異常と遺伝子発現における共通性を検討しました。 この結果、PQBP1-Syn-cKOマウスと5xFADマウスは、共通してシナプス形態に異常があり、シナプス関連遺伝子のRNAスプライシングが変化していること、さらに5xFADマウスにおけるRNAスプライシング変化はPQBP1の補充(PQBP1遺伝子治療(注8))によって回復すること、PQBP1遺伝子治療は、5xFADマウスとヒトAPPノックインマウスにおいて、シナプス形態を回復し、記銘力テストの成績を顕著に回復させることも示されました。
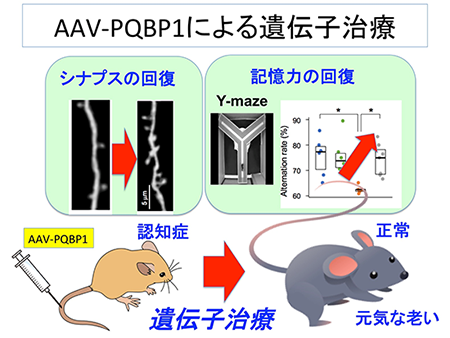
<図の説明>
2種類のアルツハイマー病モデルマウスにPQBP1遺伝子治療(AAV-PQBP1)を用いることで、発症後であっても神経回路の伝達を改善し、記憶力を回復できました。ヒトでも同様な治療の可能性が開けてきました。
また、本研究ではSRRM2リン酸化に至る、上流シグナルについても検討を行い、種々の解析の結果、Erk1, Erk2という酵素がSer1068でSRRM2をリン酸化すると考えられました。発症前・アミロイド凝集前の時期には、モデルマウスの脳内で細胞内のアミロイドが蓄積している状態が存在しており、これがERストレスなど何らかのシグナル経路を通じてErk1/2の過度な活性化状態を来しているものと想定されます。
研究成果の意義
アルツハイマー病は認知症の最も頻度の高い原因です。本研究において、岡澤グループは、アルツハイマー病の超早期(発症前・アミロイド凝集前)に生じる新しい病態メカニズムを明らかにし、この新規病態をターゲットにすることで治療が可能であることを示しました。アルツハイマー病においては、多くの臨床試験が失敗し、従来の仮説とは異なる病態仮説に基づいた新規治療法の開発が求められています。
本研究は、現在の認知症研究の焦点となっている超早期病態解明と、超早期病態で主要な役割を果たす、新たな標的分子を用いた遺伝子治療法を示した点でも、大きな意義を持つと考えられます。
用語の解説
- 注1:アルツハイマー病
- 日本において認知症の患者数は2025年には600万人に達するという予測があります。この中で主要な疾患の一つ(約100万人)がアルツハイマー病です。神経病理学的には、アミロイドと呼ばれるペプチドが、脳組織の細胞外に凝集することが、診断の定義です。アミロイドPETはこのような状態を反映するものと考えられています。家族性アルツハイマー病(アルツハイマー病全体の1%以下)では、アミロイド産生に関わる遺伝子の異常が原因であることがわかっていますが、大多数の非家族性アルツハイマー病(孤発性アルツハイマー病)においては、原因はわかっていません。したがって最終的に脳組織の細胞外アミロイド凝集に至ればアルツハイマー病と呼ぶ(診断する)ことになりますが、原因は様々であり、本当の病態は従来考えられてきたより多様で複雑と思われます。
- 注2:PQBP1
- ポリグルタミン配列結合タンパク質1(Polyglutamine binding protein 1)のこと。岡澤教授らがポリグルタミン配列をbaitとしてyeast two hybrid screening を行った結果、発見したタンパク質で(Imafuku et al., Biochem. Biophys. Res. Commun 1998; Waragai et al., Hum Mol Genet 1999)、ポリグルタミン病タンパク質あるいは他の正常タンパク質に結合します(Okazawa et al., Neuron 2002)。また発達障害(主に知的障害と小頭症を特徴とする症候群、および、非症候性知的障害)の原因遺伝子としても知られています(Kalscheuer et al, Nat Genet 2003)。PQBP1遺伝子異常症は、Renpenning症候群、Sutherland-Haan症候群, Hamel症候群, Porteous症候群、Golabi-Ito-Hall症候群などという多数の名前で呼ばれて来ましたが、遺伝性知的障害のなかでは疾患頻度が非常に高いことが近年明らかになってきました。分子機能面では、RNAの転写とスプライシングに関与することが知られています(Waragai et al., BBRC 2000; Okazawa et al., Neuron 2002 ; Mizuguchi et al., Nat Commun2014)。
- 注3:病態修飾治療法
- 疾患の原因となる病態機序を制御し、進行を抑制することを目的とした治療法。神経機能を補填することを目的とした症状改善療法 (symptomatic therapy)では、仮に治療開始後に症状が一過性に改善しても、病態進行による臨床症状の悪化は防ぎきれません。これに対して、疾患修飾治療法(disease modifying therapy)は、疾患進行そのものを抑え、場合によっては停止することが理論的には可能です。早期であれば、症状が改善してほぼ正常状態に戻ることも動物実験では示されています。
- 注4:網羅的リン酸化プロテオーム解析
- 質量解析は、サンプルに含まれるたんぱく質、脂質、糖質などの物質を、それらの質量から同定する方法です。この場合、特定の1から数種類たんぱく質のみを対象として、質量解析を行うショットガン法と、脳組織や腫瘍組織などに含まれる全てのたんぱく質を同定しようとする網羅的手法があり、後者を網羅的プロテオーム解析と呼びます。サンプルをリン酸化タンパク質濃縮カラムにかけることで、リン酸化タンパク質にフォーカスして網羅的リン酸化プロテオーム解析を行うことが可能です。
- 注5:シャペロンタンパク質
- タンパク質はアミノ酸が鎖状につながったもの(糸)であるが、これが折りたたまれて決まった立体構造を取り、アミノ酸同士の相互作用、ジスルフィド結合などによりエネルギー的に安定な状態になります。この過程で、正しく折りたたまれるように助ける別のタンパク質が存在し、シャペロンタンパク質と総称されています。
- 注6:Ser1068でリン酸化されたSRRM2
- SRRM2は大きなタンパク質(分子量:300kDa)で、多数のリン酸化される場所を持っています。この中で、アルツハイマー病の早期にリン酸化を受ける場所がアミノ末端から1068番目のセリン(Ser1068)であることが、本研究で示されました。
- 注7:スカフォールドタンパク質
- 複数のタンパク質を自身につなぎとめて、足場となるタンパク質のことを意味します。様々な細胞機能の局面でスカフォールドタンパク質が重要な役割を果たしています。
- 注8:遺伝子治療
- 主にウイルスベクターを、疾患で顕著に影響を受ける臓器、あるいは全身的に投与して、目的の遺伝子を発現させる、あるいは目的の遺伝子の発現を抑える治療法のことです。アデノ随伴ウィルスは今日最も遺伝子治療に用いられているベクターであり、無毒化したウィルスゲノムに発現させたい標的遺伝子を組み込んで目的のタンパク質を高効率で発現させることができます。
論文情報
- 掲載誌:Molecular Psychiatry
- 論文タイトル:The intellectual disability gene PQBP1 rescues Alzheimer’s disease pathology
研究者プロフィール
- 岡澤 均(オカザワ ヒトシ)Okazawa Hitoshi
- 東京医科歯科大学
- 神経病理学分野 教授
- 脳統合機能研究センター センター長
- ・研究領域
- 神経内科学、神経科学、神経病理学
問い合わせ先
研究に関すること
東京医科歯科大学 難治疾患研究所・脳統合機能研究センター
神経病理学分野 岡澤 均(オカザワ ヒトシ)
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
AMED事業に関すること
日本医療研究開発機構 脳と心の研究課