2025-02-17 国立精神・神経医療研究センター
国立精神・神経医療研究センター(NCNP)神経研究所疾病研究第五部の荒木敏之部長、加門正義研究員らの研究グループは、筋強直性ジストロフィー1型(myotonic dystrophy type 1; DM1)の病態にかかわる可能性のある新規因子を同定しました。この研究においては、DM1患者1人の細胞検体から作出したiPS細胞から多数の細胞クローン(単一の細胞から増殖した細胞グループ)を分離採取し、DMPK遺伝子の3‘非翻訳領域にある3塩基(CTG)繰り返し数*の異なる細胞どうしの間で、何が異なっているのかを検討しました。そして、CTG繰り返し数の伸長を起こす因子としてZNF850を同定しました。
厚生労働省の指定難病の一つである筋強直性ジストロフィー1型は、有病率が約2,100人に1人とされ、成人では最も多い遺伝性筋疾患であるといわれています。DM1発症の原因遺伝子は、19番染色体上にあるDMPK遺伝子であり、病気の原因はDMPK遺伝子がコードする蛋白ではなく、CTGの繰り返し配列の異常な伸長が原因であり、CTG繰り返しが異常に伸長した変異遺伝子から生成される異常RNAの毒性によるものであるとわかっています。CTG繰り返し配列は長いほどDM1の症状が重篤であることも知られています。
本研究成果は2025年2月15日に、雑誌「Human Molecular Genetics」に掲載されました。
研究背景・経緯
DM1は遺伝により世代を重ねるとより症状が重篤化することが知られています(これを「表現促進現象」と呼びます)。ゲノム上でDMPK遺伝子のCTG繰り返し数が34回以上になっていると、減数分裂時にその長さが伸びることがあり、DM1の発症リスクのある子供は親よりも長いリピート数を受け継ぐ可能性があることが原因であると考えられています。また、同一の患者においても、年をとるにしたがって、DMPK遺伝子のCTG繰り返し数が増大し、重症化する傾向があることも知られています。このような表現促進現象が起こる分子的なメカニズムを明らかにすることは、DM1の病態の理解と治療法開発の上で重要であると考えられますが、これまで、CTG繰り返し数の不安定性を、培養細胞や動物モデルで再現することは困難で、限られたモデルしか存在しませんでした。
これまでに我々は、京都大学iPS細胞研究所、大阪大学の研究者らとの共同研究により行った研究において「DM1患者さんの細胞から作出したiPS細胞は、増殖を繰り返すうちに、ゲノム上のDMPK遺伝子のCTG繰り返し数が変化し、平均的には繰り返し数が増加する傾向を示すとともに、異なるCTG繰り返し数をもつ多様な細胞が出現する」ことを示しました。この現象は、DM1患者において知られている表現促進現象を再現しているとはいえないが、DM1患者に由来する細胞において観察されるCTG繰り返し数の変化であることは注目に値すると考えられました。しかし、そのメカニズムは明らかではありませんでした。今回、我々は、DM1患者由来iPS細胞におけるCTG繰り返し数の不安定性のメカニズムを明らかにすることを目指しました。
研究内容
DM1患者由来iPS細胞は、分裂増殖に伴って、ゲノム上のDMPK遺伝子のCTG繰り返し数に多様性を生じることから、我々は、DM1患者一人の細胞検体から作出したiPS細胞から多数の細胞クローン(単一の細胞から増殖した細胞グループ)を分離採取し、CTG繰り返し数の異なる細胞どうしの間で、何が異なっているのかを検討しました。しかし、CTG繰り返し数が相対的に少ないiPS細胞でも多いiPS細胞でも両者同様に培養継続に伴うCTG繰り返し数の増加傾向を示し、またCTG繰り返し配列周辺のDNAメチル化状態にも大きな差異はありませんでした。

図1 一人のDM1患者の細胞検体から作出したiPS細胞クローンの中から、20回の植え継ぎ(継代)培養の前後でCTG繰り返し数が変化しないクローン(S14)を同定。
それぞれの棒グラフは、各iPS細胞クローンにおけるDMPK遺伝子CTG繰り返し配列数の分布を示すヒストグラムであり、上段がCTG繰り返し数計測開始時点、下段がそこから20回の継代後のCTG繰り返し数の分布を示している。
S14以外のクローンでは、CTG繰り返し数が開始時点で比較的少ないクローンも多いクローンも、CTG繰り返し数の増加傾向は同様であった。
このような検討を行うなかで、我々は、多数の細胞クローンの一つに、分裂増殖の前後でCTG繰り返し数がほとんど変化しない細胞クローンがある(図1)ことを発見し、このクローンの遺伝子発現の網羅的解析を行いました。そして、このクローンにおいて発現が強く抑制されている遺伝子としてZNF850を同定しました。
ZNF850遺伝子の、CTG繰り返し数の変化における役割を調べるため、CTG繰り返し数の増加傾向を示すDM1患者由来iPS細胞におけるZNF850遺伝子の発現を抑制したところ、CTG繰り返し数の増加傾向が抑制されました(図2)。また、DM1患者由来iPS細胞にZNF850遺伝子を過剰発現したところ、CTG繰り返し数の増加傾向が促進されることがわかりました。これらのことから、ZNF850遺伝子は、DM1患者由来iPS細胞におけるゲノム上でDMPK遺伝子のCTG繰り返し数の不安定性を制御する因子であると考えられました。

図2 ZNF850遺伝子の発現抑制によるCTG繰り返し数増加傾向の抑制。①はこの実験におけるCTG繰り返し数計測開始時点のDMPK遺伝子CTG繰り返し配列数の分布を示すヒストグラムであり、そこから10回の継代培養後のCTG繰り返し配列数の分布を②に、ZNF850遺伝子の発現を抑制した後に10回の継代培養を行った場合のCTG繰り返し配列数の分布を③に示す。各ヒストグラムのうち、白いバーは、①の培養開始時点でのCTG繰り返し配列数分布の中での最頻値の位置を示している。②では、10回の継代培養により、最頻値の位置が右にシフトし、CTG繰り返し配列数が増大していることがわかるが、③では、最頻値の位置は①から変化しておらず、CTG繰り返し配列数の増加が抑制されていることがわかる。
ZNF850遺伝子は、1090アミノ酸からなるZNF850蛋白をコードしています。ZNF850蛋白は、32回繰り返すC2H2型Zincフィンガー構造を持ちますが、そのほかには特徴的な配列はなく、これまでにこの蛋白・遺伝子の機能に関する研究報告はありません。また、これまでにDM1患者の骨格筋における遺伝子発現を、健常対照者骨格筋の遺伝子発現との間で網羅的に比較検討した多くの研究結果がデータベースに登録・公開されていますが、ZNF850遺伝子の発現レベルは、DM1患者と健常対照者の間で明確な差異はありませんでした。しかしながら、DM1患者のうち、CTG繰り返し数の比較的少ない方と多い方の骨格筋におけるZNF850遺伝子の発現レベルを比較すると、CTG繰り返し数が大きくなるにしたがってZNF850遺伝子の発現レベルが高くなる傾向がみられました(図3)。
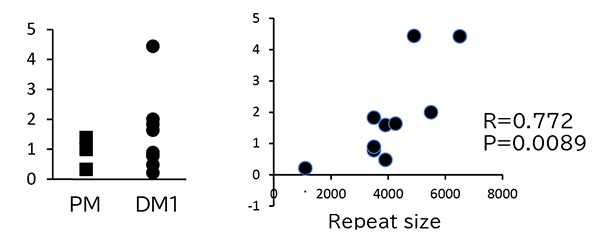
図3 DM1患者骨格筋でのZNF850発現は健常対照者と比較してもあまり変わらない(左側)が、DM1患者さんの骨格筋検体においては、DM1患者のうちCTG繰り返し数の比較的少ない方と多い方の骨格筋におけるZNF850遺伝子の発現レベルを比較すると、CTG繰り返し数が大きくなるにしたがってZNF850遺伝子の発現レベルが高くなる(右側)。
これまでにCTG繰り返し数の不安定性にはゲノムDNAの修復に関連する酵素反応が関与していることが指摘されています。そこで、我々は、ZNF850とDNA修復関連酵素の関係について検討しました。ZNF850はDNA修復酵素のうちDM1遺伝子のCTG繰り返し数の不安定性に関与しているという報告のあるMSH2、MSH3と結合している(ごく近傍に存在する)ことを示し、我々は、ZNF850蛋白はCTG繰り返し配列に結合することも示しました。
これらのことから、ZNF850蛋白は、DNA修復関連蛋白がCTG繰り返し配列を含むDNAの周辺にやってくる際の、いわば「足場」として機能し、DNA修復蛋白がCTG繰り返し配列付近で働きやすくすることによって、CTG繰り返し数の不安定性を高めているのではないかと考えられました(図4)。
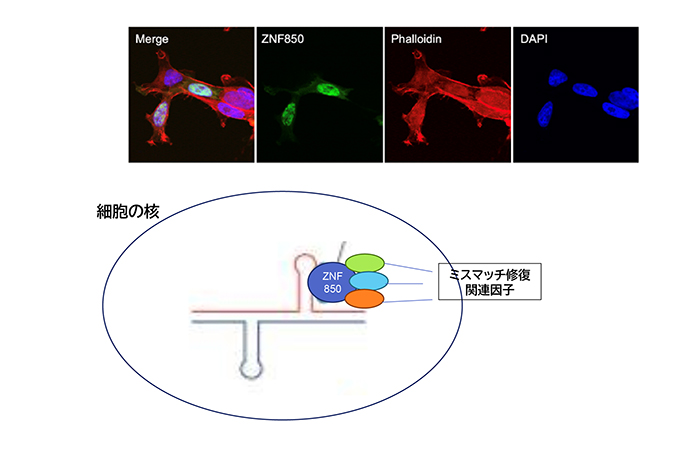
図4 CTG繰り返し配列を発現する培養細胞にZNF850蛋白を発現させると、ZNF850は細胞の核内に存在する(上の写真―DAPIは核の位置を示す)。
今回の研究から、ZNF850蛋白は、DNA修復関連蛋白がDNAの周辺にやってくる際の足場として機能している可能性がある(下図)。
今後の展望
今回の研究では、ZNF850がDM1患者由来iPS細胞におけるCTG繰り返し数の不安定性に重要な役割を果たしていることを示しましたが、ZNF850が実際のDM1患者のCTG繰り返し数の変化にどういった役割があるかは、今後さらなる検討が必要です。
また、DM1におけるCTG繰り返し配列のように、ゲノム上で3塩基繰り返し配列が存在し、その異常な伸長が、特に神経、筋肉の遺伝的な病気の原因となっている例がいくつもあります。近年の次世代遺伝子シークエンス技術の進展によりそれらは明らかになっており、前述の「表現促進現象」はそれら3塩基繰り返し配列の異常な伸長が惹起する病気に共通する現象です。そのためZNF850はDM1以外の疾患の3塩基繰り返し配列の不安定性への影響も検討していく必要があると考えます。
用語解説
*3塩基繰り返し配列の異常伸長による病気(トリプレットリピート病):ヒトのゲノム内の遺伝子にはさまざまな数と種類の塩基が繰り返す配列(リピート)があります。この中で3塩基の繰り返し配列(トリプレット・リピート)が異常に伸長することによっておこる一群の遺伝性神経疾患が知られています(トリプレット病、もしくは、トリプレットリピート病と呼びます)。これらの疾患においては、リピート長が遺伝学的に不安定で、親から子孫への疾患遺伝子の伝播に伴ってリピート長が変動することが多く、これは異なるトリプレットリピート病で共通する特徴となっています。トリプレット病 におけるリピート長の伸長が病気を引き起こす機序はさまざまで、遺伝子産物(タンパク質・RNA)の機能喪失 (loss of function)を介する場合、機能獲得(gain of function)の機構を介する場合があります)。DM1の場合は、原因となる3塩基繰り返し配列がRNAに転写された際に異常な構造をとることにより毒性を獲得してしまうことが、発症の原因となっていると考えられています。
(参照:脳科学辞典 トリプレット病)
原論文情報
論文名:Identification of ZNF850 as a novel CTG repeat expansion-related gene in myotonic dystrophy type 1 patient-derived iPSCs
著者:Masayoshi Kamon, Shuji Wakatsuki, Masayuki Nakamori, Masanori P Takahashi, Madoka Mori-Yoshimura, Hirofumi Komaki, Toshiyuki Araki
掲載誌:Human Molecular Genetics Volume 34, Issue 4 (15 February 2025) Pages 327–337
DOI:10.1093/hmg/ddae186
URL: https://doi.org/10.1093/hmg/ddae186
謝辞
本研究は、国立精神・神経医療研究センターが中心となって運営する神経筋疾患患者登録(Remudy)が発行する「Remudy通信」を通じた呼びかけに応じて細胞検体をご提供くださった患者様のご協力により可能となりました。ここに改めて厚く御礼申し上げます。
研究支援
本研究は、以下の研究費の支援により行われました。
日本医療研究開発機構 再生・細胞医療・遺伝子治療実現加速化プログラム(疾患特異的iPS細胞を用いた病態解明・創薬研究課題)(JP17bm0804005, JP18bm0804005, JP19bm0804005, JP20bm0804005, JP21bm0804005, JP22bm0804005, JP23bm1423001, JP24bm1423001)。
日本学術振興会科学研究費補助金 (JP19K09565)。
国立精神・神経医療研究センター 精神神経疾患研究開発費(5-7)。
お問い合わせ
【研究に関する問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター
神経研究所 疾病研究第五部
部長 荒木 敏之
【報道に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター
総務課広報室