2025-02-22 理化学研究所,日本医科大学,静岡県立総合病院,静岡県立大学
理化学研究所(理研)生命医科学研究センター ゲノム解析応用研究チームの寺尾 知可史 チームリーダー(静岡県立総合病院 臨床研究部 免疫研究部長、静岡県立大学 薬学部 ゲノム病態解析分野 特任教授)、内山 竣介 研修生(日本医科大学 大学院医学研究科 アレルギー膠原病内科学分野 大学院生)、日本医科大学 大学院医学研究科 アレルギー膠原病内科学分野の桑名 正隆 教授らの国際共同研究グループは、全身性自己免疫疾患である関節リウマチ(RA)[1]の末梢血DNAから後天的なDNA変異である体細胞モザイク[2]を同定し、体細胞モザイクが高齢発症関節リウマチ(LORA)[3]のリスク因子となることを発見しました。
本研究成果は、LORAの病態解明に加え、自己免疫疾患の性差・免疫老化のメカニズムの解明に貢献すると期待されます。
LORAは高齢化に伴い増加していますが、詳細な発症要因は分かっていません。今回、国際共同研究グループは、バイオバンク・ジャパン(BBJ)[4]の登録者約18万人と日本のRA前向きコホート[5]であるIORRA[5]のRA患者約2,400人の末梢血DNAから、体細胞モザイクを同定しました。LORAは若年発症関節リウマチ(YORA)と臨床特徴が異なりますが、特に男性の性染色体であるY染色体を喪失した細胞が血中に増加する現象(mLOY)がLORAのリスクの上昇に寄与するのに対し、YORAのリスクを低下させることを明らかにしました。さらに、LORAにおいてmLOYは遺伝要因であるポリジェニックリスクスコア(PRS)[6]と相互作用し、LORAのリスクの上昇と関連することも分かりました。
本研究は、科学雑誌『Annals of the Rheumatic Diseases』オンライン版(2月21日付)に掲載されました。
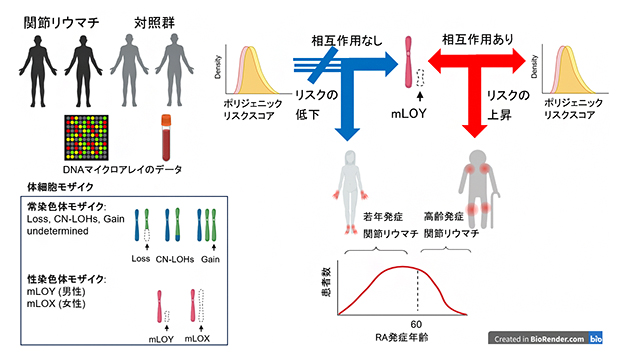
高齢発症関節リウマチの発症メカニズムの研究概要
背景
関節リウマチ(RA)は、自己抗体産生を特徴とする自己免疫性の破壊性関節炎であり、発症に遺伝要因と環境要因が関与すると考えられています。近年、特に日本では人口の高齢化に伴い、高齢発症RA(LORA)が増加しています。LORAは若年発症RA(YORA)と比較し、男性の割合が多く、肩や膝などの大関節罹患(りかん)が多く、リウマチ因子やRAに特異性の高い抗CCP抗体など自己抗体[7]の陽性率が低いといった異なる臨床特徴を持っています。従って、LORAはYORAとは異なる遺伝要因や環境要因が発症に関与すると想定されますが、詳しいことは分かっていませんでした。
「体細胞モザイク」は後天的なDNA変異のある細胞とない細胞が混在する状態です。体細胞モザイクは常染色体に生じる常染色体モザイクだけではなく、性染色体にも生じ、男性のみに生じるY染色体喪失モザイク(mLOY)と女性のみに生じるX染色体喪失モザイク(mLOX)に分類されます。
近年、常染色体と性染色体に生じる体細胞モザイクは健常者において加齢に伴い増加し、血液悪性腫瘍や加齢性疾患発症リスクとの関連が指摘されていました。加齢とともに増加した体細胞モザイクは、免疫細胞の機能を変化させることで自己免疫疾患の発症に関連する可能性が考えられていましたが、RA患者集団における関連の有無は検証されていませんでした。そこで、加齢に伴い増加する自己免疫疾患であるLORAと体細胞モザイクが関連するという仮説を立て、その関連性を調べることにしました。日本人最大規模のRAを含むDNAマイクロアレイ[8]のデータから体細胞モザイクを同定し、RAとの関連をRA発症年齢で細分化し解析することは、RA(特にLORA)の病態解明に意義があると考えられました。
研究手法と成果
国際共同研究グループは、バイオバンク・ジャパン(BBJ)の登録者約18万人と日本最大規模のRA前向きコホートであるIORRAのRA患者約2,400人のDNAマイクロアレイのデータを解析し、体細胞モザイクを同定しました。非RAをコントロールサンプル(対照群)として、二つの独立した日本人のデータセット(Set1、Set2)を用いて、それぞれの年齢の影響を調整したロジスティック回帰分析[9]を行った上、メタ解析[10]を実施しました。その結果、mLOYがLORAのリスクを上昇させるのに対し、YORAのリスクを低下させました(図1左右上段)。一方、常染色体モザイクやmLOXはRAとそのサブセット(LORA、YORA)において一貫してリスクの低下を示しました(図1左右中段・左右下段)。これらの関連は体細胞モザイクのリスクである喫煙歴や喫煙年数の影響を調整しても同様の傾向を認めました。
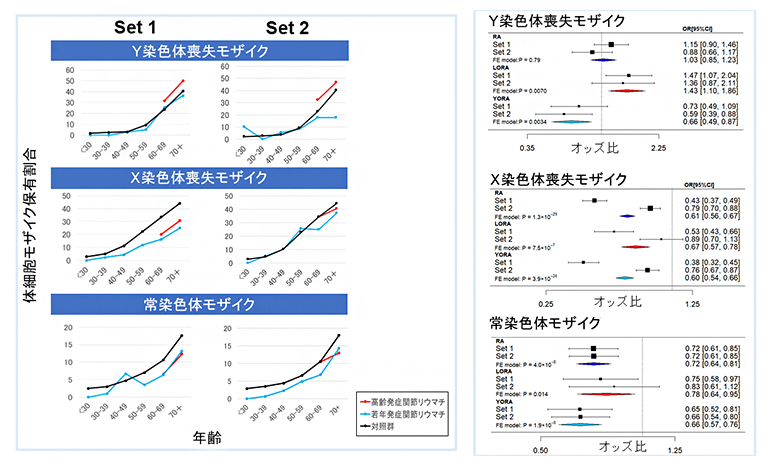
図1 Y染色体喪失モザイクの高齢発症RAにおける正の関連
非RAを対照群として、二つの独立した日本人のデータセット(Set1:RA2,107人、非RA86,998人。Set2:RA2,359人、非RA86,998人。)を用いて、それぞれ年齢を調整したロジスティック回帰分析を行った上、メタ解析を実施した。高齢発症RA(LORA)患者1,008人、若年発症RA(YORA)患者3,458人、対照群173,996人。左図が年齢別の体細胞モザイク保有割合(Y染色体喪失モザイク(mLOY):上段、X染色体喪失モザイク(mLOX):中段、常染色体モザイク:下段)を示し、右図がそれぞれに対応するメタ解析結果である。
(左右上段)メタ解析の結果、mLOYはLORAのリスクを上昇させた(基準とするものに対して、発症するリスクが何倍に上がるかを示すオッズ比(OR)が1.43、P値0.0070、有意確率:<0.05/3=0.016、多重比較検定で有意水準を調整するボンフェローニ補正で「有意差あり」とされている)のに対し、YORAのリスクを低下させた(OR0.66、P値0.0034)。
(左右中段・左右下段)mLOX、常染色体モザイクはRAとそのサブセット(YORA、LORA)において対照群と比較し、一貫したリスクの低下を認めた。
次に男性のRAと対照群を用いて、RAとmLOYの関連を、既知のRA発症のリスク因子である遺伝要因と環境要因の一つである喫煙の影響を調整したロジスティック回帰分析で評価し、メタ解析をしました。遺伝要因としては、全ゲノム関連解析(GWAS)[11]における効果量[12]と遺伝子型とを用いてスコア化したポリジェニックリスクスコア(PRS)を算出し、使用しました。その結果、PRSの効果量はLORAではYORAと比較して低いことが分かりました(図2A)。また、mLOYは、PRSや喫煙歴の影響を調整した上でも、LORAのリスクを上昇させるのに対し、YORAのリスクは低下させることが分かりました(図2B)。このことは、遺伝要因に加え、環境要因であるmLOYのRAの病態形成に対する役割が、RAサブセット間(LORA、YORA)で異なることを示唆しています。
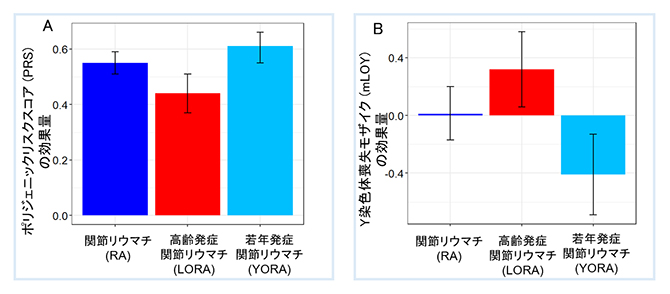
図2 LORAとYORAにおけるPRSとmLOYの効果量の違い
メタ解析の結果、ポリジェニックリスクスコア(PRS)の効果量は、高齢発症RA(LORA)では若年発症RA(YORA)と比較し低かった(A)。また、mLOYはLORAのリスクを上昇させたのに対し、YORAのリスクを低下させた(B)。
mLOYの有無に加え、mLOYの細胞分画(CF)[13]が5%より大きい群を加えた3群について、mLOYの割合とPRSの相互作用がLORAとYORAに及ぼす影響を詳細に調べました。
その結果、LORAにおいては、低PRS群・高PRS群のいずれにおいてもmLOYが陽性かつCFに依存して、高いリスクを認めました(図3A)。また、そのリスクの上昇の程度は、低PRS群でCFに依存して直線的な増加を示したのに対して、高PRS群ではより急激で非直線的でした(図3A)。このことは、LORAにおいてmLOYとPRSの相互作用が存在する可能性を示しています。対照的に、YORAでは高PRS群で高いリスクでしたが、むしろmLOYが陽性かつCFに依存してリスクの低下を認めました(図3B)。また、さらなる解析の結果、LORAでは、CFの高いmLOYとPRSの加法的相互作用[14]を認めたのに対し、YORAでは両者は独立した因子として証明されました。これらの結果は喫煙歴や喫煙本数の影響を調整した上でも同様の傾向を認めました。これらのことから、mLOYはPRSと相互作用し、LORAのリスクを上昇させるのに対し、YORAにおいて、mLOYはPRSと独立し、リスクを低下させるという明確な違いが明らかになりました。
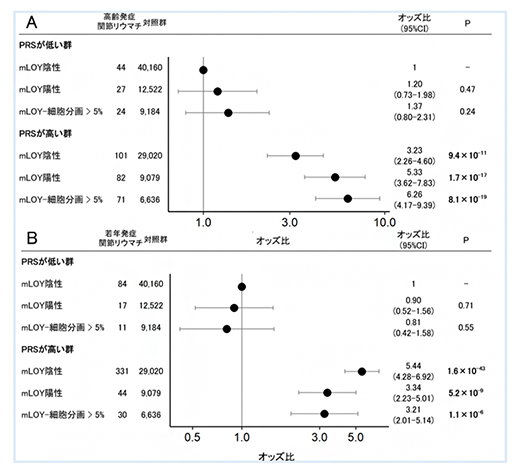
図3 PRSとmLOYの相互作用の解析
男性のRAと対照群をPRSとmLOYの状態で合計6群に細分化した。PRSは、低い群(<25%)と高い群(≧25%)に両データセットのRA患者のPRSの分布で定義し、二分化した。また、mLOYの有無に加え、mLOYの細胞分画(CF)が5%より大きい群を加えて3群に細分化した(AとBの縦軸)。最終的に、PRSが低くmLOY陰性者を対照群とした各群の高齢発症RA(LORA)・若年発症RA(YORA)のリスクを算出した。
(A)LORAでは、PRSが低い群と高い群でmLOYが陽性かつ細胞分画に依存してリスクの上昇を認めた。低PRS群と比較して、高PRS群のmLOY-CFに依存した急激なリスクの上昇は、PRSとmLOYの相互作用を示唆する。
(B)YORAではmLOY-CF依存的にリスクが低下した。
今後の期待
mLOYが遺伝要因と相互作用する、LORAの後天的なリスク因子として同定され、YORAとの明確な差異を明らかにしたことが、本研究における最も大きな成果であるとともに、今後のRA(特にLORA)の病態や免疫老化の機序の解明の研究につながる発見であるといえます。また、LORAは男性の罹患が多いことは、mLOYが男性のみに認める体細胞モザイクであることで部分的には説明できる可能性があり、mLOYがRAの性差の解明に貢献することが期待されます。
補足説明
1.関節リウマチ(RA)
手や足などの関節に炎症を引き起こす、全身性自己免疫疾患の一つ。一般的に発症要因としては遺伝要因に加え、喫煙や歯周病といった環境要因がある。炎症が持続すると関節の変形に至るため、早期診断・早期治療介入が望ましい。RAはRheumatoid Arthritisの略。
2.体細胞モザイク
体細胞に後天的なDNA変異が生じることで、変異のある細胞と変異のない細胞が混ざった状態を「体細胞モザイク」という。以前は造血器腫瘍において認めることが知られていたが、近年健常者においても男性に多く、加齢で増加することが知られている。
3.高齢発症関節リウマチ(LORA)
RAのうち、60歳以上で発症するRAのこと。LORAは近年人口の高齢化に伴い、特に日本において増加している。LORAは若年発症例と比較して、男性の罹患が多く、急性に発症し、肩や膝などの大関節罹患が多いといった、異なる臨床特徴を持つ。
4.バイオバンク・ジャパン(BBJ)
東京大学医科学研究所内に設置されている日本人27万人を対象とした生体試料のバイオバンク。理化学研究所が実験して取得した約20万人のゲノムデータを保有する。オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報とともに収集し、研究者へのデータ提供や分譲を行っている。
5.前向きコホート、IORRA
前向きコホートとはある特定の集団(コホート)を一定期間にわたって追跡し、病気の発症や進行、治療の効果などを観察する研究方法。IORRAは、日本で初めてリウマチ性疾患領域で開始された、東京女子医科大学リウマチ膠原病・痛風センターのRAの前向き大規模コホート研究のこと。RAの臨床情報に加えゲノムDNAや血清情報を有している。
6.ポリジェニックリスクスコア(PRS)
遺伝子上に存在する一塩基の違い(多型)をSNPと呼び、疾患や形質と関連あることが知られている。各SNPの関連解析における効果量と遺伝子型とを乗じたものの総和を、個人ごとに算出するスコアであり、特定の疾患の発症のしやすさの程度を示す。今回の例ではRAのPRSが高いほど、遺伝的にRAになりやすい、ことを示している。PRSはPolygenic Risk Scoreの略。
7.自己抗体
抗体は、主に細菌やウイルスなどの外来の異物(抗原)を排除する目的で産生されるタンパク質であり、ワクチンや疾患の治療にも使用される。しかし、自分の体由来の物質を異物として認識する抗体が産生されることがあり、これを自己抗体と呼ぶ。自己抗体は、関節リウマチをはじめとした種々の自己免疫疾患で認められ、診断や治療経過のモニターに使用される。
8.DNAマイクロアレイ
基板の上に、遺伝的多型(主にSNP)に相補的なプローブを搭載したビーズを高密度に配置し、数十万~数百万の遺伝的多型を検出するための分析器具。
9.ロジスティック回帰分析
複数の説明変数から特定の目的変数を予想する多変量解析の一つ。目的変数としては2値の結果(今回の例ではRAである/ない)を使用する。
10.メタ解析
独立して行われた複数の研究の統計解析結果を合算する統計学的手法。統計学的な検出力を高める利点がある。
11.全ゲノム関連解析(GWAS)
疾患の有無や臨床検査値とSNPを全ゲノムにわたって網羅的に解析する統計学的手法。特定の遺伝子や遺伝子上に存在する一塩基の違い(多型)を対象にしないバイアスのないアプローチであることから、新規の関連を同定することが可能となる。GWASはGenome-Wide Association Studyの略。
12.効果量
基準とするものに対して、発症するリスクが何倍に上がるかを示すオッズ比の自然対数を取ったものを効果量と呼び、通常βと示され、線形回帰モデルにおいて直線の傾きに相当しており、傾きが大きいほどリスクが高いと解釈される。
13.細胞分画(CF)
末梢血の白血球のDNA全体のうち体細胞モザイクが存在する割合。CFはCell Fractionの略。
14.加法的相互作用
複数の要因が一緒に働いたとき、単純な足し算よりも効果が大きくなること。
国際共同研究グループ
理化学研究所 生命医科学研究センター
ゲノム解析応用研究チーム
チームリーダー 寺尾 知可史(テラオ・チカシ)
(静岡県立総合病院 臨床研究部 免疫研究部長、静岡県立大学 薬学部 ゲノム病態解析分野 特任教授)
研修生 内山 竣介(ウチヤマ・シュンスケ)
(日本医科大学 大学院医学研究科 アレルギー膠原病内科学分野 大学院生)
研究員 石川 優樹(イシカワ・ユウキ)
ファーマコゲノミクス研究チーム
研究員 曳野 圭子(ヒキノ・ケイコ)
日本医科大学 大学院医学研究科 アレルギー膠原病内科学分野
教授 桑名 正隆(クワナ・マサタカ)
准教授 五野 貴久(ゴノ・タカヒサ)
東京女子医科大学
膠原病リウマチ内科
准教授 田中 榮一(タナカ・エイイチ)
非常勤講師 本田 卓(ホンダ・スグル)
膠原病リウマチ痛風センター
教授 猪狩 勝則(イカリ・カツノリ)
東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻 複雑形質ゲノム解析分野
教授 鎌谷 洋一郎(カマタニ・ヨウイチロウ)
ハーバード大学(米国)遺伝学分野
研究員 ジウリオ・ジェノヴェーゼ(Giulio Genovese)
研究支援
本研究は、日本医療研究開発機構(AMED)難治性疾患実用化研究事業「シングルセル統合ゲノミクス解析が解き明かす強皮症の病態基盤の開発(研究代表者:寺尾知可史、JP21ek0109555)」、同ゲノム医療実現バイオバンク利活用プログラム「先天的/後天的構造多型に着目した免疫/精神疾患病態解明に関する研究開発(研究代表者:寺尾知可史、JP21tm0424220)」、同革新的がん医療実用化研究事業「体細胞モザイクのがん発症および予後因子としての意義解明の開発(研究代表者:寺尾知可史、JP 21ck0106642)」、同免疫アレルギー疾患実用化研究事業「先天的・後天的ゲノム情報と臨床情報を用いた関節リウマチの層別化基盤の構築(研究代表者:寺尾知可史、JP23ek0410114)」、同ゲノム医療実現バイオバンク利活用プログラム「炎症性関節炎の統合ゲノミクス解析(研究代表者:寺尾知可史、23tm0424225)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「エンハンサーの遺伝的発現制御の解明による免疫疾患解析(研究代表者:寺尾知可史、JP20H00462)」、武田報彰医学研究助成「体細胞モザイク地図による老化と癌化の基盤解明(研究代表者:寺尾知可史)」による助成を受けて行われました。
原論文情報
Shunsuke Uchiyama, Yuki Ishikawa, Katsunori Ikari, Suguru Honda, Keiko Hikino, Eiichi Tanaka, Yoichiro Kamatani, Takahisa Gono, Giulio Genovese, Masataka Kuwana, Chikashi Terao., “Mosaic loss of chromosome Y characterises late-onset rheumatoid arthritis and contrasting associations of polygenic risk score based on age at onset”, Annals of the Rheumatic Diseases, 10.1016/j.ard.2025.01.034
発表者
理化学研究所
生命医科学研究センター ゲノム解析応用研究チーム
研修生 内山 竣介(ウチヤマ・シュンスケ)
(日本医科大学 大学院医学研究科 アレルギー膠原病内科学分野 大学院生)
チームリーダー 寺尾 知可史(テラオ・チカシ)
(静岡県立総合病院 臨床研究部 免疫研究部長、静岡県立大学 薬学部 ゲノム病態解析分野 特任教授)
日本医科大学 大学院医学研究科 アレルギー膠原病内科学分野
教授 桑名 正隆(クワナ・マサタカ)
報道担当
理化学研究所 広報室 報道担当
日本医科大学 広報課
地方独立行政法人静岡県立病院機構
静岡県立総合病院 総務課 広報・国際担当
静岡県立大学 広報・企画室