2018-11-02 京都大学
日野恭介 iPS細胞研究所共同研究員(大日本住友製薬株式会社研究員)、趙成珠 同特定研究員、池谷真 同准教授らの研究グループは、マウスの培養細胞を用いた進行性骨化性線維異形成症(FOP)に対する薬剤のハイスループットスクリーニング(一度に多種類の化合物から有効な化合物を見つける手法)系を構築し、それを用いて2つの候補化合物を見出しました。
本研究成果は、2018年11月2日に、米国の国際学術誌「Stem Cell Reports」のオンライン版に掲載されました。
研究者からのコメント
今回見出した候補物質は、すぐに臨床で効果を確認する段階に進められるわけではありません。新しい薬を作る際にはどうしても途中で開発中止となってしまう候補物質もでてきます。しかし、今回のように候補物質を新たに提示することで、薬剤開発の可能性を高めるとともに、FOPが起こるメカニズムの解明につなげられると期待しています。
概要
これまでの研究から、FOP患者の細胞では、骨形成のシグナルを伝達するACVR1という遺伝子が、変異することで過剰に働き、骨化が進みやすくなっていることがわかっていました。しかし、FOPを治療する薬は未だに存在しません。
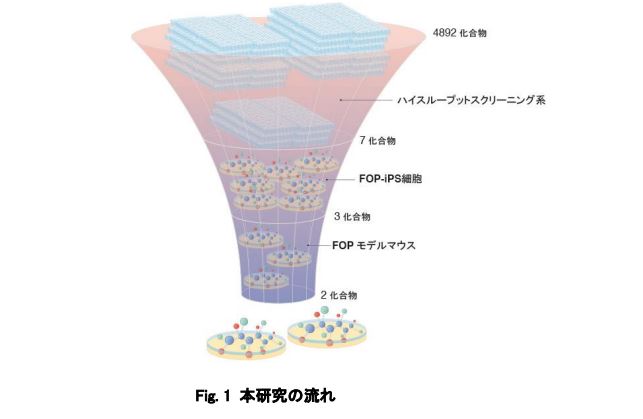
本研究グループは、まずATDC5というマウスの奇形腫由来の培養細胞に、FOP患者に特有の遺伝子変異を持ったACVR1を働かせ、ハイスループットスクリーニング系を立ち上げました。そして、約5000種類の化合物を用いて有効な化合物を探索(スクリーニング)したところ、2つのヒット化合物AZD0530とTAK 165が得られました。また、これらの化合物はFOP患者由来のiPS細胞を使った実験でも軟骨形成を抑制し、FOPの病態を再現したマウスでも異所性骨化(本来骨組織が存在しない部位に骨が形成されること)を抑制する効果が見られました。
本研究成果により、FOP治療薬の新たな候補化合物の発見による薬剤開発、FOPが起こる分子メカニズムのさらなる解明が期待されます。
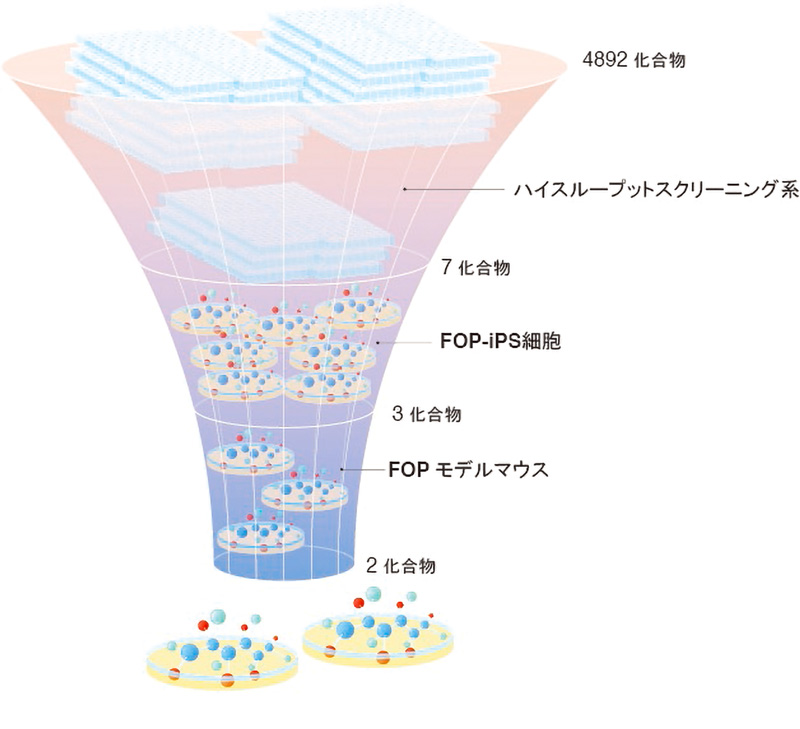
図:本研究の流れ
書誌情報
朝日新聞(11月2日 29面)、京都新聞(11月2日 25面)、産経新聞(11月2日 28面)、日刊工業新聞(11月2日 29面)および日本経済新聞(11月2日 38面)に掲載されました。
詳しい研究内容について
FOP における骨化を抑える新たな候補物質の同定
〜治療法探索へ新しい戦略への可能性を拓く〜
ポイント
●軟骨を形成する培養細胞を用いて新しい FOP に対する候補薬を選択するハイスループットスクリー ニング系注 1)を構築した
●ハイスループットスクリーニング系等を用いて 2 つの化合物を見出した
●複数の候補物質を提示することで薬剤開発の可能性を高めることが期待できる
1.要旨
日野恭介研究員(大日本住友製薬株式会社 リサーチディビジョン 疾患 iPS 創薬ラボ、京都大学 CiRA 増殖分化機構研究部門)、趙成珠研究員、池谷真准教授(京都大学 CiRA 臨床応用研究部門)らの研究 グループは、マウスの培養細胞を用いた進行性骨化性線維異形成症(FOP)に対する薬剤のハイスルー プットスクリーニング系を構築し、それを用いて 2 つの候補化合物を見出しました。
これまでの研究から、FOP の患者さんの細胞では、ACVR1 注 2)という遺伝子が変異することで過剰に働 き、骨化が進みやすくなっていることがわかっていましたが、FOP を治療する薬は未だに存在しません。今 回の研究では、まず ATDC5 というマウスの奇形腫由来の培養細胞に、FOP 患者さんに特有の遺伝子変 異を持った ACVR1 を働かせ、ハイスループットスクリーニング系を立ち上げました。約 5,000 種類の化合 物を用いてスクリーニングを行ったところ、2つのヒット化合物が得られました。これら化合物はFOP患者さ ん由来の iPS 細胞を使った実験でも軟骨形成を抑制し、FOP の病態を再現したマウスでも異所性骨化を 抑制する効果が見られました。こうした結果から、FOP のさらなる解析やドラッグリポジショニングに貢献で きると考えられます。
この研究成果は 2018 年 11 月 2 日(日本時間)に「Stem Cell Reports」で公開されました。
2.研究の背景
FOP は筋肉や腱、靭帯などの組織の中など、本来とは異なる場所に骨ができてしまう病気で、200 万人 に 1 人程度の割合で罹患し、日本には 80 名程度の患者さんがいるといわれている希少難病です。これま での研究により、FOP は骨形成に関わる因子である BMP 注 3)の受容体の一つである ACVR1 遺伝子に突 然変異が生じることで、ACVR1 が過剰に働いてしまうことが原因である事がわかっています。 これまでに研究グループは、FOP 患者さん由来の iPS 細胞(FOP-iPS 細胞)の作製に成功しています。 また、iPS 細胞から間葉系間質細胞(induced mesenchymal stromal cells; iMSC) 注 4)を経て軟骨へと分化さ せる方法も確立していました。(参考:CiRA プレスリリース 2015/03/13)
さらにこれらの細胞を用いて、本来は別のシグナルを伝える Activin-A が、FOP 細胞では BMP シグナル を異常に伝達していることを明らかにしました。また、FOP-iPS 細胞から作製した間葉系間質細胞 (FOP-iMSC)を Activin-A 発現細胞と共に免疫不全マウスに移植することで、患者さん由来細胞を用いた 異所性骨形成モデルの作製にも成功していました。(参考:CiRA プレスリリース 2015/12/01)
こうした成果をもとに、患者さん由来の iPS 細胞を使って FOP に対する治療薬候補物質の選別を行うハ イスループットスクリーニング系を立ち上げ、免疫抑制剤であるラパマイシンが FOP による異所性骨の発生を抑えることができることを見出し、2017 年 8 月からはラパマイシンを使った治験もスタートしました。 (参考:CiRA プレスリリース 2017/08/01 (論文について)/(治験について))
今回は FOP-iPS 細胞とは異なるアプローチでハイスループットスクリーニング系を構築し、さらなる候補 化合物の探索を試みました。
3.研究結果
ハイスループットスクリーニング系の構築
FOPの患者さんではACVR1に変異が生じており、本来とは異なる刺激で活性化してしまいBMP のシグナ ルが働いてしまうことがわかっています。この状況により近い細胞の状態を作るために、軟骨形成をする マウス培養細胞である ATDC5 に FOP 型の変異を持った ACVR1 を発現させました。この ATDC5 は BMP シグナル等の働きで軟骨分化が亢進すると ALP 注 5)がたくさん産生されるため、この ALP の働きを異所性 骨化につながる異常な軟骨分化の指標として測定するハイスループットスクリーニング系を構築しました。
この系を用いて、4,892 種類の化合物の中から、候補化合物を 7 種類にしぼりこみました。
患者さん由来の iPS 細胞を使った実験系による絞り込み
次に、FOP の患者さんの細胞から作製した FOP-iPS 細胞を用いた実験系で更に絞り込みを行いました。 iPS 細胞から作製した間葉系間質細胞(FOP-iMSC)に Activin-A を加えることで軟骨形成が起こりますが、 これをより強く抑える物質を探しました。その結果 3 種類の化合物(AZD0530、PD 161570、TAK 165)を候 補として得ました。(Fig. 2)
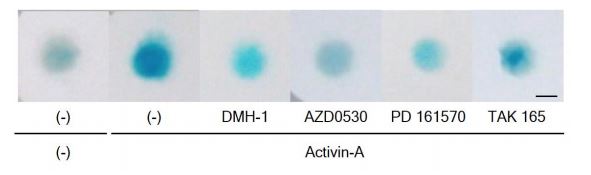
Fig. 2 iPS 細胞由来の FOP-iMSC を使って化合物の軟骨分化を抑えるかを評価した。 DMH-1 は陽性コントロール。青くなっているところが軟骨へと変化した部分で、色が濃いほど軟骨への 分化が進んでいる。AZD0530, PD 161570 は DMH1 と同程度、TAK 165 は半分程度の効果がある。
マウスを使った実験系による評価
FOP-iMSC をマウスに移植し、マウスの体内で FOP の骨化を再現したモデルを用いて、絞り込んだ化合 物の効果を評価したところ、2 つの化合物(AZD0530、TAK 165)で異所性骨化を防ぐ効果があることがわ かりました(Fig.3)。さらに、TAK165 は mTOR シグナル経路を調節する作用があり、直接ではないものの mTOR シグナルを阻害していることを明らかにしました。
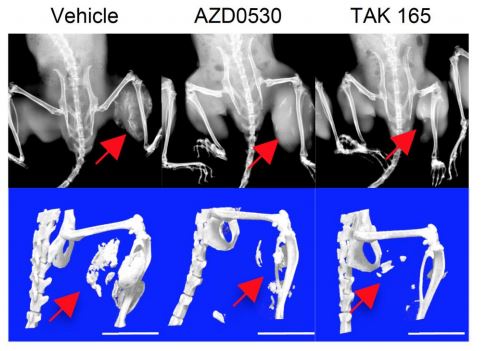
Fig. 3 マウス体内での骨化抑制の実験結果 上段はレントゲン撮影像、下段は CT 撮影像。図中の赤い矢印のあたりに FOP-iMSC を移植し、アクチビ ンを過剰に働かせると Vehicle (溶媒投与群)のように骨ができてしまう。そこへ2 つの化合物をそれぞれ与 えると、骨化が抑えられている。
4.まとめ
本研究により、AZD0530 や TAK 165 には FOP で生じる異所性骨化を抑える効果があることがわかりま した。今回見出した化合物は医薬品として市販されているものではないため、昨年発表し治験が開始され たラパマイシンのように、すぐに臨床で効果を確認する段階に進められるわけではありません。しかし病 気に対する薬を作る際には、どうしても途中で開発中止となってしまう候補物質が出てきます。また複数 の薬剤を組み合わせることでより高い効果が得られる場合もあります。今回の成果は、別の候補物質を 提示することで、薬剤開発の可能性を高めるとともに、FOPが起こる分子メカニズムのさらなる解明につな がると期待できます。
5.論文名と著者
○ 論文名: “An mTOR Signaling Modulator Suppressed Heterotopic Ossification of Fibrodysplasia Ossificans Progressiva”
○ ジャーナル名 :Stem Cell Reports
○ 著者: Kyosuke Hino1,2* , Chengzhu Zhao2*, Kazuhiko Horigome1,2, Megumi Nishio3 , Yasue Okanishi2 , Sanae Nagata2 , Shingo Komura2, 4, Yasuhiro Yamada2 , Junya Toguchida2,3,5,6 , Akira Ohta2 and Makoto Ikeya2**
○ 著者の所属機関 :
1 大日本住友製薬株式会社
2 京都大学 iPS 細胞研究所 (CiRA)
3 京都大学ウイルス・再生医科学研究所
4 岐阜大学大学院 医学系研究科
5 京都大学医学部附属病院 臨床研究総合センター(iACT)
6 京都大学大学院医学研究科
* 筆頭著者 **責任著者
6.本研究への支援
本研究は、下記機関より支援を受けて実施されました。
●日本学術振興機構 科学研究費補助金
●AMED 再生医療実現拠点ネットワークプログラム 疾患特異的 iPS 細胞を活用した難病研究
●AMED 再生医療実現拠点ネットワークプログラム iPS 細胞研究中核拠点
●AMED 創薬基盤推進研究事業
●AMED 難治性疾患実用化研究事業
●AMED 再生医療実現拠点ネットワークプログラム 疾患特異的 iPS 細胞の利活用促進・難病研 究加速プログラム
●AMED 再生医療実用化研究事業
●iPS 細胞研究基金
●京都大学 研究連携基盤次世代研究者支援事業
7.用語説明
注 1) ハイスループットスクリーニング 多数の化合物の中から有効な化合物を見つけるための手段。一度に多種類の化合物について評価を行 う。
注 2) ACVR1 (Activin receptor type-1) BMP 受容体の一部を構成するタンパク質で、BMP と結合することにより骨形成のシグナルを伝達する。ア クチビン A とは、結合はするがシグナルは伝えないことが知られていた。FOP では ACVR1 遺伝子の変異 により、ACVR1 タンパク質の 206 番目のアルギニンがヒスチジンに変化し、アクチビン A との結合で本来 伝えないはずの BMP シグナルを伝えていた。
注 3) BMP (Bone Morphogenetic Protein; 骨形成因子) 骨組織や軟骨の分化を誘導、促進するタンパク質。
注 4) 間葉系間質細胞(Mesenchymal Stromal Cells) 骨・軟骨・脂肪細胞などといった間葉系の細胞に分化する能力を持った間質(結合組織)の細胞。本報で は、iPS 細胞から作製したものを iMSC(induced Mesenchymal Stromal Cell)としている。
注 5) ALP (Alkaline Phosphatase) 様々な細胞の表面に存在する酵素の一種であるが、軟骨細胞の分化マーカー(目印)でもある。この酵素 活性を利用してハイスループットスクリーニングを行った。