「Genetics in Medicine」に掲載
2018-11-29 横浜市立大学,日本医療研究開発機構
横浜市立大学大学院医学研究科 遺伝学 濱中耕平研究員、松本直通教授らの研究グループは、RNAシーケンシングを用いたメンデル遺伝病の診断法を開発し、ネマリンミオパチーの原因となる変異を発見しました。日本人の178人に1人が持っている頻度の高い変異です。本研究は、横浜市立大学附属病院遺伝子診療科、神奈川県立こども医療センター臨床研究所、熊本大学大学院生命科学研究部 脳神経内科学分野、国立精神・神経医療研究センター神経研究所およびメディカル・ゲノムセンター 臨床ゲノム解析部、浜松医科大学医化学講座と共同で行われました。
また、本研究は、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業「希少難病の高精度診断と病態解明のためのオミックス拠点の構築」の一環として実施されました。
研究成果のポイント
- RNAシーケンシングを用いた、メンデル遺伝病の診断法を開発した。
- この方法を用いて、従来の方法で変異が同定されなかったネマリンミオパチーの6症例中、4症例で変異を同定した。
- その内1つの変異は、日本人の178人に1人が持つ頻度の高い変異であった。
研究の背景
メンデル遺伝病は、ある1つの遺伝子における変異が原因となって発症する疾患の総称で、100人に1人が発症する頻度の高い疾患です(世界保健機関)。メンデル遺伝病は、これまで診断をつけるために多くの検査を繰り返すことで患者の負担が大きく、医療費もかさみ、「診断オデッセイ」と呼ばれ、問題となっていました。現在は全エクソーム解析*1で診断されていますが、全エクソーム解析によっても診断率は30~35%程度で、依然未解決症例が数多く存在します。
全エクソーム解析はタンパク質をコードするエクソン領域を集中的に解析する技術です。全エクソーム解析による診断率が低い原因の1つは、異常なスプライシング*2を起こすことで病気を発症するシノニマス変異*3やディープイントロン変異*4を同定することが難しいことです。シノニマス変異は全エクソーム解析で検出できますが、異常なスプライシングを起こすかどうかの解釈が困難です。ディープイントロン変異は、そもそも全エクソーム解析がディープイントロン領域を調べないため、検出が不可能です。これらの変異は、スプライシングを検出するRNAシーケンシング*5を使うことで検出出来る可能性があります。
研究の内容
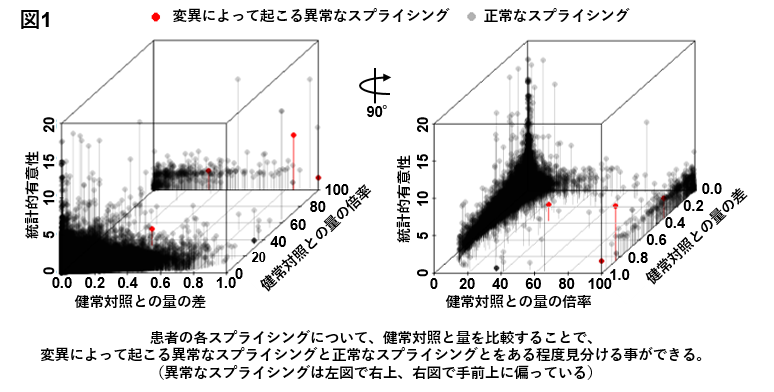
研究には主として症例の罹患筋組織を用いました。最初に、患者においてRNAシーケンシングにより検出される全てのスプライシングから、変異によって起こる異常なスプライシングを見分けられるか調べました。変異によって起こる異常なスプライシングが以前に同定されている患者と、健常対照とをRNAシーケンシングで解析し比較しました。すると、変異によって起こる異常なスプライシングは、健常対照と比べて患者において量が増えており、正常なスプライシングと見分けられることがわかりました(図1)。この方法を利用して、変異によって起こる異常なスプライシングの候補を症例当たり約30か所程度に絞ることが出来るシステムを開発しました。
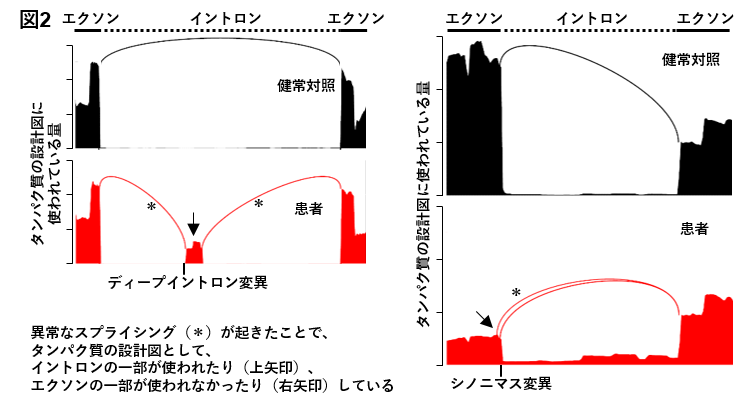
次に、この方法を用いて、ネマリンミオパチー*6の患者で全エクソーム解析によって診断がつかなかった6症例の罹患骨格筋をRNAシーケンシングで調べました。すると4症例で、検出された異常なスプライシングの候補の中に、ネマリンミオパチーの常染色体劣性遺伝形式の原因遺伝子として知られるNEBのスプライシングが含まれていました。さらに、そのスプライシングの周辺に、1症例でディープイントロン変異(c.1569+339A>G)が、3症例でシノニマス変異(c.24684G>C)が検出されました(図2)。これらの患者は、過去に行われた全エクソーム解析でNEB遺伝子の変異がもう1つ検出されていたため、常染色体劣性*7遺伝形式でNEB遺伝子の両アリル性変異によってネマリンミオパチーを発症していると診断されました。今回検出されたシノニマス変異は、東北大学 東北メディカル・メガバンク機構(ToMMo)が公表しているデータベース「全ゲノムリファレンスパネル3.5KJPN」によると、日本人の178人に1人が持つ頻度でした。
今後の展開
本研究により、シノニマス変異やディープイントロン変異の中には、頻度が高く多くの疾患の原因となるものが隠れている可能性が示唆されました。本手法を様々なメンデル遺伝病に適用することで、メンデル遺伝病の診断率が向上し、「診断オデッセイ」の解決につながることが期待されます。
用語説明
- *1 全エクソーム解析:
- 遺伝子上でタンパク質の設計図に当たる部分(エクソン)の配列を次世代シーケンサーで網羅的に調べる方法。
- *2 スプライシング:
- 遺伝子から転写されたRNA上で、イントロンを取り除きエクソンのみをつなぎ合わせる現象。つなぎ合わされたエクソンを設計図としてタンパク質が作られる。異常なスプライシングによってつなぎ合わされ方が変わるとタンパク質の設計図が変わるため、病気を引き起こす可能性がある。
- *3 シノニマス変異:
- エクソン上にある変異で、タンパク質のアミノ酸配列が一見変わらないもの。多くのシノニマス変異は病気を引き起こさないが、中にはスプライシングの異常を引き起こし病気の原因となるものがある。
- *4 ディープイントロン変異:
- イントロン上にある変異で、エクソンの近傍にないもの。エクソンの近傍にあるイントロン上の変異は、全エクソーム解析で調べることが出来るが、エクソンから離れたところにある変異は調べることが出来ない。
- *5 RNAシーケンシング:
- RNAの配列を次世代シーケンサーで網羅的に調べる方法。RNAの配列から、スプライシングがどのように起こっているかがわかる。
- *6 ネマリンミオパチー:
- 筋力の低下を主徴とする遺伝性筋疾患の一種。
- *7 常染色体劣性:
- 両親から1つずつ変異が遺伝し、変異を合わせて2つもつことで疾患が発症する遺伝形式。
掲載論文
RNA sequencing solved the most common but unrecognized NEB pathogenic variant in Japanese nemaline myopathy
Kohei Hamanaka, Satoko Miyatake, Eriko Koshimizu, Yoshinori Tsurusaki, Satomi Mitsuhashi, Kazuhiro Iwama, Ahmed N. Alkanaq, Atsushi Fujita, Eri Imagawa, Yuri Uchiyama, Nozomu Tawara, Yukio Ando, Yohei Misumi, Mariko Okubo, Mitsuko Nakashima, Takeshi Mizuguchi, Atsushi Takata, Noriko Miyake, Hirotomo Saitsu, Aritoshi Iida, Ichizo Nishino, Naomichi Matsumoto
Genetics in Medicine, Published 23 November 2018, https://doi.org/10.1038/s41436-018-0360-6
※本研究は、『Genetics in Medicine』に掲載されました(11月23日オンライン)。The article was published in “Genetics in Medicine, the peer-reviewed journal of the American College of Medical Genetics and Genomics (ACMG).
お問い合わせ先
資料の内容に関するお問い合わせ
公立大学法人横浜市立大学
大学院医学研究科 遺伝学 研究員 濵中 耕平
教授 松本 直通
取材対応窓口、詳細の資料請求など
公立大学法人横浜市立大学
研究企画・産学連携推進課長 渡邊 誠
事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
戦略推進部 難病研究課