2025-10-21 ロックフェラー大学
<関連情報>
- https://www.rockefeller.edu/news/38480-new-study-reveals-how-tiny-but-powerful-gatekeepers-guard-the-nucleus/
- https://www.pnas.org/doi/10.1073/pnas.2507559122
統合マッピングにより核質輸送のメカニズムの基礎となる分子的特徴が明らかに Integrative mapping reveals molecular features underlying the mechanism of nucleocytoplasmic transport
Barak Raveh, Roi Eliasian, Shaked Rashkovits, +8 , and Andrej Sali
Proceedings of the National Academy of Sciences Published:October 16, 2025
DOI:https://doi.org/10.1073/pnas.2507559122
Significance
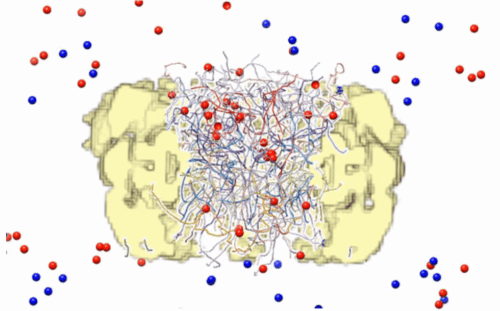
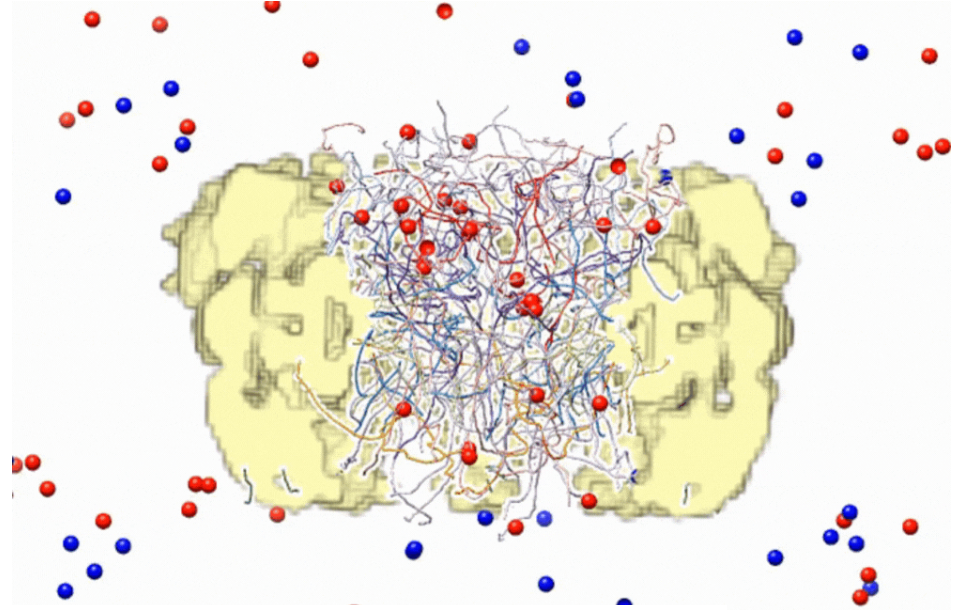
We construct an integrative experimental and computational map of macromolecular transport through the nuclear pore complex (NPC), at the level of both a single complex and the whole cell. Our approach minimizes prior assumptions about transport by exploring the space of possible models consistent with varied experimental data. The resulting spatiotemporal model reveals and quantifies molecular design features of transport, thus providing a basis for rational modulation of the NPC and its artificial mimics.
Abstract
Nuclear pore complexes (NPCs) enable rapid, selective, and robust nucleocytoplasmic transport. To explain how transport emerges from the system components and their interactions, we used experimental data and theoretical information to construct an integrative Brownian dynamics model of transport through an NPC, coupled to a kinetic model of transport in the cell. The model recapitulates key aspects of transport for a wide range of molecular cargoes, including preribosomes and viral capsids. Our model quantifies how flexible phenylalanine-glycine (FG) repeat proteins create an entropic barrier to passive diffusion and how this barrier is selectively lowered in facilitated diffusion by the many transient interactions of nuclear transport receptors with the FG repeats. Selective transport is enhanced by “fuzzy” multivalent interactions, redundant FG repeat mass, coupling to the energy-dependent RanGTP concentration gradient, and exponential dependence of transport kinetics on the transport barrier. Our model will facilitate rational modulation of the NPC and its artificial mimics.
![[新種発見] ヤドカリの「宿」を作る“淡い桃色”のイソギンチャク~万葉集に詠まれた「愛する気持ち」を名前に~ [新種発見] ヤドカリの「宿」を作る“淡い桃色”のイソギンチャク~万葉集に詠まれた「愛する気持ち」を名前に~](https://www.kumamoto-u.ac.jp/whatsnew/sizen/sizeninfo_file/20251022.jpg/@@images/c4d15779-dd51-4ef0-866a-b0fac05b3dd7.jpeg)
