動物を使わずに試験管内で多様な抗体を調製することが可能に
2019-04-25 京都大学
植田充美 農学研究科教授、青木航 同助教、宮本佳奈 同修士課程学生(現・小野薬品工業株式会社 研究員)らの研究グループは、ペプチドバーコードという新しい標識を用いて遊離型の抗体を試験管内で生産し、個体生体内での多様な抗体の結合能を有するモノクロナル抗体を迅速かつ簡単にスクリーニングして評価するという、次世代DNAシーケンサーとモノリス・ナノLC/MS/MS解析との融合による新規手法の確立に成功しました。
抗体は、研究・診断・治療などに有用な高分子ですが、主に動物細胞を用いて生産されており、時間とコストがかかります。近年、従来の抗体と同様の特性を持ちながら、分子量が約1/10のナノボデイが注目を集めています。ナノボデイは、ラクダ科の動物が持つ単一ドメイン抗体の可変領域です。
本研究では、動物個体への免疫や培養細胞等の方法を用いずに、新規発想のペプチドバーコードを用いることで、酵母を用いて試験管内で遊離状態の多様なナノボデイを迅速に作成でき、スクリーニングでモノクロナル抗体を調製可能なシステムを確立しました。
本研究成果は、2019年4月24日に、国際学術誌「PLOS ONE」のオンライン版に掲載されました。
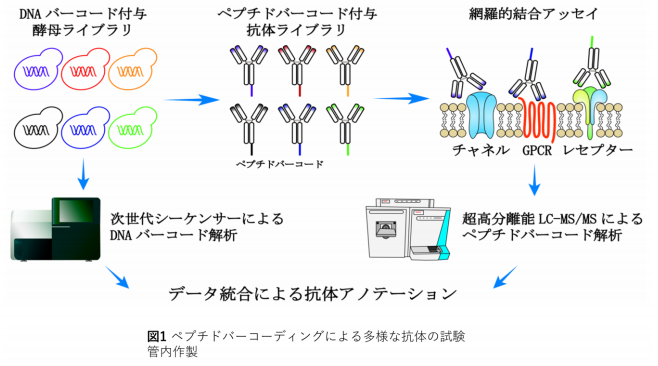
図:ペプチドバーコーディングによる多様な抗体の試験管内作製
詳しい研究内容について
多様なモノクロナル抗体分子を 迅速に作製するペプチドバーコード手法を確立
―動物を使わずに試験管内で多様な抗体を調製することが可能に―
概要
京都大学大学院農学研究科応用生命科学専攻 植田充美 教授、青木航 同助教、宮本佳奈 同修士課程学生 (現 小野薬品工業株式会社)らの研究グループは、ペプチドバーコードという新しい標識を用いて遊離型の 抗体を試験管内で生産し、個体生体内での多様な抗体の結合能を有するモノクロナル抗体を迅速かつ簡単にス クリーニングして評価するという、次世代 DNA シーケンサーとモノリス・ナノ LC/MS/MS 解析との融合に よる新規手法の確立に成功しました。
抗体は、研究 ・診断 ・治療などに有用な高分子ですが、主に動物細胞を用いて生産されており、時間とコス トがかかります。近年、従来の抗体と同様の特性を持ちながら、分子量が約 1/10 のナノボデイが注目を集め ています。ナノボデイは、ラクダ科の動物が持つ単一ドメイン抗体の可変領域です。本研究では、動物個体へ の免疫や培養細胞等の方法を用いずに、新規発想のペプチドバーコードを用いることで、酵母を用いて試験管 内で遊離状態の多様なナノボデイを迅速に作成でき、スクリーニングでモノクロナル抗体を調製可能なシステ ムを確立しました。
本研究成果は、2019 年 4 月 24 日に国際学術誌「PLOS ONE」にオンライン掲載されました。
1.背景
これまで抗体は脊椎動物個体に抗原を投与して、時間をかけて作成されてきました。抗体は、重鎖 (分子量 の重い鎖 H 鎖)と軽鎖(分子量の軽い鎖 L 鎖)からなる 150kDa(キロダルトン ダルトンは分子の質量 を表す単位)の大きなタンパク質分子です。その抗原決定部位は、ゲノム上に多様な部位の遺伝子としてコー ドされており、外部からの多様な異物の侵入に対抗してその多様性を組み合わせ、いわゆるポリクロナル抗体 タンパク質分子を作り出しています。さらに、特異性を向上させるために、ミエローマ細胞 (骨髄腫細胞)と のハイブリドーマ細胞 (融合細胞)を試験管内で作成して調製しています。抗体生産は、大きなタンパク質分 子の生産であり、ポリクロナル抗体については脊椎動物を、モノクロナル抗体については培養細胞を使った費 用と時間のかかる生産方法でした。
2.研究手法・成果
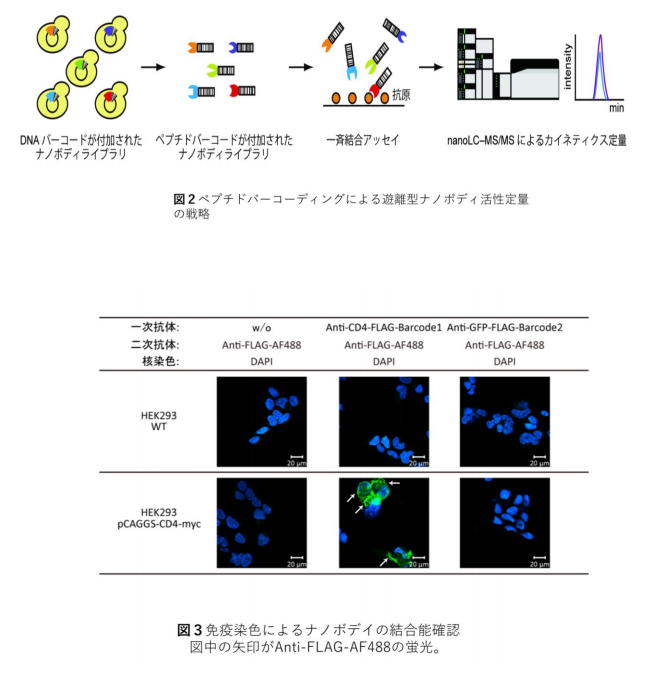
我々は、ラクダの単鎖抗体の抗原決定部位からだけなる 15kDa を利用したナノボディをベースにして、真 核生物である酵母を用いて、短期間にモノクロナル抗体を作製する方法を確立しました。酵母で、多様性を現 出させるために、ナノボディの C 末端にペプチドバーコードを付加したバーコード抗体を世界で初めて創製し ました。そして、特異的結合活性と多様性の現出に生物個体を使わずに、試験管内で成功しました(図1)。 ペプチドバーコードついては、そのもとになる DNA バーコード、次世代 DNA 配列分析、モノリス・ナノ LCMS/MS を駆使した新規なモノクロナル抗体の作製は前例がありません。
2-1.ペプチドバーコード付加抗体の発現と結合確認
ナノボデディ発現には、多量のタンパク質を分泌できるメタノール資化性酵母を用いました。その分子量は 一般的な抗体の分子量の 1/10 程度であり、微生物での生産が可能であり、細胞内に取り込まれやすく、細胞 内でも機能しやすいといった利点があります。本研究ではモデルとして、anti-CD4 ナノボディと anti-GFP ナ ノボディにそれぞれ異なるペプチドバーコードを付加して生産しました(図2)。
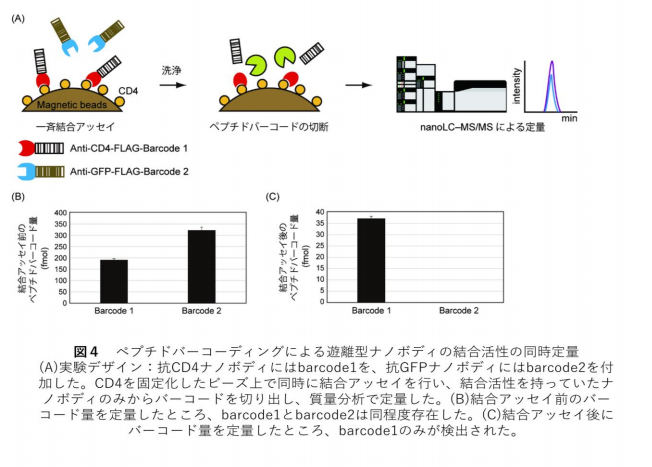
CD4 発現細胞を用いた免疫染色(図3)と表面プラズモン共鳴 (SPR)による解離定数測定の結果から、ペプ チドバーコードを付加してもナノボデイの性質に影響を与えないことが確かめられました。
2-2.ペプチドバーコーディングによる共結合アッセイ
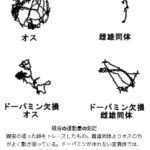
それぞれ異なるペプチドバーコードを付加した anti-CD4 ナノボディと anti-GFP ナノボディをマグネティ ックビーズに固定化した CD4 と反応させました。結合していないナノボデイを洗浄して除いた後、エンテロ キナーゼによってペプチドバーコードを切断し、モノリス・ナノ LC-MS/MS によって定量しました。その結 果、anti-CD4 ナノボディに付加していたペプチドバーコードのみが検出されました(図4)。これにより、ペプ チドバーコードを用いることで、複数の遊離型抗体の結合能力を並列に評価する系の構築が可能になると期待 できました。
3.波及効果、今後の予定
細胞内の多くのタンパク質の同定や定量に特異的な抗体を使いたい、という要望は多いですが、抗体は非常 に大きな分子で、そのすべてを調製するには、現在のところ、動物個体を使わざるを得ない現実があります。 この閉塞状態を克服するための新しい抗体として、我々の開発したバーコードナノボディは大きな福音となる と考えられます。本研究の手法であれば、脊椎動物や培養細胞を使った費用と時間のかかる抗体生産に代わり、 試験管内、実験室内で多様な性質の抗体タンパク分子を作り出すことができます。基礎的なイメージング研究 やセンシング研究だけでなく、実用的には分子標的薬(抗体)などに展開することが期待されます。
4.研究プロジェクトについて
JST-CREST 研究領域「統合1細胞解析のための革新的技術基盤」・研究課題名「細胞膜レセプタ ータンパクの1細胞統合解析技術の開発」(1細胞レセプトーム解析技術の創成)
<用語解説>
ポリクロナル抗体:抗原決定部位をいくつか持つ抗体
モノクロナル抗体:抗原決定部位を一つもつ抗体 ナノボディ:ラクダの単鎖抗体の抗原決定部位だけからなる抗体
DNA バーコード:特徴的DNA塩基の配列で、個々のDNA断片をシーケンスにより識別可能な配列
モノリス・ナノ LC-MS/MS:シリカ一体型の超微量定量解析の可能な高速液体クロマトグラフィーと質量分 析装置
ハイスループット:迅速で簡単に処理できる方法
<研究者のコメント>
抗体は分子標的薬をはじめとして、研究試薬やイメージングプローブとして有用性 が増している分子です。しかし、これまで抗体は主に、動物に抗原を接種することで取 得されていますが、この方法は多くのコストと時間がかかる上に、動物愛護の観点か らも大きな問題になります。動物を用いない抗体作製とスクリーニング法としては、 昨年のノーベル化学賞でも有名なファージディスプレイ法がありますが、抗体を担体 と融合させることによって、その機能を阻害してしまう場合もあります。
本研究では、遊離型の抗体を試験管内で微生物によって生産し、ペプチドバーコー ドを用いて抗体の同定と結合能をハイスループットに評価する新規手法を確立しまし た。この方法は、遺伝子型情報を包含するペプチドバーコードを設計し、それを抗体に 付加して発現させたもので、次世代 DNA シークエンサーで遺伝子型情報を、モノリス・ナノ LC/MS/MS で ペプチドバーコードを解析することで、ネイティブ構造 (細胞環境におけるタンパク質構造)に極めて近い遊 離型抗体の結合能を有するモノクロナル抗体をハイスループットに評価し獲得できます。分子標的薬(抗体) などの創薬や、細胞内のイメージングの分子プローブなど、多様な用途に展開できるものと期待されます。
<論文タイトルと著者>
タイトル :Peptide barcoding for establishment of new types of genotype–phenotype linkage (遺伝子型と表現型を結びつける新しい発想からなるペプチドバーコード法の確立)
著 者 :Kana Miyamoto, Wataru Aoki, Yuta Ohtani, Natsuko Miura, Shunsuke Aburaya, Yusei Matsuzaki, Kaho Kajiwara, Yoshinori Kitagawa, Mitsuyoshi Ueda
掲 載 誌 :PLOS ONE DOI 未定
<参考図>