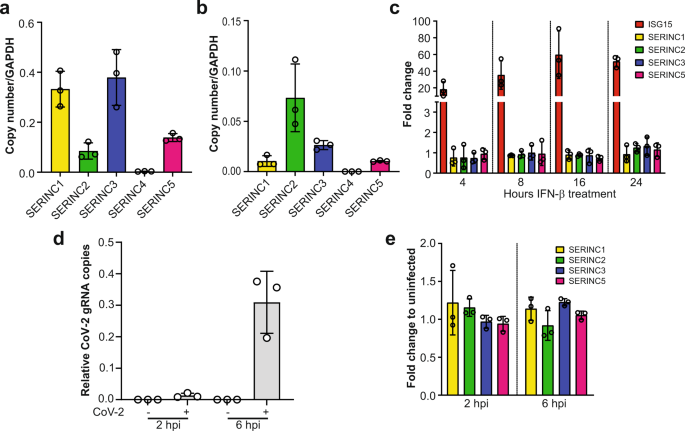
2022-05-26 理化学研究所,熊本大学
理化学研究所(理研)生命機能科学研究センター心臓再生研究チームの西山千尋テクニカルスタッフ、木村航チームリーダー、熊本大学国際先端医学研究機構(IRCMS)の有馬勇一郎特任准教授らの共同研究グループは、有袋類[1]であるハイイロジネズミオポッサム(Monodelphis domestica、以下オポッサム)の新生仔は、出生後2週間以上にわたって心臓を再生させる能力を持つことを発見しました。
本研究成果は、心臓の再生医療を可能にする新たな治療法の開発に貢献するものと期待できます。
マウスなどの哺乳類は、胎仔期や出生後数日間に限り、心筋梗塞[2]などによる心筋の損傷を再生する能力を持つことが知られています。
今回、共同研究グループは、有袋類であるオポッサムの新生仔は、出生後少なくとも2週間にわたって心筋細胞の細胞分裂を継続し、心筋再生能力を維持できることを発見しました。この維持期間は既知の哺乳類において最長です。また、マウスとオポッサムの心臓組織の遺伝子発現を網羅的に比較することで、AMPKシグナル[3]の活性化が哺乳類での出生後の心臓再生能の喪失に重要な役割を果たすことを示しました。
本研究は、科学雑誌『Circulation』オンライン版(5月26日付:日本時間5月26日)に掲載されました。
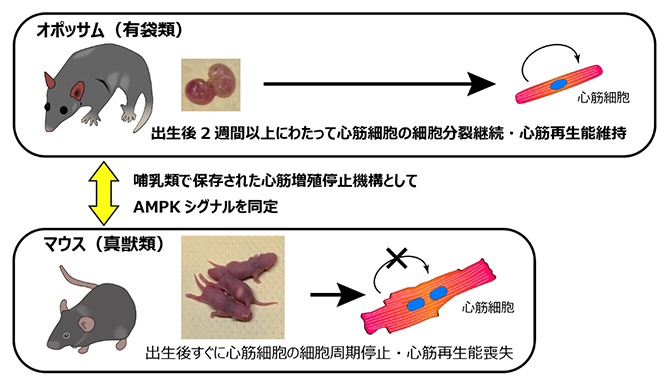
哺乳類の種間比較による心筋再生の分子機構の同定
背景
心疾患はヒトの死因の第一位を占めており、現代において最も重大な疾患の一つです注1)。その主な原因の一つとして、成体の哺乳類には心筋梗塞などで失われた心筋細胞を再生させる能力がないため、障害を受けた心臓の治療法に限界があることが挙げられます。一方、胎仔期および出生直後の新生仔期の哺乳類には、多くの心筋細胞に細胞分裂能があり、心筋梗塞などの障害を受けると心筋細胞の細胞分裂が活性化され、失われた心筋組織を再生することができます。
ところが、マウスやラットなどの小型動物からブタなどの大型動物まで、これまで調べられた全ての哺乳類において、生後数日以内にほとんどの心筋細胞は細胞分裂を停止し,同時に心筋再生能も失われることが報告されています。そのため、出生後に心筋細胞が細胞分裂を停止するメカニズムを理解することは、新しい心臓再生法の発見に大きく資すると考えられます。
マウスなどで出生後すぐに心筋細胞が細胞分裂を停止するのは、胎仔期の器官形成から出生後の器官成熟への切り替わりが、出生のタイミングに対応しているためと考えられます。一方、発達した胎盤を持つ哺乳類(真獣類[1])とは異なり、カンガルーやコアラなどの有袋類は超未熟仔の状態で誕生し、器官形成の大部分を子宮外環境で行うことが知られています。つまり有袋類では、器官形成から器官成熟への切り替わりと出生のタイミングが乖離していると考えられます。しかし、出生後に心筋細胞が細胞分裂を継続しているか、また心臓再生能を維持しているかは分かっていませんでした。
有袋類の一種ハイイロジネズミオポッサム(Monodelphis domestica、以下オポッサム)は、体長が約15cmであり、マウスやラットに似た飼育形態での繁殖、系統維持が可能であることから、有袋類では数少ない確立されたモデル動物の一つです。オポッサムは他の有袋類同様、短い妊娠期間(14日間)を経て未熟な新生仔を産みますが、カンガルーのような育児嚢(袋)を持たないため、仔は母親の乳房にしがみついて離乳期まで過ごします。
本研究では、理研生命機能科学研究センター生体モデル開発チームで飼育・維持されているオポッサム注2)を用いて、新生仔の心筋細胞が細胞分裂を継続するか、またそれと同調して心筋再生能を維持しているかを調べました。
注1)2019年の全世界死因1位はIschaemic heart disease(虚血性心疾患)で、約890万人が亡くなっている。
WHO「The top 10 causes of death(9 December 2020)」
注1)2021年7月22日プレスリリース「有袋類の遺伝子改変に世界で初めて成功」
研究手法と成果
共同研究グループはまず、オポッサム新生仔の心筋細胞の細胞分裂を観察しました。その結果、出生後2週間時点での心筋細胞の細胞分裂の頻度は、出生直後のマウス新生仔のそれと同程度であること、そしてその後2カ月の間に心筋細胞は細胞分裂を停止することが分かりました(図1)。
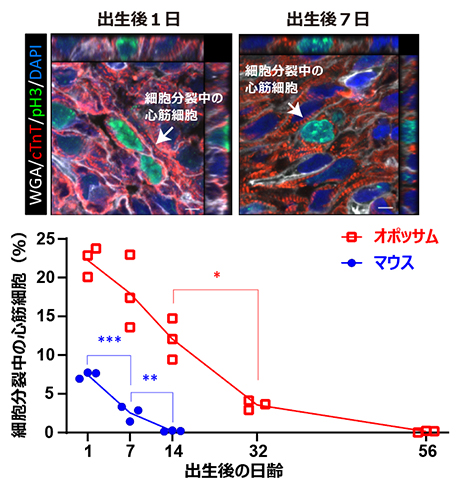
図1 マウス・オポッサム新生仔の心筋細胞の細胞分裂
(上図)出生後1日および7日のオポッサム心筋組織の免疫染色像。各色はそれぞれ、白色:細胞膜(WGA、小麦胚芽凝集素)、赤色:心筋(cTNT、心筋トロポニンT)、緑色:分裂細胞(pH3、リン酸化ヒストンH3)、青色:細胞核(DAPI)に対する染色を示す。矢印は細胞分裂している心筋細胞を指し、その断面像を上および右に並べた。スケールバーは5マイクロメートル(μm、1μmは1,000分の1mm)。
(下図)マウスおよびオポッサム新生仔について、出生後の日齢と心筋細胞の細胞分裂の頻度を比較したグラフ。四角や丸は、それぞれ観察した個体を示す。統計的有意性の指標であるP値は、一元配置分散分析後の多重比較(テューキー法)による算出。*P<0.05、**P<0.01、***P<0.001。
出生直後のマウスは心尖部切除[4]や心筋梗塞などで生じた心筋の損傷を再生できることから、オポッサム新生仔では出生後2週間まで心筋再生能を維持している可能性が考えられました。そこで、生後2週間のオポッサム新生仔に対して心尖部切除や心筋梗塞による心筋障害を導入し、心筋の損傷や心機能の回復状況を経時的に計測したところ、心筋再生能を持つことが確認されました。この心筋再生能は、出生後1カ月が経過すると失われることも分かりました(図2)。
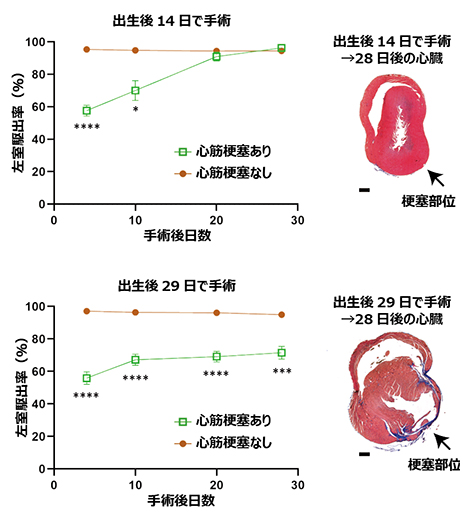
図2 オポッサム新生仔の心筋再生能力
心筋梗塞を起こした心臓の再生は、心臓が送り出す血液量の指標(左室駆出率)と、壊死した心筋細胞が結合組織に置き換わってしまう現象(線維化)の観察により、機能的、組織学的に検証できる。出生後14日(上図)および出生後29日(下図)で心筋梗塞または偽手術(心筋梗塞なし)を受けたオポッサム新生仔の、心エコーによる経時的な左室駆出率計測(左)とトリクローム染色(青色)による梗塞部位の線維化の検出(右)。出生後14日の新生仔では左室駆出率が次第に回復し、線維化も見られないことから、心臓の機能的・形態的な再生が起きていることが確認できた。P値は二元配置反復測定分散分析後の多重比較(ボンフェローニ法)による算出。*P<0.05、***P<0.001、****P<0.0001。スケールバーはいずれも500μm。
マウスやヒトなど真獣類の心筋細胞が出生後すぐに細胞分裂を停止し、心筋再生能が失われる分子メカニズムについては、これまでにさまざまなアプローチで研究が行われてきました。しかし、出生によって変化するものはホルモン分泌や栄養状態、外的刺激への応答など多岐に及ぶため、それらのうちどの要因が心筋細胞の細胞分裂を制御するのか、同定することは容易ではありません。一方、有袋類のオポッサムでは出生のタイミングと心筋細胞の細胞分裂停止のタイミングは同調しないため、心筋に影響する要因を絞り込みやすいと期待されます。
そこで、心筋細胞の細胞分裂停止の分子的背景を探索するために、オポッサム新生仔の心筋組織のトランスクリプトーム解析[5]を行いました。オポッサムやマウスなどのさまざまな発生段階でのさまざまな臓器のトランスクリプトーム解析のデータは公開されていたので、そのデータを再解析しました。その結果、オポッサムの心臓では出生後2週間前後で、AMPKシグナルと呼ばれる細胞内シグナル伝達に関わる遺伝子の発現が強く誘導されていることを見いだしました。これは、AMPKシグナルの活性化が心筋細胞の細胞分裂停止を誘導している可能性を示しています。
そこで、マウスの新生仔とオポッサムの新生仔に対して、AMPKシグナルの阻害剤を投与しその活性化を抑えたところ、いずれの新生仔においても心筋細胞の細胞分裂停止が抑制され、マウスでは出生後7日、オポッサムでは出生後28日でも心筋細胞が細胞分裂していました。さらに、AMPKシグナルの活性化を出生後の心筋細胞でのみ抑制できるコンディショナルノックアウトマウス[6]を用いた実験からも、心筋細胞でのAMPKシグナルの抑制が心筋細胞の細胞分裂停止を抑制することを確認しました(図3)。
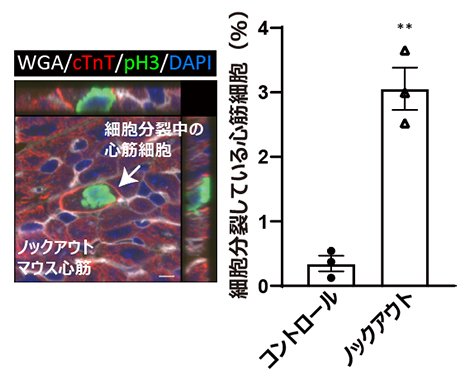
図3 心筋特異的AMPKノックアウトマウス新生仔の心筋細胞の細胞分裂
(左)出生後7日のノックアウトマウス心筋組織の免疫染色像。細胞分裂している心筋細胞を矢印で示す。スケールバーは5μm。
(右)出生後7日での対照(コントロール)群とノックアウト群でのマウス心筋細胞の細胞分裂の頻度の比較。P値はt検定による算出。**P<0.01
今後の期待
これまでの研究では、調べられた全ての哺乳類において心筋細胞は出生後数日以内に細胞分裂を停止し、心筋再生能が失われることが示されていました。今回の研究では、有袋類であるオポッサムが出生後少なくとも2週間にわたって心筋細胞の細胞分裂を継続し、心筋再生能を維持していることを示しました。これは、これまでに調べられた哺乳類の中では、心筋再生能を出生後に維持している期間としては最長になります。さらに、オポッサム心臓でのトランスクリプトームデータの再解析により、AMPKシグナルが心筋細胞の細胞分裂停止に重要な役割を果たすことを見いだしました。これらの成果は、新生仔の持つ心臓再生能の分子機構の一端を明らかにするとともに、心臓再生研究の新たなモデル動物としてオポッサムの持つポテンシャルを示すものです。
マウス新生仔では、出生後の子宮外環境への暴露が、心筋細胞の分裂を停止させることが示されています。しかし、オポッサムでは出生後も心筋細胞が細胞分裂を継続することから、オポッサムには子宮外環境でも心筋細胞が細胞分裂を継続するための特有の仕組みが備わっていることが示唆されます。今後、その詳細なメカニズムを追究し、ヒトを含む哺乳類の成体においても心筋細胞の細胞分裂を活性化する方法を発見できれば、心臓の再生医療戦略の確立に貢献すると期待できます。
補足説明
1.有袋類、真獣類
現生哺乳類の分類群。有袋類は発達した胎盤を持たず、未熟な状態で生まれた新生仔は、体外で母乳を飲んで成熟する。一方、多くの哺乳類が含まれる真獣類(有胎盤類)は、胎盤を介して母体から胚に栄養分を供給する。
2.心筋梗塞
心臓に酸素を供給する動脈が閉塞し、酸素不足となった心筋が壊死する心臓病。
3.AMPKシグナル
細胞内シグナル伝達系の一つで、細胞内のエネルギー源の枯渇に応答して活性化され、ミトコンドリア代謝の上昇などによりエネルギー産生量を増やすなどの働きを持つ。AMPKは5′-adenosine monophosphate-activated protein kinaseの略。
4.心尖部切除
心臓の損傷に対する応答について調べるために行われる、心室の先端部(心房から最も遠い箇所)を部分的に切除する実験手法。
5.トランスクリプトーム解析
細胞や組織の遺伝子発現(mRNA)の状態を網羅的に解析する手法。
6.コンディショナルノックアウトマウス
特定の遺伝子の機能を、特定の時期かつ・または特定の細胞種でのみ喪失させた遺伝子改変マウス。
共同研究グループ
理化学研究所 生命機能科学研究センター
心臓再生研究チーム
テクニカルスタッフ 西山 千尋(ニシヤマ・チヒロ)
基礎科学特別研究員 齋藤 祐一(サイトウ・ユウイチ)
研究員 坂口 あかね(サカグチ・アカネ)
チームリーダー 木村 航(キムラ・ワタル)
生体モデル開発チーム
テクニカルスタッフ 金子 麻里(カネコ・マリ)
チームリーダー 清成 寛(キヨナリ・ヒロシ)
自治医科大学 分子病態治療研究センター 再生医学研究部
准教授 魚崎 英毅(ウオサキ・ヒデキ)
熊本大学 国際先端医学研究機構(IRCMS)
特任准教授 有馬 勇一郎(アリマ・ユウイチロウ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費補助金若手研究(A)「低酸素シグナルによる心臓再生(研究代表者:木村航)」、同基盤研究(B)「生理的環境下におけるストレス応答による心筋細胞の細胞周期制御(研究代表者:木村航)」、同挑戦的研究(開拓)「哺乳類の出生の異時性に基づく心筋再生機構の解明(研究代表者:木村航)」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業「全ライフコースを対象とした個体の機能低下機構の解明」PRIME「加齢性心不全発症における心筋ターンオーバーの役割(研究代表者:木村航)」、科学技術振興機構(JST)創発的研究支援事業「心筋の代謝と再生をつなぐメカニズムの解明(研究代表者:木村航)」、などによる支援を受けて行われました。
原論文情報
Chihiro Nishiyama, Yuichi Saito, Akane Sakaguchi, Mari Kaneko, Hiroshi Kiyonari, Yuqing Xu, Yuichiro Arima, Hideki Uosaki, and Wataru Kimura, “Prolonged Myocardial Regenerative Capacity in Neonatal Opossum”, Circulation, 10.1161/CIRCULATIONAHA.121.055269
発表者
理化学研究所
生命機能科学研究センター 心臓再生研究チーム
チームリーダー 木村 航(キムラ・ワタル)
テクニカルスタッフ 西山 千尋(ニシヤマ・チヒロ)
熊本大学 国際先端医学研究機構(IRCMS)
特任准教授 有馬 勇一郎(アリマ・ユウイチロウ)
報道担当
理化学研究所 広報室 報道担当
熊本大学 総務部総務課 広報戦略室