欠神発作発生機構のパラダイムシフト
2019-05-16 理化学研究所
理化学研究所(理研)脳神経科学研究センター神経遺伝研究チームの山川和弘チームリーダー、宮本浩行研究員(研究当時)、立川哲也研究員らの共同研究グループ※は、てんかんの「欠神(けっしん)発作」が引き起こされる新たな神経回路を発見しました。
本研究成果は、てんかんの発症機構の正しい理解と効果的な治療法の開発につながると期待できます。
欠神発作はてんかん発作の一つで、意識消失を示します。これまで、欠神発作の生成部位は大脳皮質ー視床[1]神経回路であるとされ、大脳基底核[2]は単にそれを修飾する(欠神発作発生後に逆に発作を抑制する)ものと考えられてきました。また、動物モデルにおいては大脳皮質興奮性神経細胞[3]の機能低下も観察されていましたが、その役割は明らかではありませんでした。
今回、共同研究グループは、てんかん、知的障害、自閉スペクトラム症[4]などの患者で変異が見られる遺伝子「STXBP1[5]」または「SCN2A[6]」を欠損したマウスでは共通して、①欠神発作などが生じること、②①が大脳皮質興奮性神経細胞の機能低下により引き起こされること、③大脳皮質から大脳基底核の抑制性神経細胞[3]への興奮性入力の低下が欠神発作の直接の引き金(原因)となっていることを明らかにしました。さらに、典型的な欠神てんかんラットモデルの解析からも、これが一般的な欠神てんかんの発作回路であることが示唆されました。
本研究成果は、英国のオンライン科学雑誌『Nature Communications』(4月23日付け:日本時間4月23日)に掲載されました。
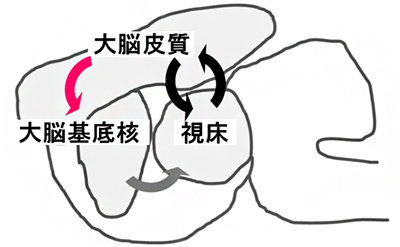
図 欠神発作の発症機構(赤矢印の機能低下により黒矢印が駆動され発作が起こる)
※共同研究グループ
理化学研究所 脳神経科学研究センター
神経遺伝研究チーム
研究員(研究当時) 宮本 浩行(みやもと ひろゆき)
(現 東京大学 ニューロインテリジェンス国際研究機構 特任講師)
研究員 立川 哲也(たつかわ てつや)
研究員(研究当時) 下畑 充志(しもはた あつし)
(現 日本医科大学)
研究員 山形 哲司(やまがた てつし)
研究員 鈴木 俊光(すずき としみつ)
研究員 ラボ・マチュー(Raveau Matthieu)
研究員(研究当時) 荻原 郁夫(おぎわら いくお)
(現 日本医科大学)
研究員(研究当時) 天野 賢治(あまの けんじ)
技術員(研究当時) 眞崎 恵美(まざき えみ)
チームリーダー 山川 和弘(やまかわ かずひろ)
行動遺伝学研究チーム
チームリーダー(研究当時) 糸原 重美(いとはら しげよし)
技術員(研究当時) 大葉 敦子(おおば あつこ)
(現 東京大学)
新潟大学 脳研究所 細胞神経生物学分野
教授 崎村 健司(さきむら けんじ)
福島医科大学 生体情報伝達研究所 生体機能研究部門
教授 小林 和人(こばやし かずと)
米国ハーバード大学 脳科学センター・分子細胞生物学科
教授 タカオ・ヘンシュ(Takao K.Hensch)
(東京大学 ニューロインテリジェンス国際研究機構 教授)
生理学研究所 行動・代謝分子解析センター ウイルスベクター開発室
准教授 小林 憲太(こばやし けんた)
※研究支援
本研究は、日本医療研究開発機構(AMED) 脳科学研究戦略推進プログラム(融合脳)「Rare variantから迫る発達障害・統合失調症の診断法・治療法の開発(代表研究者:糸川昌成)」の分担研究課題「発達障害・てんかんモデルの作成とそれらを用いた治療法の開発(分担研究者:山川和弘)」、文部科学省(MEXT)科学研究費補助金基盤研究(C)「シナプス伝達異常がもたらす難治性てんかんと知的障害発症機序の解明(代表研究者:宮本浩行)」、公益財団法人てんかん治療研究振興財団「乳児難治性てんかん大田原症候群:二つの独立したモデルマウスの解析によるてんかんと知的障害発症の神経メカニズムの解明(代表研究者:宮本浩行)」、公益財団法人川野小児医学奨学財団一般枠研究助成金「シナプス伝達を制御するMunc18-1欠損による難治性小児てんかんと知的障害発症メカニズムの解明=興奮性・抑制性細胞の選択的寄与を探る=(代表研究者:宮本浩行)」などの支援を受けて行なわれました。
背景
てんかんは反復するてんかん性の発作を特徴とし、世界における全人口の1%以上の人が発症する頻度の高い神経疾患です。てんかんにはさまざまな種類があり、その多くに遺伝的背景があるといわれています。
また、てんかん発作にも多くの種類があり、意識消失を示す「欠神(けっしん)発作」はその一つです。その発作時間は数秒から数十秒程度と短く、見た目は動きを止めてぼんやりとした状態で、本人だけでなく周りの人にも気づかれない場合が多くあります。欠神発作には、比較的軽度なてんかんに見られる「定型欠神発作[7]」や、知的障害を伴う難治性のてんかんなどに見られる、始まりと終わりが明確でない「非定型欠神発作[7]」などが知られています。欠神発作時には、棘徐波(SWD)[8]と呼ばれる特徴的な脳波が観察されます。
欠神発作についてこれまで、大脳皮質-視床神経回路が主要かつ唯一の生成部位とされ、大脳基底核など他の脳領域は単にそれを修飾する(大脳基底核は欠神発作発生後に逆に発作を抑制する)ものと考えられてきました。また、複数の欠神てんかん動物モデルで大脳皮質の興奮性神経細胞の機能低下も報告されていましたが、それが欠神発作の原因なのか、てんかん発作が原因となって現れる症状に過ぎないのかはよく分かっていませんでした。
てんかん、知的障害、自閉スペクトラム症などの患者では、電位依存性ナトリウムチャネル[9]をコードする遺伝子「SCN2A」と、シナプスタンパク質をコードする遺伝子「STXBP1」などの変異が報告されています。山川チームリーダーらはこれまでに、これらの疾患におけるSCN2Aの変異と機能変化を初めて報告するとともに注1,2,3)、Scn2aヘテロ欠損マウス[10]における記憶学習障害や記憶再生異常注4)、統合失調症様の社会性行動異常注5)、興奮性神経細胞の機能低下による欠神発作を含むてんかん発作注6)、またStxbp1ヘテロ欠損マウスにおいては興奮性神経細胞の機能低下による攻撃性の亢進注7)などを報告してきました。
しかし、それら遺伝子の異常がどのようなメカニズム(神経回路)を介して疾患の発症に至っているのかは謎のままでした。そこで本研究では、てんかんの発症神経回路の解明を目指しました。
注1)2001年5月18日プレスリリース「新規てんかん原因遺伝子の発見」
注2)2004年3月17日プレスリリース「重篤な知能障害を伴う難治てんかんの新規原因遺伝子変異の発見」
注3)Ogiwara I, et al. (2009) De novo mutations of voltage-gated sodium channel alpha II gene SCN2A in intractable epilepsies. Neurology 73: 1046-1053.
注4)2018年6月5日プレスリリース「知的障害における記憶再生の異常」
注5)Tatsukawa T, et al. (2019) Scn2a haploinsufficient mice display a spectrum of phenotypes affecting anxiety, sociability, memory flexibility and ampakine CX516 rescues their hyperactivity. Mol Autism 10:15.
注6)Ogiwara I, et al. (2018) Nav1.2 haplodeficiency in excitatory neurons causes absence-like seizures in mice. Commun Biol 1:96.
注7)Miyamoto H, et al. (2017) Potentiation of excitatory synaptic transmission ameliorates aggression in mice with Stxbp1 haploinsufficiency. Hum Mol Genet 26:4961-4974.
研究手法と成果
共同研究グループはまず、Scn2aヘテロ欠損マウス注6)と同様に、Stxbp1ヘテロ欠損マウスでもSWDを伴う欠神発作などのてんかん発作が見られることを確認しました。このSWDは、特に大脳皮質と線条体[2](大脳基底核の一部)で強く観察されました。さらに、大脳皮質、線条体、視床の機能を薬剤で抑制するとSWDが止まったことから、これらの脳領域が欠神発作の発生に深く関わっていることが分かりました。また逆に、線条体を活性化するとSWDが再現されました。これらマウスの欠神発作は、治療によく用いられる抗てんかん薬のエソスクシミドを用いると効率良く抑制されることも分かりました。
さらに興味深いことに、大脳皮質の興奮性神経細胞のみでScn2aもしくはStxbp1をヘテロ欠損させたマウスでは欠神発作が見られたのに対し、抑制性神経細胞のみでヘテロ欠損させたマウスでは発作が見られませんでした。この結果は、欠神発作の原因が、他のてんかんでしばしば報告されている抑制性神経細胞の機能低下ではなく、興奮性神経細胞の機能の低下にあることを示しています。
続いて、①Stxbp1ヘテロ欠損マウスの線条体では、脳神経細胞を興奮させる神経伝達物質のグルタミン酸[11]の放出は低下しているが、興奮を抑制するGABA(ガンマアミノ酪酸)[12]の放出低下は見られないこと、②同マウスにおいて、大脳皮質から線条体への興奮性神経伝達を亢進させるとSWDは止まるが、大脳皮質から視床への興奮性神経伝達を亢進させても止まらないこと、③大脳皮質ー線条体投射神経細胞でStxbp1もしくはScn2aを欠損させるとSWDが見られるが、大脳皮質ー視床投射神経細胞で欠損させてもSWDは見られないことを見いだしました。これらのことから、「大脳皮質から線条体への興奮性神経伝達の低下が、欠神発作を引き起こすこと」が明らかになりました。
さらに、④Stxbp1ヘテロ欠損マウスの線条体では、中型有棘細胞(MSN)[13]ではなく高頻度発火抑制性神経細胞(FSI細胞)[14]において、興奮性入力の大幅な低下が見られること、⑤野生型マウスで、薬剤を用いて線条体FSI細胞への興奮性入力を特異的に抑えると、用量依存的に欠神発作、ミオクロニー発作[15]、ジストニア[16]、強直間代発作[17]が生じること、⑥Stxbp1ヘテロ欠損マウスの線条体FSI細胞の発火[18]を特異的に亢進させるとSWDが止まること、⑦Stxbp1ヘテロ欠損マウスの線条体FSI細胞で、SWDの発生に一致して発火の一時的低下が見られることを見いだしました。これらのことから、「大脳皮質から線条体FSI細胞への興奮性入力の低下が、SWDを引き起こしていること」が明らかになりました。
以上の知見と、これまでに欠神てんかん動物モデルで報告された知見を組み合わせ、「大脳皮質ー大脳基底核(間接路)ー視床」を介する欠神発作の発症神経回路を提案しました(図1)。
加えて、多くの研究グループで長い間、典型的な欠神てんかんモデルとして研究されているGAERSラット[19]において、大脳皮質ー線条体の興奮性入力を亢進するとSWDが減少し、逆に抑制するとSWDが増加することを見いだしました。これらの結果は、大脳皮質ー大脳基底核ー視床を介する回路が一般的な欠神てんかんの発症神経回路であることを示唆しています。
今後の期待
大脳皮質-視床回路が中心かつ唯一の欠神発作発生機構であるというこれまでの説に対して、大脳皮質から大脳基底核への興奮性入力の低下によって欠神発作が生じ得ることが明らかになりました。本発症回路がSTXBP1やSCN2A以外の遺伝子変異によって引き起こされるてんかんでも成り立つのか、どこまで一般化されうるのか、さらにはより重いてんかん発作にもこの回路が役割を担っているのかなど、今後のさらなる解析が待たれます。
本成果は、今まで想定されていた欠神発作のメカニズムに大きな転換を迫るとともに、今後、てんかんに対しての効果の高い治療法開発や、意識に関連する神経回路の理解、ジストニアなどの運動障害疾患の理解にも広く寄与すると期待できます。
原論文情報
Miyamoto H†, Tatsukawa T†, Shimohata A, Yamagata T, Suzuki T, Amano K, Mazaki E, Raveau M, Ogiwara I, Oba-Asaka A, Hensch TK, Itohara S, Sakimura K, Kobayashi K, Kobayashi K, Yamakawa K* (†+co-first authors, *corresponding author)., “Impaired Cortico-Striatal Excitatory Transmission Triggers Epilepsy.”, Nature Communications, 10.1038/s41467-019-09954-9
発表者
理化学研究所
脳神経科学研究センター 神経遺伝研究チーム
チームリーダー 山川 和弘(やまかわ かずひろ)
研究員(研究当時) 宮本 浩行(みやもと ひろゆき)
(現 東京大学 ニューロインテリジェンス国際研究機構 特任講師)
研究員 立川 哲也(たつかわ てつや)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 視床
- 脳の中心に位置し、視覚、聴覚、体性感覚などの感覚入力を大脳皮質へ中継したり、大脳基底核を介して大脳皮質や小脳からの指令を受け取り、それをさらに大脳皮質に送ることで運動を引き起こしたりするなどの重要な役割を担う。
-
- 大脳基底核、線条体
- 大脳基底核は、大脳皮質と視床、脳幹を結びつけている複数の神経核の集まりであり、線条体、淡蒼球、視床下核、中脳黒質などからなる。線条体は、大脳皮質からの情報の入力部にあたり、運動制御、意思決定などに関わる。
-
- 興奮性神経細胞、抑制性神経細胞
- 興奮性神経細胞は、軸索末端からグルタミン酸を放出し、他の神経細胞を興奮させるのに対し、抑制性神経細胞は、主にガンマアミノ酪酸(GABA)を放出し、他の神経細胞の活動を抑制する。
-
- 自閉スペクトラム症
- コミュニケーションなどの社会性の障害や、興味や行動の偏りといった特徴を示す発達障害の一つ。症状が重いものには自閉症があるが、症状が軽度なものもあり、多様な表現型があるためスペクトラム症と呼ばれる。
-
- STXBP1
- 神経細胞の間のシグナル伝達(シナプス伝達)に必須のシナプスタンパク質Munc18-1をコードする遺伝子。
-
- SCN2A
- 神経細胞の興奮に必須である電位依存性ナトリウムチャネルサブユニットのうち、αサブユニット2型Nav1.2タンパク質をコードする遺伝子。
-
- 定型欠神発作、非定型欠神発作
- 定型欠神発作は、主にてんかん性の意識消失発作(欠神発作)のみを症状とし、比較的軽度で薬が良く効く「欠神てんかん」の患者でみられる。典型的には3Hzの棘徐波サイクルを示す異常脳波が見られ、発作の始まりと終わりがはっきりしている。非定型欠神発作は、レンノックス・ガストー症候群などの重症難治てんかんの患者でしばしば見られる意識消失発作。1.5~2.5Hzとやや遅い棘徐波サイクルを示す異常脳波が見られ、発作の始まりと終わりがはっきりしていない。
-
- 棘徐波(SWD)
- 「きょくじょは」と読む。尖った波(棘波)となだらかな波(徐波)が交互に続く異常脳波のこと。棘徐波複合とも呼ばれる。SWDはSpike-and-Wave Dischargeの略。
-
- 電位依存性ナトリウムチャネル
- 神経細胞膜上には、ナトリウムチャネル、カリウムチャネル、カルシウムチャネルなどさまざまなイオンチャネルが存在し、神経細胞の興奮、抑制などをつかさどっている。特に、電位依存性ナトリウムチャネルは神経細胞の興奮に主要な働きをする。ナトリウムチャネルはポア(イオンが通る穴)を形成する主要サブユニットであるαサブユニットと、その開閉などを制御するβサブユニットからなっており、αサブユニットは1~9型までが同定されており、例えば1、2、3、6型は脳に、4型は骨格筋に、5型は心臓にというようにそれぞれ発現部位が異なる。βサブユニットは1~4型までが知られている。
-
- ヘテロ欠損マウス
- 遺伝子は一つの個体あたり、父親由来と母親由来の2コピー存在する。ヘテロ接合体の場合は、正常遺伝子と変異遺伝子をそれぞれ1コピーずつ、ホモ接合体の場合は、変異遺伝子2コピーを持つ。てんかん、知的障害、自閉スペクトラム症で見られる変異の多くはヘテロ変異であることから、ヘテロ欠損マウスが疾患モデルになる。
-
- グルタミン酸
- アミノ酸の一つで、脳神経細胞を興奮させる神経伝達物質。神経細胞のシナプス前部から放出され、シナプス後部の膜上に存在するAMPA受容体、NMDA受容体などと結合し作用する。
-
- GABA(ガンマアミノ酪酸)
- アミノ酸の一つで、脳神経細胞の興奮を抑える神経伝達物質。神経細胞のシナプス前部から放出され、シナプス後部の膜上に存在するGABA受容体と結合し作用する。
-
- 中型有棘細胞(MSN)
- 線条体の神経細胞の大部分(~95%)を占めるGABA作動性の投射細胞。MSNはMedium Spiny Neuronの略。
-
- 高頻度発火抑制性神経細胞(FSI細胞)
- 高頻度(6Hz~)に発火する抑制性神経細胞であり、線条体においては中型有棘細胞に投射して、その活動を強く抑制している。パルブアルブミンというカルシウム結合タンパク質を多く発現しており、パルブアルブミン陽性細胞とも呼ばれる。FSIはFast-Spiking Interneuronの略語。
-
- ミオクロニー発作
- 短時間のピクピクとした骨格筋の攣縮(れんしゅく)発作。全身の場合もあれば、顔面、体幹、四肢の一部に限局する場合もある。
-
- ジストニア
- 中枢神経系の障害による、自分では制御できない持続的な筋収縮に関わる運動障害の総称。比較的長い筋肉の収縮により、姿勢異常や全身あるいは身体の一部が捻れたり、硬直、痙攣といった症状が起きたりする。
-
- 強直間代発作
- 「きょうちょくかんたいほっさ」と読む。てんかん発作の中でも最もよく見られるもので、大発作として知られる。強直発作に続いて間代発作が起こる。強直発作時には、強く激しい筋の収縮により、四肢がこわばった姿勢に固定される。呼吸抑制のためにチアノーゼを呈し、しばしば眼球および頭部が側方へ偏位し、転倒を伴う。間代発作時には、筋の間欠的な攣縮によるガクガクとした動きを示す。
-
- 発火
- 神経細胞が別の神経細胞から信号を受け取って活性化し、膜電位を発生すること。発生した膜電位は軸索を通って神経末端まで伝わり、シナプスで化学物質による伝達に変換されて、次の神経細胞へと情報が伝わる。
-
- GAERSラット
- 自然発生欠神てんかんモデルラット。近年、欠神てんかん患者で変異が見られるカルシウムチャネル遺伝子CACNA1Hの変異がこのラットで見つかっている。GAERSはGenetic Absence Epilepsy Rats from Strasbourgの略語。
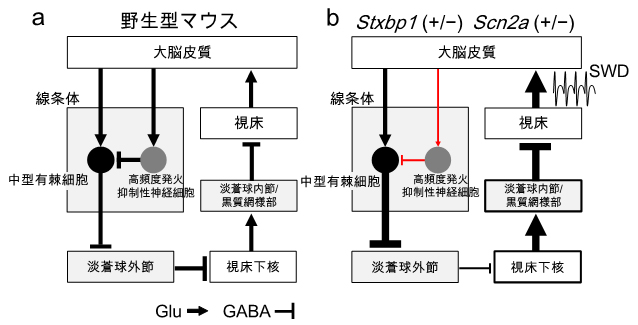
図1 欠神てんかん発症の神経回路
大脳皮質から大脳基底核にある線条体の高頻度発火抑制性神経細胞(FSI細胞)への興奮性神経伝達の低下が(赤矢印)、FSI細胞の発火低下を引き起こす。それが中型有棘細胞の脱抑制(活性化)(赤横線)、淡蒼球外節の過剰抑制、視床下核の脱抑制、淡蒼球内節・黒質網様部の過剰興奮を介して、視床投射細胞の過剰抑制とその結果としてのリバウンドにつながり、視床-大脳皮質回路の駆動、欠神発作の発症につながる。大脳基底核には線条体、淡蒼球外節、視床下核、淡蒼球内節/黒質網様部が含まれる。