遺伝子発現制御に関わる50万カ所のゲノム領域を同定
2019-05-20 理化学研究所
理化学研究所(理研)生命医科学研究センター免疫遺伝子発現研究YCIラボの吉田英行上級研究員らの国際共同研究グループ※は、マウスの免疫細胞の遺伝子発現パターンやクロマチン[1]構造の大規模な解析を行い、遺伝子発現を制御すると考えられるゲノム[2]領域を50万カ所以上同定しました。
本研究成果は、免疫システムを形成する多種多様な免疫細胞が、どのようにして異なる遺伝子発現のパターンを形成するのか、その全容解明の基盤となる知見です。したがって、免疫細胞の機能や遺伝子発現制御メカニズムの解明、さらには自己免疫疾患[3]の病因やそれらの治療方法の開発への貢献が期待できます。
今回、国際共同研究グループは、マウスから86種類の免疫細胞を単離し、それぞれの細胞集団における遺伝子発現解析[4]と、遺伝子発現を調整するオープンクロマチン領域[1]のプロファイリングを行いました。これらの手法による解析は、少数の細胞集団を対象に行われることが一般的で、これまで大規模な解析はほとんど行われていませんでした。本研究では、多種多様な免疫細胞を網羅し、従来のスケールでは不可能だった解析を行うことができました。その結果、約7,000の遺伝子について、それぞれの発現制御に関連するゲノム領域と、そこへの結合が推定される200以上の転写因子[5]、さらに何らかの遺伝子発現制御に関わっていると考えられる50万カ所以上のゲノム領域が明らかになりました。
本研究は、米国の科学雑誌『Cell』(2月7日号)に掲載されました。
※国際共同研究グループ
理化学研究所 生命医科学研究センター
融合領域リーダー育成プログラム
免疫遺伝子発現研究YCIラボ
上級研究員 吉田 英行(よしだ ひでゆき)
プログラムディレクター 山本 雅(やまもと ただし)
ブリティッシュコロンビア大学 遺伝医学部門
准教授 サラ・モスタファビ(Sara Mostafavi)
Broad Institute of MIT and Harvard
准教授 ジェイソン・ブエンロストロ(Jason Buenrostro)
ハーバード大学医学部
教授 クリストフ・ベノワ(Christophe Benoist)
背景
私たちの体内には、さまざまな種類の免疫細胞が存在します。これら免疫細胞には病原体から身体を守ったり、がん細胞を排除したりする働きがある一方、免疫細胞の異常は関節リウマチや1型糖尿病といった自己免疫疾患を引き起こすこともあります。したがって健康を維持する上で、免疫細胞の機能は非常に重要であり、免疫細胞のことを詳しく知ることは、さまざまな病気の予防や治療に役立つと考えられます。
機能の異なる多種多様な免疫細胞を比較解析することは、それぞれの特徴を調べる上で有効です。この方法の一つに、遺伝子発現解析があります。一個体内の全細胞には、同一のゲノム(遺伝情報)が存在しますが、それぞれの遺伝子の発現量には細胞の種類による違いがあり、この違いを解析することで、それぞれの細胞の特徴を調べることができます。特に、近年の技術進歩により、数万種類の遺伝子の発現を網羅的に解析することが可能となり、それぞれの細胞を包括的に調べられるようになりました。
これまでに、さまざまな免疫細胞を対象に遺伝子発現解析が行われてきており、各免疫細胞の分化に重要な遺伝子や、免疫細胞が活性化する際に重要な遺伝子などが明らかになってきています。しかし、免疫細胞の特性である造血幹細胞[6]からの分化や活性化のメカニズムを解明し、免疫細胞の全体像を捉えるためには、これらの遺伝子発現がどのように制御されているかを明らかにする必要があります。
研究手法と成果
遺伝子発現を制御する分子として、転写因子と呼ばれるタンパク質が知られています。転写因子は、ゲノム上の転写調節領域[7]内に存在する10塩基程度の特定配列(結合配列)に結合し、近傍の遺伝子の発現(転写)を制御します(図1)。
転写因子による制御は、遺伝子発現のパターンを決定する最重要なメカニズムであるので、例えばこれら転写因子の結合を広範囲に調べることができれば、それぞれの免疫細胞がどのようにして異なる遺伝子発現パターンや機能を持つのか、免疫細胞の全体像の理解に役立つと考えられます。しかし、ヒトやマウスでは1,000種類以上の転写因子が存在し、また解析には数十万~数百万といった多くの細胞を必要とするため、一つ一つの転写因子を直接的に調べることは労力や費用の点で現実的ではありませんでした。
そこで、国際共同研究グループは、多くの転写因子を一度に調べるために、次世代シークエンシング[8]の技術を利用した網羅的オープンクロマチン領域解析(ATAC-seq)[9]を行い、転写因子の転写制御領域への結合を網羅的に調べました。転写因子が結合配列へと結合すると、その周辺のゲノム構造が変化することが知られており、ATAC-seqではその変化を検出することができる点に着目しました。この手法では、結合する転写因子の種類は判別できませんが、これらの領域のDNA配列に含まれるその転写因子に特有の配列(結合配列)を調べることで、転写因子を“間接的に”推定することができます。
まず、10,000細胞あるは1,000細胞から安定した解析ができるように、ATAC-seqやRNA-seq[10]の手法を最適化し、特に重要と考えられる86種類の免疫細胞をマウス生体より単離し、①転写因子の発現量、②転写因子が結合する発現制御領域、③ターゲット遺伝子の発現量を明らかにしました。これらは遺伝子転写の一面を示すデータとはなりますが、それぞれ単独では発現制御の解析には不十分なものです。そこで、④発現制御領域のDNA配列に基づいた転写因子の予測(既知のデータベースを活用したバイオインフォマティクス[11])と組み合わせることで、大規模データである利点を活かしつつ発現制御の包括的解析を試みました。その結果、免疫細胞間の相違点や共通点といった解析も有効に行うことができました。
本研究により、何らかの遺伝子発現制御に関わっていると考えられる50万カ所以上のゲノム領域、さらには約7,000の遺伝子の発現制御に関連する転写制御領域とそこへの結合が推定される200以上の転写因子を明らかにでき、これまでの研究手法では達成できなかったスケールで免疫細胞における転写制御機構に迫ることができました(図2)。
また、T細胞やB細胞、マクロファージといった免疫細胞の各系統に沿った分化において、それぞれに重要と考えられる転写因子と転写制御領域を推定するとともに、ダイナミックに変化する転写制御領域を同定することができました。さらに、異なる免疫細胞では異なる制御領域と関連している遺伝子など、転写制御の多様性・複雑性に関する知見を深めることもできました。これらの結果は、広範な免疫細胞における転写制御を俯瞰するものでもあり、免疫細胞の遺伝子発現制御の全体像の理解を促進するものです。
今後の期待
遺伝子の発現制御は、免疫細胞の機能を決定づける根本的なメカニズムです。免疫細胞の機能異常は感染症や、がんのみならず、糖尿病といった代謝疾患にも関連しており、本研究における転写制御のメカニズムの網羅的解析データは、さまざまな疾患において免疫細胞の機能異常がどのように起こっているのかを解き明かす手掛かりとなると期待できます。
また、本研究で得られた大規模なデータは無償で公開されており、世界中の研究者が、免疫細胞の研究のみならず、より広範囲な遺伝子発現制御といった分野にも利用することができ、さまざまな生物学的研究の基盤として活用されることが期待できます。
原論文情報
Hideyuki Yoshida, Caleb A. Lareau, Ricardo N. Ramirez, Samuel A. Rose, Barbara Maier, Aleksandra Wroblewska, Fiona Desland, Aleksey Chudnovskiy, Arthur Mortha, Claudia Dominguez, Julie Tellier, Edy Kim, Dan Dwyer, Susan Shinton, Tsukasa Nabekura, YiLin Qi, Bingfei Yu, Michelle Robinette, Ki-Wook Kim, Amy Wagers, Andrew Rhoads, Stephen L. Nutt, Brian D. Brown, Sara Mostafavi, Jason D. Buenrostro, Christophe Benoist and the Immunological Genome Project, “The cis-Regulatory Atlas of the Mouse Immune System”, Cell, 10.1016/j.cell.2018.12.036
発表者
理化学研究所
生命医科学研究センター 融合領域リーダー育成プログラム 免疫遺伝子発現研究YCIラボ
上級研究員 吉田 英行(よしだ ひでゆき)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- クロマチン、オープンクロマチン領域
- クロマチンは、ゲノムDNAがヒストンタンパク質を代表としたタンパク質に巻き付くことで形成するDNA・タンパク質複合体。クロマチン構造は遺伝子の転写と関連し、転写の活性化した遺伝子座や、それに関係する転写制御領域では開いた状態となり、オープンクロマチン領域と呼ばれる。
-
- ゲノム
- 細胞の核内に存在する生体高分子(DNA配列)で、全ての遺伝情報を記録する。
-
- 自己免疫疾患
- 何らかの免疫異常によって自分の体や組織を異物のように認識し、自己抗体や自己に反応するリンパ球を作り、自分の体を攻撃する疾患のこと。代表的なものに関節リウマチがある。
-
- 遺伝子発現解析
- ゲノム(上記)上の遺伝子を鋳型として作られるRNA(リボ核酸)の解析。
-
- 転写因子
- 遺伝子の発現を調節するタンパク質。DNA上に存在する遺伝子の転写調節領域に結合し、DNAを鋳型としてRNAが産生(転写)される時期や量を調節する。
-
- 造血幹細胞
- 主に骨髄に存在し、免疫細胞を含む血球系細胞に分化可能な細胞であり、種々の免疫細胞のもととなる。
-
- 転写調節領域
- 遺伝子の上流や下流に位置し、遺伝子の転写を調節する領域のこと。転写の誘導に必要なプロモーター領域、転写効率を著しく高めるエンハンサー領域、転写を抑制するサイレンサー領域などが該当する。
-
- 次世代シークエンシング
- 数十万から数億ものDNA分子を同時に解析し、配列を調べる技術。
-
- 網羅的オープンクロマチン領域解析(ATAC-seq)
- ゲノムワイドにオープンクロマチン領域を探索する手法。開いたクロマチン領域は、活性化状態にあるシス転写調節領域に高頻度に観測されるため、シス転写調節領域の状態把握や新たなシス転写調節領域の探索などに応用可能である。ATAC-seqはAssay for Transposase-Accessible Chromatin using SEQuencingの略。
-
- RNA-seq
- 次世代シークエンシングの技術を利用した遺伝子発現解析の手法。さまざまな手法が開発されており、1細胞からの解析も可能となっている。RNA sequencingの略。
-
- バイオインフォマティクス
- 生物学と情報学の融合分野で、DNAやRNA、タンパク質など発現や機能に関する生命現象を情報科学や統計学などのアルゴリズムを用いて分析する手法のこと。
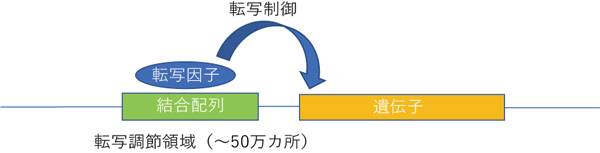
図1 転写因子による遺伝子発現制御の模式図
転写因子による遺伝子の発現制御メカニズム。多くの転写因子はそれぞれ特定のDNA配列(結合配列)に結合し、近隣の遺伝子発現(転写)を制御する。
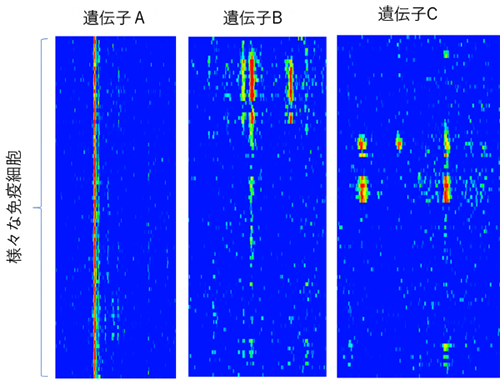
図2 免疫細胞により異なるオープンクロマチン領域
異なる免疫細胞に共通する領域(遺伝子A近傍)や細胞により異なる領域(遺伝子B、C近傍)が存在し、これらの相違が、細胞による遺伝子発現の違いを生む。領域のクローズ~オープンを青~赤で表示。