2018-02-05 理化学研究所
要旨
理化学研究所(理研)杉田理論分子科学研究室の杉田有治主任研究員、李秀栄研究員、渡部茂久研修生(研究当時)、グローバル研究クラスタ糖鎖構造生物学研究チームの山口芳樹チームリーダーらの国際共同研究グループ※は、分子動力学(MD)計算[1]を用いて、気相でのN型糖鎖[2]の立体構造アンサンブル[3]から衝突断面積[4]を予測し、糖鎖折り畳み構造と衝突断面積との関係性を明らかにしました。
糖鎖は単糖が鎖状につながった生体分子で、生体内でタンパク質や脂質に結合し、細胞間の情報伝達やウイルス感染などの病気とも関わっています。一方、糖鎖は枝分かれ構造をとり、異性体も多く存在することから、糖鎖の機能や病気に関係する構造を正確に同定することが困難でした。イオンモビリティー質量分析法(IM-MS)[5]は、生体分子をその形状(衝突断面積)に基づいて同定する技術で、近年の高感度技術を用いれば、微細な立体配座の違いで糖鎖異性体を分離できるとして注目を集めています。しかし、糖鎖は複数の安定構造をとっているため、衝突断面積からどの構造かを特定するのは困難です。
今回、国際共同研究グループは、10種類のピリジルアミノ化N型分岐型糖鎖に着目し、MD計算により立体構造アンサンブルから衝突断面積を予測することに成功しました。これまで衝突断面積から立体構造を予測した例はありますが、立体構造から衝突断面積を予測したのは初めてです。効率のよい構造探索アルゴリズムであるレプリカ交換MD法[6]を用いて、立体構造アンサンブルを高い信頼性で計算することで、定量的な予測を可能にしました。構造解析の結果、気相でのN型糖鎖は、プロトン化状態(水素イオンが付加した状態)と分岐鎖の長さに応じて特徴的な折り畳み構造をとっていることが分かり、その特徴と衝突断面積の値との間に明瞭な関係性があることが示されました。
本成果は、IM-MSデータの解釈を容易にするだけでなく、新しい糖鎖のIM-MS測定を計算化学的に予測できることを示しています。MD計算とIM-MSの連携により、今後、生体内の機能糖鎖の同定が大きく進展すると期待できます。
本成果は、英国の科学雑誌『Scientific Reports』(1月26日号)に掲載されました。
※国際共同研究グループ
理化学研究所
杉田理論分子科学研究室
主任研究員 杉田 有治(すぎた ゆうじ)
研究員 李 秀栄(り すよん)(生命システム研究センター 分子機能シミュレーション研究チーム 上級研究員)
研修生(研究当時) 渡部 茂久(わたべ しげひさ)
研究員(研究当時) 二島 渉(にしま わたる)
グローバル研究クラスタ 糖鎖構造生物学研究チーム
チームリーダー 山口 芳樹 (やまぐち よしき)
中央大学 理工学部
教授 宗行 英朗 (むねゆき えいろう)
米国メリーランド大学薬学部
教授 アレクサンダー・マッカレル(Alexander D. MacKerell Jr.)
背景
糖鎖は単糖が鎖状につながった生体分子で、生体内ではタンパク質や脂質に結合して存在しています(図1)。真核生物のタンパク質の約50%、特に膜タンパク質ではそのほとんどに糖鎖が結合していることが知られています。また、膜タンパク質に結合した糖鎖は細胞間の情報伝達やウイルス感染などの病気と密接に関わっていることが分かっています。そのため、糖鎖の機能や病気に関係する構造を正確に同定することができれば、生命現象の理解が進み、医療や創薬にも役立つと考えられます。
一方、糖鎖は枝分かれ構造をとり、異性体も多く存在することから、正確な構造解析は困難です。イオンモビリティー質量分析法(IM-MS)は、生体分子をその形状(衝突断面積)に基づいて同定する技術で、近年の高感度技術を用いれば、微細な立体配座の違いで糖鎖異性体を分離できるとして注目を集めています。しかし、糖鎖が複数の安定構造をとるため、衝突断面積の解釈を難しくしています。
研究手法と成果
国際共同研究グループは、10種類のピリジルアミノ化N型分岐型糖鎖に着目し(図2(a)左)、分子動力学(MD)計算により立体構造アンサンブルから衝突断面積を予測することを考えました。これまで衝突断面積から立体構造を予測した例はありますが、立体構造から出発して衝突断面積を予測した例はありません。効率のよい構造探索アルゴリズムであるレプリカ交換MD法を用いて、立体構造アンサンブルを高い信頼性で計算することで、定量的な予測を可能にしました。立体構造アンサンブルのクラスタ解析[7]により代表構造と存在比を割り出し、それぞれについてMOBCAL計算[8]で衝突断面積を計算した結果は、計算値と実験値の相関係数0.9を実現しました(図2(a)右)。
構造解析の結果、気相でのN型糖鎖は、プロトン化状態(水素イオンが付加した状態)と分岐鎖の長さに応じて特徴的な折り畳み構造をとっていることが分かりました(図2(b))。「α1-6アーム」が折れ曲がった「バックフォールド」構造は大きな衝突断面積を示す一方、全ての分岐鎖が寄り集まった「球状」構造では衝突断面積が著しく小さくなることが分かりました(図2(c))。ほとんどの糖鎖で、一つの安定構造が支配的になっており、衝突断面積が折り畳み構造の特徴を反映していることが示されました。
今後の期待
本成果は、IM-MSデータの解釈を容易にするだけでなく、新しい糖鎖のIM-MS測定をMD計算とMOBCAL計算から予測できることを示しています。今後、ab initio MD計算[9]と組み合わせるなどすれば、プロトン化状態の変化を含めた高精度予測も可能になります。また、MD計算とIM-MSの連携により、今後、生体内の機能糖鎖の同定が大きく進展すると期待できます。
原論文情報
Suyong Re, Shigehisa Watabe, Wataru Nishima, Eiro Muneyuki, Yoshiki Yamaguchi, Alexander D. MacKerell Jr., and Yuji Sugita, “Characterization of Conformational Ensembles of Protonated N-glycans in the Gas-Phase”, Scientific Reports, doi:
発表者
理化学研究所
主任研究員研究室 杉田理論分子科学研究室
主任研究員 杉田 有治 (すぎた ゆうじ)
研究員 李 秀栄 (り すよん)
(生命システム研究センター 分子機能シミュレーション研究チーム 上級研究員)
研修生(研究当時) 渡部 茂久 (わたべ しげひさ)
グローバル研究クラスタ システム糖鎖生物学研究グループ 糖鎖構造生物学研究チーム
チームリーダー 山口 芳樹 (やまぐち よしき)
報道担当
理化学研究所 広報室 報道担当
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
補足説明
-
- 分子動力学(MD)計算
- 原子間に働く力を計算し、運動方程式を繰り返し解くことで、分子の動きを追跡する方法。MDはMolecular Dynamicsの略。
-
- N型糖鎖
- タンパク質のアスパラギン(Asn)の側鎖に結合する分岐型糖鎖。β1-4結合したグルコサミン二量体(キトビオース)とマンノース三量体からなる共通コア構造を持つ。
-
- 立体構造アンサンブル
- 柔軟な生体分子構造を表現する、複数の立体構造からなる構造モデル。
-
- 衝突断面積
- イオンや分子が他のイオンや分子と相互作用(衝突)する際の有効面積。イオン移動度実験では、イオンが通過する際の中性ガス分子との衝突に対する有効面積を表す。
-
- イオンモビリティー質量分析法(IM-MS: Ion-Mobility Mass Spectrometry)
- 生体分子をその質量と形状(衝突断面積)に基づいて同定する分析法。IM-MSは、Ion-Mobility Mass Spectrometryの略。
-
- レプリカ交換MD法
- 構造探索効率を上げるための方法の一つ。系の複数コピー(レプリカ)に対してパラメータの異なるMD計算を実施して、レプリカ間でパラメータを適宜交換することで構造探索の効率を上げる。
-
- クラスタ解析
- 対象となる集団を、任意の特徴量を用いて部分集合に分類する解析法。
-
- MOBCAL計算
- 米国インディアナ大学のグループが開発した衝突断面積の計算プログラム。
-
- ab initio MD計算
- 経験的な力場パラメータを用いずに第一原理的に(ab initioに)力を計算するMD計算。
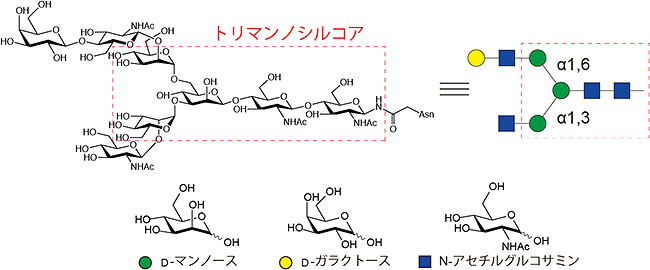
図1 N型糖鎖の構造
タンパク質のアスパラギン(Asn)の側鎖に結合する分岐型糖鎖。β1-4結合したアセチルグルコサミン二量体(キトビオース)とマンノース三量体からなる共通コア構造(トリマンノシルコア)を持つ。
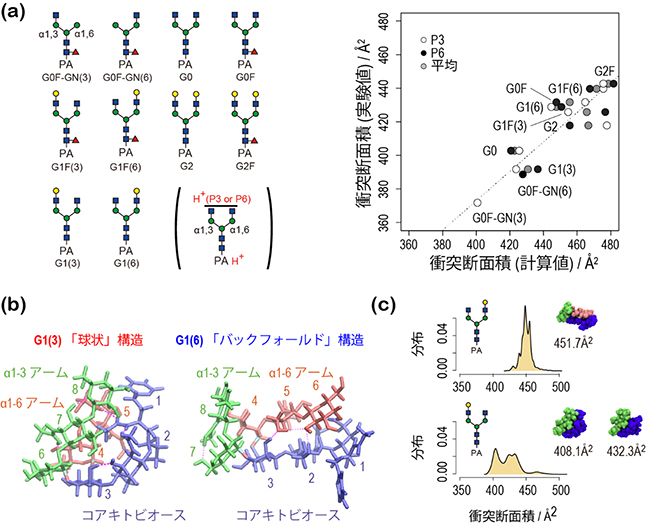
図2 10種のピリジルアミノ化N型分岐型糖鎖の衝突断面積と折り畳み構造
a:10種類のピリジルアミノ化N型分岐型糖鎖の構造(左)と計算された衝突断面積の値(右)。α1-3アームにプロトン(水素イオン)が付加した状態(P3)とα1-6アームにプロトンが付加した状態(P6)について、それぞれ衝突断面積を計算した。計算値と実験値の相関係数は0.9となった。
b:特徴的な折り畳み構造。α1-6アームが折れ曲がったバックフォールド構造(右、G1(6))と全ての分岐鎖が寄り集まった球状構造(左、G1(3))。右が大きな衝突断面積を示すのに対し、左の衝突断面積は著しく小さい。
c:計算された衝突断面積の分布の例。α1-6アームが長い糖鎖(上、G1(6))は、α1-3アームが長い糖鎖(下、G1(3))に比べて、衝突断面積が大きくなっている。