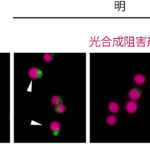
「大脳のシワ」形成に貢献する外側放射状グリアはどのように誕生するか
2019-07-08 京都大学
松崎文雄 生命科学研究科教授(兼・理化学研究所チームリーダー)、川上巧 名古屋大学特任助教、川口綾乃 同准教授らの研究グループは、発生期の大脳の中でニューロンに分化する細胞と分化しないままの神経前駆細胞の移動をもたらす共通の仕組みを明らかにしました。
神経前駆細胞は神経幹細胞とも呼ばれる細胞で、哺乳類の大脳ができる過程で分裂を繰り返しながら多くの細胞を生み出していきます。神経前駆細胞の多くは、当初は脳室面で分裂し、生まれた細胞のうちニューロンに分化する細胞は、すみやかに脳室面から離脱して外側へ移動します。この離脱は3次元的な脳を形作るための重要なステップですが、その実行役となる分子の詳細は明らかとなっていませんでした。
一方、大脳の発生が進むにつれ、脳室面から離れた外側の領域には別の種類の神経前駆細胞である外側放射状グリアが出現してきます。外側放射状グリアは「大脳にシワのない」マウスに比べて「大脳にシワを持つ」生物種で特に多く、大量のニューロンを生み出すことで大脳のシワ形成に貢献することが知られています。しかし、その誕生をもたらす仕組みはよくわかっていませんでした。
本研究グループは、これら分化細胞の脳室面からのすみやかな移動開始と外側放射状グリア誕生の両者を共通して制御している分子を発見しました。本研究は、ヒトの大脳のシワ形成にも貢献する外側放射状グリアの誕生の仕組みを初めて明らかとするとともに、それが分化細胞の移動開始という脳の発生過程でみられる基本的現象と共通の分子によって制御されていることを示しました。
本研究成果は、2019年6月25日に、国際学術誌「Nature Communications」のオンライン版に掲載されました。
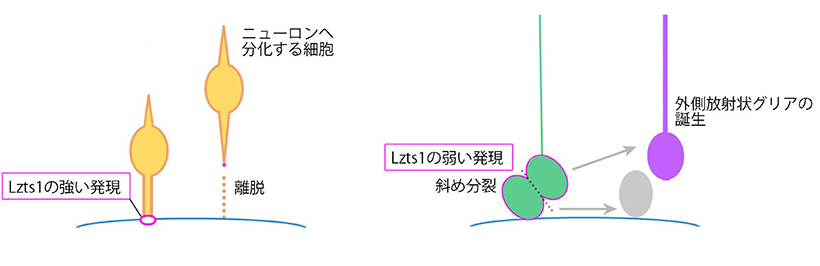
図:大脳の発生過程で、誕生したばかりのニューロン分化細胞の移動開始をLzts1という分子が制御していることを解明した
書誌情報
【DOI】 https://doi.org/10.1038/s41467-019-10730-y
【KURENAIアクセスURL】 http://hdl.handle.net/2433/242930
T. Kawaue, A. Shitamukai, A. Nagasaka, Y. Tsunekawa, T. Shinoda, K. Saito, R. Terada, M. Bilgic, T. Miyata, F. Matsuzaki & A. Kawaguchi (2019). Lzts1 controls both neuronal delamination and outer radial glial-like cell generation during mammalian cerebral development. Nature Communications, 10:2780.
詳しい研究内容について
発生期の大脳で分化細胞と未分化細胞の移動開始をもたらす共通の分子を解明
―「大脳のシワ」形成に貢献する外側放射状グリアはどのように誕生するか―
京都大学大学院生命科学研究科 松崎文雄 教授(理化学研究所生命機能科学研究センター・ チームリーダー兼任)は、名古屋大学大学院医学系研究科細胞生物学分野の川上 巧 特任助教 と川口 綾乃 准教授らの研究グループとの共同研究により、発生期の大脳の中でニューロンに 分化する細胞と分化しないままの神経前駆細胞の移動をもたらす共通の仕組みを明らかにしま した。
神経前駆細胞は神経幹細胞とも呼ばれる細胞で、哺乳類の大脳ができる過程で分裂を繰り返 しながら多くの細胞を生み出していきます。神経前駆細胞の多くは、当初は脳室面で分裂し、 生まれた細胞のうちニューロンに分化する細胞は、すみやかに脳室面から離脱して外側へ移動 します。この離脱は 3 次元的な脳を形作るための重要なステップですが、その実行役となる分 子の詳細は明らかとなっていませんでした。
一方、大脳の発生が進むにつれ、脳室面から離れた外側の領域には別の種類の神経前駆細胞 である外側放射状グリア 1)が出現してきます。外側放射状グリアは「大脳にシワのない」マウス に比べて「大脳にシワを持つ」生物種で特に多く、大量のニューロンを生み出すことで大脳の シワ形成に貢献することが知られています。しかし、その誕生をもたらす仕組みはよくわかっ ていませんでした。
本研究グループは、これら分化細胞の脳室面からのすみやかな移動開始と外側放射状グリア 誕生の両者を共通して制御している分子を発見しました。本研究は、ヒトの大脳のシワ形成に も貢献する外側放射状グリアの誕生の仕組みを初めて明らかとするとともに、実はそれが分化 細胞の移動開始という脳の発生過程でみられる基本的現象と共通の分子によって制御されてい ることを示しました。
本研究成果は、2019 年 6 月 25 日に英国科学誌「ネイチャー・コミュニケーションズ(Nature Communications)」の電子版に掲載されました。
ポイント
○ 大脳の発生過程で、誕生したばかりのニューロン分化細胞の移動開始を Lzts1 という分子 が制御していることを明らかにしました。
○ Lzts1 は外側放射状グリアとよばれる種類の未分化な神経前駆細胞の誕生も制御していま した。
○ 外側放射状グリアは大量のニューロン産生を介して「大脳のシワ」形成に貢献することから、 Lzts1 は「大脳のシワ」形成の最初のステップを制御していると考えられます。
1.背景
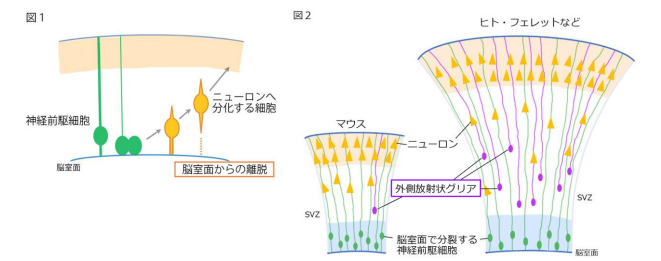
哺乳類の大脳の発生過程では、未分化な神経前駆細胞は分裂を繰り返しながら多くの細胞を生み 出していきます。複雑な形をした大脳も、もとは神経管と呼ばれる一本の管です。この管の内側の 空間が将来の脳室です。管の壁を構成する神経前駆細胞の多くは、当初は脳室面で分裂し(放射状 グリア 2))、生まれた細胞のうちニューロンに分化する細胞はすみやかに脳室面から離脱して外側 へと移動を開始し、壁の厚みを増していきます(図1)。この離脱は 3 次元的な脳を形作るために 基本となる重要なステップですが、なぜ、分化細胞だけが誕生後数時間のうちに脳室面から離脱す るのか、その実行役となる分子の詳細は明らかとなっていませんでした。
一方、大脳の発生が進み、脳壁が厚くなるにつれ、脳室面から離れた外側の領域には別の種類の 神経前駆細胞である外側放射状グリアが出現してきます。この外側放射状グリアは「大脳のシワの ない」マウスに比べて「大脳にシワを持つ」フェレットやヒトなどの生物種で特に多く、この外側 の領域(SVZ)で分裂して、大量のニューロンを生み出すことで大脳のシワ形成に貢献することが 知られています(図2)。しかし、脳の発生過程で、この外側放射状グリアがどのような分子メカ ニズムで、脳室面で分裂する神経前駆細胞から誕生するのかはよくわかっていませんでした。
2.研究成果
(1)ニューロン分化細胞の足先に発現する分子 Lzts1 の発見
本研究グループは、マウス単一細胞レベルでの遺伝子発現情報をもとに、神経前駆細胞の分裂に よって誕生するニューロンに分化する細胞が、その誕生後の早いタイミングで発現を上昇させる遺 伝子の一つとして Lzts1 を発見しました。Lzts1 は微小管 3)の形成を阻害する作用があると報告され る分子です。
Lzts1 の発現場所を調べる免疫染色の結果から、Lzts1 はこれから脳室面から離脱しようとする幼 若な分化細胞の、特に脳室面に面した突起の足先に局在していることがわかりました。また、電子 顕微鏡を用いてより詳細に発現場所を調べたところ、ベルト状の細胞接着構造(Adherens junction belt)の細胞の内側にその局在が観察されたことから、Lzts1 は分化細胞の細胞接着帯からの離脱に 関係しているのではないかと考えられました。
(2)Lzts1 は分化細胞の離脱と MST を引き起こす
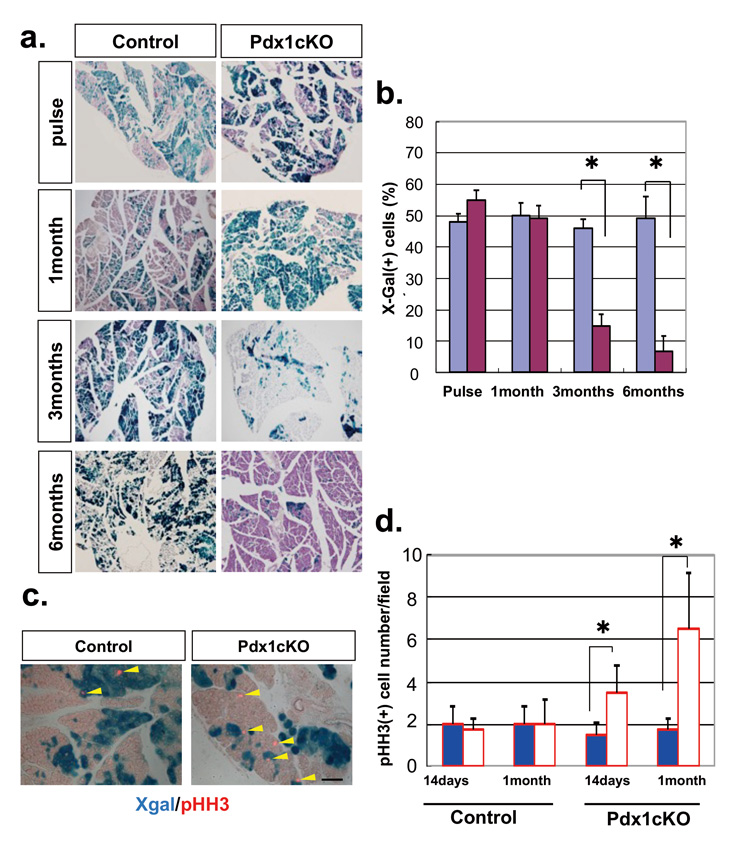
そこで、本研究グループは、生体内エレクトロポレーション法 4)を用いて Lzts1 を発生期のマウス大脳へ強制的に発現させる実験を行いました。その結果、Lzts1 は細胞の分化状態そのものには 直接的な影響をあたえない一方、Lzts1 を発現させたほぼ全ての細胞が脳室面から離脱すること、 このとき多くの細胞が MST(mitotic somal translocation)と呼ばれる特徴的な分裂直前の素早い細胞 体の動きを示すことを観察しました。
分化細胞が離脱する過程では、細胞突起の足先を束ねているリング状の細胞接着構造物 (Adherens junction ring、AJ ring)がアクトミオシン系 5)の活性化により収縮することが知られてい ます。Lzts1 強制発現はこの AJ ring の収縮を強く促すとともに、その部位にある細胞を接着する分 子 N-カドヘリンの発現も低下させていました。また、逆に、Lzts1 の発現を阻害する実験を行うと、 分化細胞の脳室面からのすみやかな離脱と移動開始が損なわれることもわかりました。
これらの結果から、Lzts1 はこれから脳室面を離脱しようとする幼若な分化細胞の突起の足先に 発現し、すみやかな離脱を促す実行役の分子として機能していることがわかりました(図3左)。
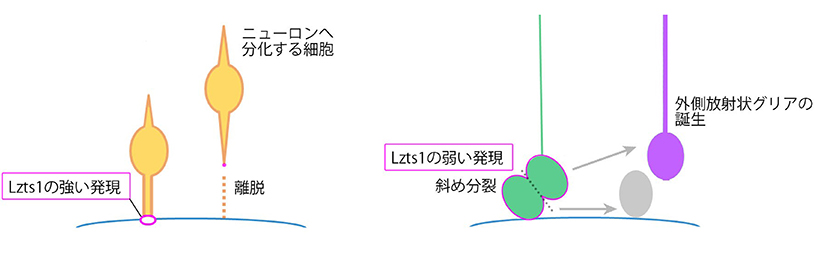
(3)低レベルに発現する Lzts1により「斜め分裂」がおこる
次に、本研究グループは神経前駆細胞における Lzts1 の機能に注目しました。脳室面で分裂する 神経前駆細胞の一部も Lzts1 を弱く発現しています。そこで Lzts1 を低レベルで神経前駆細胞に発 現させる実験を行ったところ、多くの神経前駆細胞が脳室面での分裂時に斜め分裂をするようにな りました。逆に、Lzts1 発現を阻害した神経前駆細胞の分裂の様子を顕微鏡でライブ観察したとこ ろ、斜め分裂の頻度は明らかに減少していました。このことから、通常の発生過程でも Lzts1 の弱 い発現が神経前駆細胞の斜め分裂を引き起こしていることがわかりました。
(4) Lzts1 は外側放射状グリアの誕生をもたらす
これまでの国内外の研究によって、MST や斜め分裂は外側放射状グリアの誕生を特徴づける細胞 のふるまいとされています。そこで、発生期のマウス脳で Lzts1 発現を阻害して外側放射状グリア 様細胞の誕生を調べたところ、予想どおりにその割合は減少していました。
外側放射状グリアは発生期のマウス脳にはそれほど多くなく、一方で、大脳にシワを持つ生物種 であるフェレット脳には豊富に存在することが知られています。このことから、さらに発生期のフ ェレット脳内で Lzts1 発現を阻害する実験を行ったところ、確かに誕生する外側放射状グリアの数 が減少しました。これらの一連の実験から、Lzts1 はニューロンに分化する細胞の脳室面からの離 脱のみならず、神経前駆細胞の斜め分裂を介した新たな外側放射状グリアの誕生ももたらしている ことが明らかとなりました(図3右)。
脳発生の過程を時間軸にそって考えると、これら一見異なる 2 つの現象が共通の分子によって制 御されていることは、ニューロンが生み出される時期にニューロンを生み出す能力を持った外側放射状グリアが誕生することを担保する役割を担っていると考えられます。
また、Lzts1 は霊長類であるマーモセットの脳組織でもマウスと似た発現パターンを示すこと、 ヒトの外側放射状グリアでも発現していることなどから、本研究で明らかとなった Lzts1 の機能は マウスからヒトまで保存されていることが予想されます。
3.今後の展開
本研究は、私たちヒトも含む哺乳類の脳が、どのようにしてできるのかを知ろうとする基礎研究 にあたります。本研究成果を脳の進化という点でとらえると、発生の過程で Lzts1 を発現する神経 前駆細胞の数やその中での Lzts1 発現の強さの差が、生物種による外側放射状グリアの誕生数の差 や SVZ の厚みの差をもたらしている可能性が考えられます。今後、Lzts1 発現のレベルやタイミン グをコントロールするシステムを明らかにすることが、生物種による大脳皮質の大きさや形の違い が生じる仕組みの理解へとつながることが期待されます。
4.研究支援
本研究は、日本学術振興会科学研究費助成事業新学術領域研究(研究領域提案型)「脳構築にお ける発生時計と場の連携」ならびに公益財団法人堀科学芸術振興財団の支援を受けて行ったもので す。
5.用語説明
1) 外側放射状グリア(outer radial glia, oRG):脳室側から少し外側へ離れた脳室下帯(subventricular zone, SVZ)に存在する神経前駆細胞(神経幹細胞)。特に大脳にシワを持つ生物種では豊富に存 在しており、SVZ で分裂を繰り返し大量のニューロン産生に貢献することが知られる。
2) 放射状グリア (radial glia):脳室に近い場所に細胞体があり脳室面で分裂する未分化な神経前駆 細胞(神経幹細胞)。頂端放射状グリア(apical radial glia, aRG)や頂端神経前駆細胞(apical progenitor cell)と呼ばれることもある。
3) 微小管:主要な細胞骨格の一つ。主にチューブリンがつながったもので構成される。 4) 生体エレクトロポレーション (in vivo electroporation) :生体組織中への遺伝子導入法の一つ。短 時間のパルス状の電圧をかけることで、細胞近傍の、今回は脳室内に注入した DNA や RNA を細 胞内へ導入することができる。
5) アクトミオシン:アクチンとミオシンから成り立つ収縮力をもつ複合体。
6.発表雑誌
雑誌名:Nature Communications (2019 年 6 月 25 日(日本時間 18 時)の電子版に掲載予定)
論文タイトル: Lzts1 controls both neuronal delamination and outer radial glial-like cell generation during mammalian cerebral development
著者:Takumi Kawaue1 , Atsunori Shitamukai2 , Arata Nagasaka1 , Yuji Tsunekawa2 , Tomoyasu Shinoda1 , Kanako Saito1 , Ryoma Terada1 , Merve Bilgic2, 3, Takaki Miyata1 , Fumio Matsuzaki2, 3 and Ayano Kawaguchi1 .
所属:1 Department of Anatomy and Cell Biology, Nagoya University Graduate School of Medicine
2 Laboratory for Cell Asymmetry, RIKEN Center for Biosystems Dynamics Research
3 Graduate School of Biostudies, Kyoto University
DOI:10.1038/s41467-019-10730-y