痒みをコントロールする治療薬の開発に期待
2019-08-09 九州大学,日本医療研究開発機構
九州大学生体防御医学研究所の福井宣規 主幹教授、坂田大治 助教の研究グループは、同大学医学研究院の古江増隆 教授、富山大学大学院医学薬学研究部の安東嗣修 准教授と共同して、アトピー性皮膚炎の主要な痒み惹起物質であるIL-31が、脳に「痒みの感覚」を伝える際、ニューロキニンBという物質が必要であることを世界に先駆けて発見しました。
アトピー性皮膚炎は国民の7~15%が罹患している国民病であり、痒みに伴い生活の質が著しく損なわれることから、その対策は急務となっています。IL-31は、アトピー性皮膚炎発症に重要な痒み物質で、その受容体(※1)は、感覚情報の中継点として機能する脊髄後根神経節(※2)に発現していますが、IL-31がどうやって脳に痒みの感覚を伝えているかは不明でした。研究グループは、DOCK8という分子がないマウスでは、IL-31の産生が亢進し、痒みを伴う重篤なアトピー様皮膚炎を自然発症することに着目し、このマウスの脊髄後根神経節で発現する遺伝子を解析しました。その結果、神経伝達物質(※3)であるニューロキニンBをコードする遺伝子の発現が、IL-31刺激依存的に亢進することを見出しました。ニューロキニンBを発現できないように遺伝子操作したマウスを作製したところ、通常のマウスに比べて、IL-31投与による引っ掻き行動が顕著に低下しましたが、他の痒み惹起物質に対する反応性は、両者の間で違いを認めませんでした。ニューロキニンBは、NK3Rという受容体を介して機能します。研究グループは、IL-31による痒みが、NK3Rの阻害剤で抑制できることも実証しました。
本研究成果は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業インキュベートタイプ(LEAP)の成果で、2019年8月9日(金)午前7時(米国東部時間)に米国科学雑誌「Journal of Allergy and Clinical Immunology」に掲載されます。
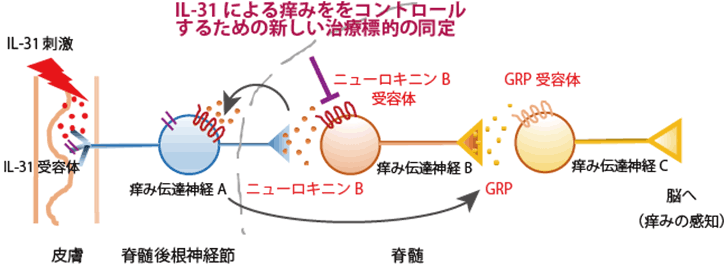
アトピー性皮膚炎の主要な痒み惹起物質であるIL-31は、ニューロキニンBを使って、脳に「痒みの感覚」を伝えることを発見しました。ニューロキニンBとその受容体NK3Rとの相互作用は、IL-31による痒みをコントロールするための、新しい治療標的になると期待されます。
背景
痒みは「掻破したいという衝動を起こさせる不快な感覚」として定義され、生活の質を著しく損なうことから、その対策は重要です。特に、アトピー性皮膚炎は国民の7~15%が罹患している国民病であり、その痒みをコントロールするための創薬ニーズは極めて高いと言えます。これまで、痒み研究はヒスタミン(※4)を中心に進んできましたが、アトピー性皮膚炎の痒みの多くは抗ヒスタミン剤(H1ヒスタミン受容体遮断薬)では抑制されないことから、別の痒み物質の存在が示唆されてきました。このような中、アトピー性皮膚炎と関連した新しい痒み物質として注目されているのがIL-31です。IL-31は主にヘルパーT細胞(※5)から産生され、その受容体は感覚を司る脊髄後根神経節に高発現することが報告されていますが、IL-31がどうやって脳に痒みの感覚を伝えているかは不明でした。
内容
研究グループは以前から、DOCK8という分子を欠損した患者さんが重篤なアトピー性皮膚炎を発症することに着目し、このタンパク質の機能解析を進めてきました。この中で、DOCK8が発現できないように遺伝子操作したマウス(Dock8–/–)では、DOCK8を発現したマウス(Dock8+/–)と異なり、掻破行動を伴う重篤なアトピー様皮膚炎を自然発症し(図1A)、血中のIL-31が異常高値を示すこと(図1B)を明らかにしています(Nature Commun. 8:13946,2017)。そこでこれらのマウスから脊髄後根神経節を単離し、その遺伝子発現を解析したところ、DOCK8欠損マウス(Dock8–/–)の脊髄後根神経節において発現が上昇する遺伝子が698種類存在しており、その上位2番に位置していたのが、ニューロキニンBをコードする遺伝子でした。興味深いことに、DOCK8欠損マウス(Dock8–/–)であっても、遺伝子操作でIL-31受容体の発現を無くしたり(Osmr–/–)、IL-31の発現を無くしたり(Il31–/–)した場合には、この遺伝子の発現上昇は認められませんでした(図1C)。このことから、ニューロキニンBが、IL-31刺激依存的に、脊髄後根神経節で産生されることが明らかになりました。
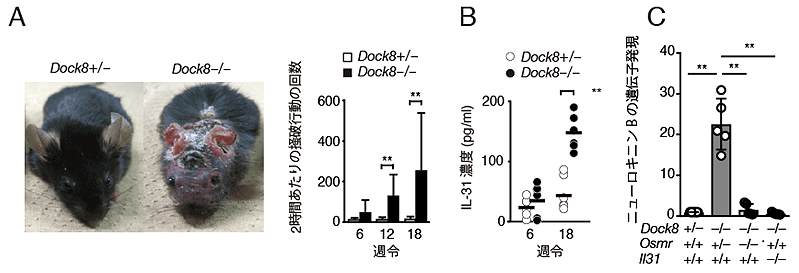
図1 DOCK8欠損マウスの脊髄後根神経節では、ニューロキニンBの発現が亢進している
A:DOCK8欠損マウス(写真右)は、掻破行動を伴う重篤なアトピー様皮膚炎を自然発症する。
B:DOCK8欠損マウスでは、血清IL-31が異常高値を示す。
C:ニューロキニンBは、IL-31刺激依存的に、脊髄後根神経節で産生される。
次に、IL-31による痒み感覚の脳への伝達に、ニューロキニンBが本当に重要なのかを調べるため、ニューロキニンBを発現できないように遺伝子操作したマウスを作製したところ、通常のマウスに比べて、IL-31投与による引っ掻き行動が顕著に低下していました(図2)。一方、他の痒み惹起物質―例えばヒスタミンやクロロキン、PAR2作動薬に対する反応性は、両者の間で違いを認めませんでした(図2)。このことから、ニューロキニンBは、IL-31による痒み感覚の伝達に選択的に関わっていることが明らかになりました。
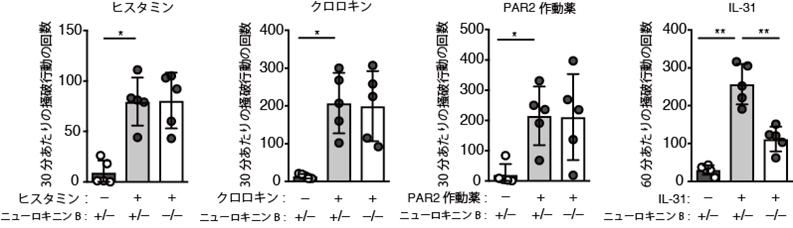
図2 ニューロキニンBは、IL-31による痒み感覚の伝達に選択的に関与している
これまで多くの痒み惹起物質が、NppbやGRPという神経伝達物質を使って、痒みの感覚を脳に伝えていることが知られています。そこで次に、これらの神経伝達物質とニューロキニンBの関係性について検討しました。ニューロキニンBをマウスの脊髄腔に注射すると、引っ掻き行動が誘発されますが、これはGRPの受容体を発現する神経細胞を前もって除去しておくと、低下します。一方、Nppbの受容体を発現する神経細胞を前もって除去しておいても、ニューロキニンBによる引っ掻き行動には、影響がありませんでした。このことから、ニューロキニンBはGRPの上流で機能し、GRPを使って、IL-31による痒み感覚を脳へ伝達していることが示唆されました(図3)。
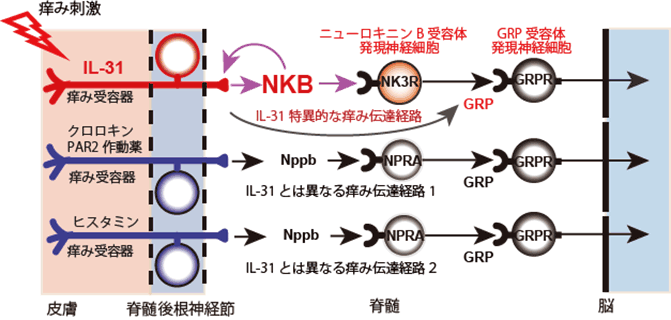
図3 IL-31による痒み感覚の伝達機構に関する模式図
NKB:ニューロキニンB、GRPR:GRP受容体、NPRA:Nppb受容体
ニューロキニンBは、NK3Rという受容体を介して、シグナルを細胞内へ伝えます。これまでに多くのNK3Rの選択的阻害剤が開発されています。例えば、オサネタントもその一つで、精神疾患の薬として開発され、これまで大きな副作用は報告されていません。オサネタントをマウスに投与しても、ヒスタミンやクロロキン、PAR2作動薬による引っ掻き行動には、全く影響がありませんでした(図4)。しかしながら、オサネタントの投与により、IL-31による引っ掻き行動が顕著に抑制されました(図4)。同様の結果は、他のNK3R阻害剤を用いた場合にも得られました。
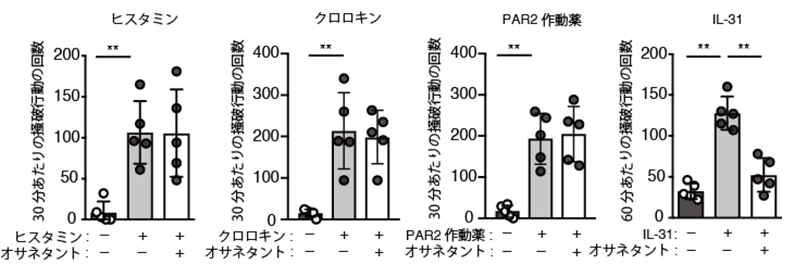
図4 NK3R阻害剤であるオサネタントは、IL-31による引っ掻き行動を選択的に抑制する
今後の展開
IL-31の発見に伴い、アトピー性皮膚炎の治療の選択肢も広がりつつあります。今回私達は、IL-31が、ニューロキニンBを介して、脳に「痒みの感覚」を伝えていることを明らかにしました。NK3R阻害剤は、アトピー性皮膚炎の痒みをコントロールするための、新たな選択肢となることが期待されます。
本研究について
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業インキュベートタイプ(LEAP)における研究課題「DOCKファミリー分子の生体機能と動作原理の解明に基づく革新的医薬品の創出」の研究成果です。
用語解説
- (※1)受容体:
- 細胞の表面に発現し、細胞外にある物質と結合して、細胞内にシグナルを伝達するタンパク質の総称。例えば、IL-31受容体は、IL-31受容体A鎖とオンコスタチンM受容体(OSMR)からなり、IL-31と結合して、細胞内にシグナルを伝達する。
- (※2)脊髄後根神経節:
- 感覚情報を伝える知覚神経路に位置する神経細胞の集団。
- (※3)神経伝達物質:
- シナプスから放出される化学物質で、受容体を介して次の神経細胞に作用し、信号を伝達する役割を有する。
- (※4)ヒスタミン:
- マスト細胞等から放出される化学物質で、アレルギー反応において中心的役割を演じている。
- (※5)ヘルパーT細胞:
- リンパ球の一種であり、CD4 T細胞とも呼ばれる。サイトカインという液性因子を分泌し、B細胞を刺激または補助して抗体の産生を促す機能を有する。
論文名
- タイトル:
- “Selective role of neurokinin B in IL-31–induced itch response in mice”
(マウスのIL-31による痒み反応におけるニューロキニンBの選択的役割) - 雑誌名:
- Journal of Allergy and Clinical Immunology
お問い合わせ先
研究に関するお問い合わせ
九州大学生体防御医学研究所
主幹教授 福井 宣規(ふくい よしのり)
報道に関するお問い合わせ
九州大学 広報室
事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課(革新的先端研究開発支援事業)