2019-12-24 理化学研究所
理化学研究所(理研)生命機能科学研究センター 非対称細胞分裂研究チームの松崎文雄チームリーダー、藤田生水研究員、下向敦範専門職研究員らの研究チームは、哺乳類の脳が作られる際に神経幹細胞が柔軟に「形」を再生する仕組みを発見しました。
本研究成果は、脳が形作られる基本的な仕組みや、その形成不全に伴う脳疾患の原因解明に貢献すると期待できます。
脳の神経細胞(ニューロン)やグリア細胞[1]を生み出す神経幹細胞は、非常に細長い柱状の細胞であり、発生途中の脳組織は、この柱が無数にひしめき合って構成されています。
今回、研究チームは多光子顕微鏡[2]などを用いて、マウス胎仔の脳組織に存在する神経幹細胞の形状変化を鮮明に捉えることに成功し、神経幹細胞が柱状の形態を柔軟に再形成することを明らかにしました。この再生能により、脳発生初期(図:増殖期)に神経幹細胞が細胞分裂するとき柱状構造が分断されたとしても、脳組織の細胞配置が保たれます。脳発生後期(図:神経産生期)になるとこの性質は失われ、柱状構造が分断された神経幹細胞が次第に蓄積していき、脳組織の中には別の神経幹細胞層が出現することも分かりました。この新たな幹細胞層の出現は、特にヒトのように大きくしわのある脳が形作られる際に見られる特徴であることが分かっており、今回の発見はその裏に潜む細胞の振る舞いを明らかにしたといえます。
本研究は、英国の科学雑誌『Nature Cell Biology』のオンライン版(12月23日付:日本時間12月24日)に掲載されます。
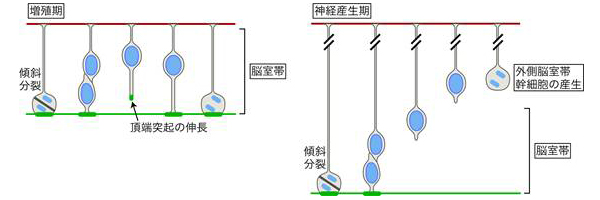
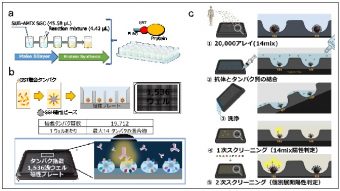
図 頂端構造再生能と脳組織構造の関係
背景
脊椎動物の脳の発生過程において、神経細胞(ニューロン)やグリア細胞を生み出す神経幹細胞を「放射状グリア[3]」と呼びます。放射状グリアは、細胞核から2本の突起を上下に伸ばした細長い柱状の細胞で、「頂端」と「基底」の細胞極性[4]を持っています。また、多数の放射状グリアがそれぞれの頂端で接着し、上皮細胞[5]のようにシート状の構造を形成します。このシート状構造が、脳の発生における基本構造となります。
放射状グリアは、細胞周期に応じて頂端-基底軸に沿って細胞核をエレベーターのように上下動させ、頂端側で細胞分裂を行います。脳が発生する際、放射状グリアは「対称分裂」による自己複製でその数を増やし(増殖期)、その後「非対称分裂」によって放射状グリアと分化細胞に分裂します。非対称分裂では、まずさまざまな種類の神経細胞が作られ(神経産生期)、後に神経細胞の働きを補佐するグリア細胞が作られることで(グリア産生期)、複雑な脳が形成されていきます。
対称分裂と非対称分裂の切り替えを制御するメカニズムは、長い間研究者達の興味を引いてきました。ショウジョウバエの神経幹細胞をはじめとするいくつかの系では、細胞極性(頂端-基底軸)と細胞分裂の軸(分裂軸)のなす角度によって、対称/非対称分裂が制御されることが明らかになっています。当初は哺乳類の脳でも同様に、放射状グリアの頂端-基底軸に対して分裂軸の角度が変わることで対称/非対称分裂が切り替わると考えられ、現在に至るまで多くの研究者がその仮説に基づいて哺乳類の脳の発生を解釈してきました。
これに対して研究チームは、マウスの脳の発生過程においては、対称/非対称分裂にかかわらず分裂軸の角度は頂端面に対してほぼ水平であること、実験的に分裂軸の角度を変えても非対称分裂は正常に起こることを示してきました注1, 2)。神経産生期に分裂軸の角度を変えると、対称・非対称分裂の割合が変わることなく、代わりに放射状グリアの柱状構造が頂端側と基底側とに分断され、基底側だけ受け継いだ放射状グリアが組織の基底側へと移動することが分かっていました。ところが、増殖期にいくら分裂軸の角度を変えても、放射状グリアの基底側への移動は起きず、全く正常な構造を保っているようでした。このことは、分裂軸の角度が放射状グリアの対称分裂に必須とする仮説はもとより、研究チームの神経産生期における実験結果とも異なるものでした。そこで、研究チームはその原因を探ることにしました。
注1)2008年1月8日プレスリリース「LGNが神経上皮細胞の自己複製能を維持している」
注2)2011年7月4日プレスリリース「脳進化をもたらした神経幹細胞の新たな分裂様式」
研究手法と成果
細胞分裂時に分裂装置の向きを制御するLGN[6]というタンパク質を欠損させると、放射状グリアはランダムな方向に細胞分裂するようになります。研究チームは、放射状グリアの分裂軸を乱すためにLGN欠損マウスを用いました。LGN欠損マウスの胎仔脳を取り出して培養し、増殖期の放射状グリアの様子を顕微鏡で観察しました。その結果、放射状グリアの細胞分裂(対称分裂)の約40%において、分裂してできた二つの娘細胞のうちの片方が頂端側を失っていることが分かりました。頂端側を失った細胞は、組織の頂端面にはつながっていないはずです。それにもかかわらず、全ての放射状グリアの細胞核は組織の頂端面まで動き、頂端面付近で細胞分裂を行いました。
その原因を探るために、多光子顕微鏡を用いて、LGN欠損マウス胎仔の脳組織を奥まで3次元的に経時観察しました(図1)。子宮内電気穿孔法[7]を用いて、細胞の形や上皮の構造が分かるように蛍光タンパク質[8]で標識したところ、頂端側を失い組織の基底側に離れてしまった放射状グリアから、頂端側に向かって細い突起が伸びる様子を捉えることに成功しました。その突起は、最終的に組織の頂端面まで到達し、頂端構造を再形成しました(図2)。これにより、基底側に離れていた放射状グリアは、元の頂端突起を持つ細長い形態を取り戻すことが明らかになりました。また突起の先端には、頂端側の構成因子である接着分子のN-カドヘリン[9]やPar極性複合体[10]が集積し、周囲の細胞と接着構造を形成していたことから、突起は周囲の細胞を伝いながら頂端面まで到達すると考えられます。
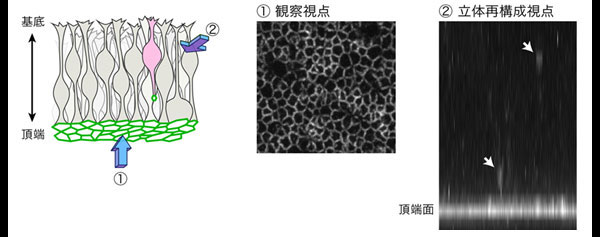
図1 大脳皮質の神経幹細胞の観察手法
接着結合の構成因子Plekha7を可視化して、神経幹細胞(放射状グリア)の動きを観察した。頂端面から見た視点①から組織を観察し、立体再構成して視点②からの動きを解析した。白い矢印は、伸長する突起の先端におけるPlekha7の集積を示す。
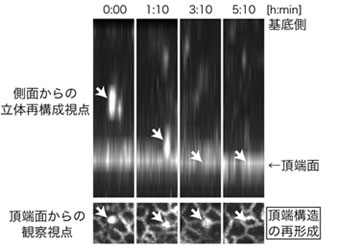
図2 LGN欠損マウスの脳における頂端構造が再形成される様子
Plekha7を観察することで、接着因子の集積が基底側から頂端面に向かって移動し、新たな頂端構造を作ることが分かった。
次に、LGN欠損マウスの脳組織で増殖期に頂端面の再形成が起こる割合を計測したところ、頂端面の約14%が再形成されたことが分かりました。前述のように、LGN欠損マウスでは細胞分裂した細胞の40%において二つの娘細胞のうち片方(すなわち娘細胞の20%)が頂端側を失うことから、頂端側を失った細胞のうちおよそ70%が頂端側の構造を再形成している計算になります。さらに、同様の計測を神経産生期でも行ったところ、再形成の割合は次第に低下することが分かりました。これらの結果は、放射状グリアが、増殖期においては頂端構造を失っても高効率で再形成でき、大半が頂端側に戻れる一方(図3上)、神経産生期になると再生能が低下し頂端側に戻れないことを示しています(図3下)。これこそが、LGN欠損マウスにおいて神経産生期にならないと基底側だけ受け継いだ放射状グリアが観察されなかった理由だと考えられます。
さらに、頂端構造の再生能をつかさどる分子メカニズムを探索した結果、細胞形態を制御するR-Ras[11]というタンパク質が関与していることが分かりました。Forster共鳴エネルギー移動(FRET)[12]プローブを用いて、野性型マウスにおけるR-Rasの活性を計測したところ、増殖期では高く、神経産生期になると低下しました。また、R-Ras遺伝子を欠損させると、増殖期の頂端構造の再生能が低下すること、逆に常時活性化型R-Rasを神経産生期の放射状グリアに発現させると、頂端構造の再生が促進されることが分かりました。また、R-Rasの上流では放射状グリアの自己複製能をつかさどるNotchシグナル経路[13]が働き、それらの下流では細胞接着シグナルを媒介するインテグリンβ1[14]が働くことが示されました。
LGN欠損マウスの観察結果から、脳室帯[15]で起こる頂端構造の再生能は、放射状グリアの基底側への移動を抑制するといえます。基底側に移動する放射状グリアは、ヒトなど霊長類の脳発生過程の後期に非常に多く出現する「外側脳室帯[15]」の神経幹細胞として知られ、脳の肥厚化やしわ形成との関連が注目されています。そこで、しわのある脳を形成するイタチ科のフェレットを用いて、放射状グリアの上皮構造再生能の寄与について検証しました。フェレット胎仔脳の放射状グリアに対して、子宮内電気穿孔法により常時活性化型R-Rasや常時活性化型Notchを導入したところ、外側脳室帯の神経幹細胞の産生が抑制されることが分かりました。これらのことから、放射状グリアがその柔軟な上皮構造の再生能を失うことは、新たな神経幹細胞層を形成して脳の肥厚化を促す必要条件となっていることが示唆されました(図3)。
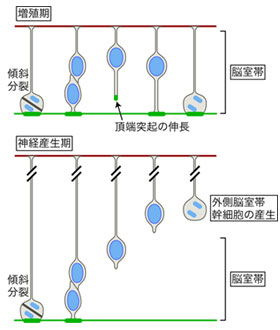
図3 頂端構造の再生能と外側脳室帯幹細胞の関係
頂端構造の再生能は、増殖期には活性が高く、神経産生期になると低下する。この変化は、神経産生期に外側脳室帯の神経幹細胞を生じるきっかけとなる。
今後の期待
今回、LGNによる分裂軸の厳密な制御をなくしても増殖期には頂端面が高効率で再形成されたことから、分裂軸の厳密な制御は放射状グリアの対称分裂に不要であることが明確となりました。このことから、従来のモデルは見直しが必要となりました。また、新たに発見した神経幹細胞の持つ「形」の再生能力は、哺乳類の脳発生と進化に新しい知見を与え、ヒトを含む脳の発生をつかさどる機構の研究が一層活性化されると期待できます。
補足説明
1.グリア細胞
神経膠(しんけいこう)細胞とも呼ばれる。脳内の神経細胞を除いた多くの細胞の総称で、アストロサイト、オリゴデンドロサイト、ミクログリアなどがある。
2.多光子顕微鏡
赤外レーザーを用いることで、組織の深部まで観察できる顕微鏡。
3.放射状グリア
歴史的経緯から「グリア」と呼ばれるが、グリア細胞ではなく神経幹細胞であることが後に判明した。脳胞の内側から外側へ突起を伸ばすため「放射状」と呼ばれる。
4.細胞極性
細胞内小器官やタンパク質の偏在化によって作られる細胞の異方性。細胞の運動や細胞間相互作用の基礎となる性質。
5.上皮細胞
強固な細胞間接着により、皮膚に代表されるシート状の組織を形作る細胞。頂端、基底の細胞極性を持ち、極性に応じて特徴的な接着分子やシグナル分子を持つ。
6.LGN
GPSM2(ショウジョウバエではPins)とも呼ばれ、ショウジョウバエから哺乳類まで広く保存されたタンパク質で、細胞が分裂するときに形成される紡錘体の末端と細胞膜をつなぐ役割を持つ。欠損すると、分裂の向きを一定に保つことができなくなる。また、ヒトのLGN遺伝子欠損は聴覚を失うことも知られており、分裂している細胞以外でもさまざまな機能があると考えられている。
7.子宮内電気穿孔法
電気パルスを加えることで、子宮内にいる胎仔の細胞にDNAなどを導入する手法。
8.蛍光タンパク質
特定波長の光で励起され、蛍光を発するタンパク質。さまざまな蛍光タンパク質をコードする遺伝子が発見・開発されている。遺伝子操作で他のタンパク質と融合させることで、それらの位置や振る舞いを観察することに応用される。
9.N-カドヘリン
カドヘリンは細胞と細胞を互いに接着させる機能を持つ膜タンパク質で、上皮構造の頂端部位に局在している。いくつものファミリーがあり、同じファミリー同士が結合する性質を持つ。N-カドヘリンは、主に神経系で発現が見られるカドヘリン(Nはneuronを示す)で、神経幹細胞の構造維持や神経細胞の移動に関与している。
10.Par極性複合体
ショウジョウバエから哺乳類まで広く存在するタンパク質の複合体で、Par3、Par6、aPKCの三種のタンパク質から構成される。さまざまな細胞の極性形成や維持に関与しており、上皮細胞では、カドヘリンと同様に上皮構造の頂端部位に局在し、上皮構造の形成や維持に関与している。
11.R-Ras
Rasファミリーに属する低分子量GTP結合タンパク質。同じファミリーでがんの原因遺伝子として有名なK-Rasタンパク質と異なり、細胞の増殖ではなく、細胞の形態を制御する。脳では神経細胞やグリア細胞の突起の形成にも関与している。
12.Forster共鳴エネルギー移動(FRET)
近接した蛍光分子間でエネルギーが移動する現象。これを利用して分子間相互作用を顕微鏡観察により検出できる。タンパク質修飾に伴う構造変化と組み合わせて、修飾酵素の活性測定にも応用される。FRETはForster Resonance Energy Transferの略。
13.Notchシグナル経路
ショウジョウバエから哺乳類まで広く保存されたシグナル伝達経路。Notchタンパク質は細胞膜に局在する受容体で、Notchリガンド(DeltaやJaggedなど)を発現する細胞とNotch受容体が発現する細胞が接触することで活性化される。Notchシグナル経路は、さまざまな組織で幹細胞の増殖や分化を制御している。
14.インテグリンβ1
細胞の表面に存在し、細胞と細胞外とをつなぐ接着シグナル分子の一つ。αとβが結合した二量体から成る。α、βそれぞれが複数種類存在し、β1はその一つである。インテグリンが細胞外の特異的なタンパク質と結合すると、FAKタンパク質がリン酸化され、細胞内にシグナルが伝わって細胞が増殖したり移動したりする。
15.脳室帯、外側脳室帯
神経産生期の初期まで、細胞分裂は組織の頂端側(脳室帯)で行われるが、後期になると脳室帯の外(外側脳室帯)でも分裂が見られるようになる。外側脳室帯の神経幹細胞は、基底側だけを持った放射状グリアのような形を持つ。マウスの脳発生ではその寄与は少ないが、ヒトの脳発生では爆発的に増大する。
研究チーム
理化学研究所 生命機能科学研究センター
非対称細胞分裂研究チーム
研究員 藤田 生水(ふじた いくみ)
専門職研究員 下向 敦範(したむかい あつのり)
大学院生(研究当時) 楠本 史也(くすもと ふみや)
大学院生リサーチ・アソシエイト(研究当時)間瀬 俊(ませ しゅん)
テクニカルスタッフ 末次 妙子(すえつぐ たえこ)
テクニカルスタッフ 大森 絢加(おおもり あやか)
研究員(研究当時)今野 大治郎(こんの だいじろう)
チームリーダー 松崎 文雄 まつざき ふみお)
生態モデル開発チーム
技師 阿部 高也(あべ たかや)
研究員 塩井 剛(しおい ごう)
自然科学研究機構 生命創成探究センター 生物画像情報解析グループ
特任助教 加藤 輝(かとう かがやき)
研究支援
本研究の一部は、日本学術振興会(JSPS)科学研究費補助金基盤研究(A)「哺乳類の複雑脳形成プログラムの解明(研究代表者:松崎文雄)」、若手研究「脳室帯外神経幹細胞を誘導したマウスにおけるMCPH遺伝子の機能解析(研究代表者:藤田生水)」、若手研究(B)「発生期大脳皮質を織り成す神経幹細胞の形態と配置(研究代表者:藤田生水)」、「高等脳における神経細胞から幹細胞へのフィードバックシグナルの役割(研究代表者:下向敦範)」、新学術領域研究(研究領域提案型)「脳構築における発生時計と場の連携(領域代表者:影山龍一郎)」、「シリア・中心体系による生体情報フローの制御(領域代表者:濱田博司)」による支援を受けて行われました。
原論文情報
Ikumi Fujita*, Atsunori Shitamukai*, Fumiya Kusumoto*, Taeko Suetsugu, Shun Mase, Ayaka Omori, Kagayaki Kato, Takaya Abe, Go Shioi, Daijiro Konno and Fumio Matsuzaki, “Endfoot regeneration restricts radial glial state and prevents translocation into the outer subventricular zone in early mammalian brain development”, Nature Cell Biology, 10.1038/s41556-019-0436-9
発表者
理化学研究所
生命機能科学研究センター 非対称細胞分裂研究チーム
チームリーダー 松崎 文雄(まつざき ふみお)
研究員 藤田 生水(ふじた いくみ)
専門職研究員 下向 敦範(したむかい あつのり)
報道担当
理化学研究所 広報室 報道担当
生産技術研究所 広報室