2020-01-21 理化学研究所
理化学研究所(理研)バイオリソース研究センター遺伝工学基盤技術室の廣瀬美智子テクニカルスタッフII、冨島俊子テクニカルスタッフII、小倉淳郎室長(開拓研究本部小倉発生遺伝工学研究室主任研究員)らの国際共同研究グループは、ハムスターを用いて、精子の先体[1]に含まれるタンパク質分解酵素の「アクロシン」が受精時における精子の卵子透明帯通過に必須であることを明らかにしました。
本研究成果は、哺乳類の受精機構の解明やヒトの男性不妊の原因究明に貢献すると期待できます。
哺乳類の卵子は、細胞の周りに存在する透明帯(糖タンパク質の膜)によって物理的な衝撃から守られています。受精の際、精子はこの丈夫な透明帯を通過する必要がありますが、そのメカニズムは不明のままでした。
今回、国際共同研究グループは、哺乳類体外受精の動物モデルとして長年使われてきたゴールデンハムスターからアクロシンを欠失させた雄ハムスター(ノックアウトハムスター)を作出し、このハムスターでは自然交配で産仔を得られず、不妊であることを確認しました。また、体外受精の実験により、ノックアウトハムスター精子は透明帯に結合するものの通過できない一方、透明帯を除去した卵子とは問題なく受精することが分かりました。この結果から、アクロシンは精子の透明帯通過に必要で、正常な受精に必須な因子であることが示されました。ヒトを含めた他の多くの哺乳類の精子も、ハムスター精子と同様に発達した先体を持つことから、アクロシンの異常が男性不妊の原因の一つである可能性が考えられます。
本研究は、米国の科学雑誌『Proceedings of the National Academy of Sciences (PNAS)』オンライン版(1月20日付:日本時間1月21日)に掲載されます。
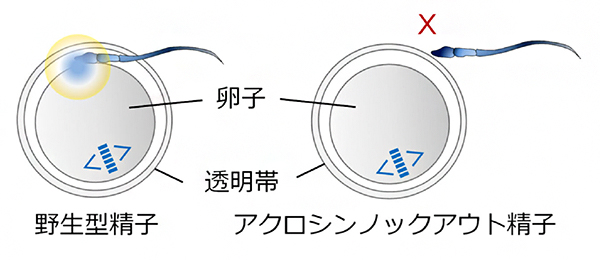
図 精子先体酵素アクロシンは精子の透明帯通過に必須である
背景
哺乳類の卵子(卵母細胞)は、直径100マイクロメートル(μm、1μmは1,000分の1mm)以下の小さな細胞です。卵子は「透明帯」と呼ばれる糖タンパク質の膜に包まれており、これによって物理的な衝撃や感染から守られています。しかし、透明帯はゴムのように丈夫なため、受精の際に透明帯を通過する必要のある精子にとっては大きな障壁となります。精子が透明帯を通過するメカニズムは、精子の物理的な力(推進力)と精子頭部の「先体」に含まれるタンパク質分解酵素による化学的な力によると考えられています。しかし、これまで、精子先体酵素の中で透明帯通過の際に機能するものは同定されておらず、後者のメカニズムは不明でした。
精子先体酵素の一つに、「アクロシン」と呼ばれるセリンプロテアーゼ[2]があります。マウスおよびラットの精子はアクロシンを欠失(ノックアウト)しても透明帯を通過できることから、これまでアクロシンは透明帯通過には機能していないと考えられてきました。しかし、マウスとラットの先体は特に小さいため、それは必ずしも哺乳類全般には当てはまらない可能性があります。哺乳類の体外受精の代表的なモデル動物としてゴールデンハムスターが長年使われてきましたが、ハムスターの受精卵は体外で操作すると発生が止まるために、その遺伝子ノックアウト技術はまだ確立されていませんでした。
そこで、国際共同研究グループは、同グループの東海大学・大塚正人准教授が開発した体内エレクトロポレーション法(電気穿孔法)である「i-GONAD法[3]」のハムスターへの応用を試みました。i-GONAD法では、CRISPR/Cas9[4]と呼ばれるゲノム編集技術の試剤(Cas9タンパク質とガイドRNA)を受精卵の存在する卵管内へ注入し、卵管全体に電気パルスをかけます。したがって、受精卵を体外で取り扱う必要がなく、ノックアウトハムスターの作出に適した方法だと考えられました。
研究手法と成果
国際共同研究グループは、まず、マウス用に開発されたi-GONAD法の条件をハムスター用に最適化しました。その結果、5匹のアクロシンノックアウトハムスターの作出に成功し、これらのハムスターを交配させて2つのアクロシンノックアウト系統を樹立しました(図1A)。最初に、ゼラチン分解活性の解析とウエスタンブロット法[5]により、ノックアウトハムスター雄の精子がアクロシンタンパク質を欠失していることを確認しました。一方、精子機能の重要なパラメーターである精子運動性と先体反応[1]の速度には異常はありませんでした(図1B,C)。
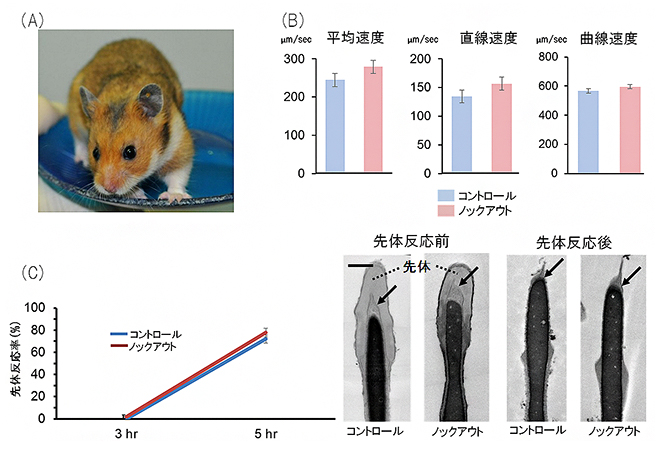
図1 作出したアクロシンノックアウトハムスター精子の運動性と先体反応速度の結果
(A)アクロシンをノックアウトした雄ハムスター。
(B)ノックアウトハムスターの精子では、その運動性(平均速度、直線速度、曲線速度)に異常は見られなかった。
(C)左は、先体反応速度を示すグラフ。ノックアウトハムスターやコントロールハムスターの精子を先体反応の促進液で培養すると、約5時間で精子の80%において先体反応が起こった。右は、先体反応前後における精子頭部の電子顕微鏡写真。先体反応の前に存在していた先体(灰色の部分)が反応後に消失し、先体内膜(矢印)が露出したことが分かる。スケールバーは0.5μm。
次に、ノックアウトハムスター2系統の雄を野生型の雌と自然交配させたところ、産仔は得られず不妊であることが分かりました。一方、野生型雄を野生型雌と交配させた場合は産仔が得られました。
体外受精の場合は、野生型精子の受精率は88%であったのに対し、ノックアウト精子では0%でした(図2A)。光学顕微鏡観察により、ノックアウト精子は透明帯に結合できるものの、通過できないことが分かりました(図2B)。そこで、23個のあらかじめ透明帯を除去した卵子とノックアウト精子を体外受精させたところ、全ての卵子が受精しました(図2A)。以上の実験から、アクロシンは精子機能のうち特に透明帯通過に重要な役割を果たす、受精に必須の因子であることが分かりました。
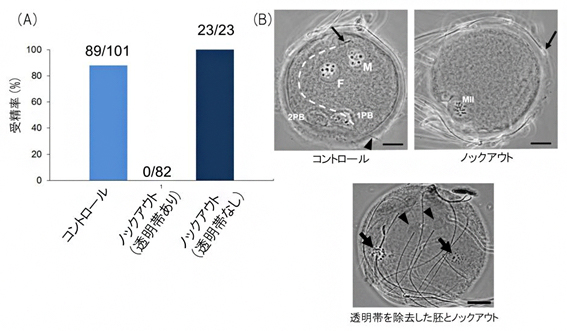
図2 体外受精による受精率と受精胚の写真
(A)体外受精による受精率。コントロール精子では88%だったのに対し、ノックアウト精子では0%だった。また、ノックアウト精子と透明帯を除去した卵子を用いた場合の受精率は100%だった。
(B)光学顕微鏡による体外受精胚の写真。コントロール精子と体外受精させた卵子では、雌性前核(F)と雄性前核(M)、卵子に侵入した精子の尾部(矢印から白点線を経て矢頭まで)、第2極体(2PB)が観察されるが、ノックアウト精子と体外受精させた卵子では雌染色体(MII)のみが観察される。透明帯を除去した卵子とノックアウト精子の体外受精では、複数の前核(矢印)や卵子内で膨化した精子頭部(矢頭)と多くの卵子内の精子が観察される。スケールバーは20μm。
今後の期待
本研究では、哺乳類の精子が先体酵素アクロシンの活性を利用して透明帯を通過することを初めて明らかにしました。アクロシンはヒトを含めた他の哺乳動物種の精子先体にも豊富に含まれているため、ハムスター以外の動物でも同様の機能を持つ可能性があります。
また、ヒトを含めた他の多くの哺乳類の精子も、ハムスター精子と同様に発達した先体を持つことから、アクロシンの異常が男性不妊の原因である可能性があります。したがって本成果は、ヒトの不妊治療の現場における男性不妊の治療上の一つの指標となると期待できます。
補足説明
1.先体、先体反応
先体は、精子の頭部に存在する袋状の構造物で、内部には数種類のタンパク質分解酵素が含まれている。受精能を獲得した精子は、細胞膜と先体外膜が融合して胞状化し、先体内の酵素を放出する。この現象を先体反応という。
2.セリンプロテアーゼ
活性中心にセリン残基を持つプロテアーゼ(タンパク質分解酵素)。
3.i-GONAD法
受精卵(着床前胚)を持つ妊娠した雌の卵管内にゲノム編集試薬を注入し、卵管全体に対して電気穿孔を行うだけのシンプルな手法。i-GONADはimproved Genome-editing via Oviductal Nucleic Acids Deliveryの略。
4.CRISPR/Cas9
CRISPR/Cas系を用いたゲノム編集技術の一つ。CRISPR/Cas系は古細菌が持つ獲得免疫機構で、外来性のDNAを自らのゲノムに組み込み、2度目の感染のときにこの外来性のDNAの断片から二つのガイドRNAを発現させ、侵入してきた標的DNAを、Cas9ヌクレアーゼを用いて切断する系である。一つのガイドRNAとCas9の二つの因子だけでゲノムDNAを切断できることが分かっており、手法の簡便さからゲノム編集の主たる手法となりつつある。
5.ウエスタンブロット法
電気泳動によって分離したタンパク質を特殊な膜に転写した後、ある特定の抗体を利用することで目的タンパク質の存在を検出もしくは定量する方法。
国際共同研究グループ
理化学研究所 バイオリソース研究センター 遺伝工学基盤技術室
テクニカルスタッフⅡ 廣瀬 美智子(ひろせ みちこ)
専任研究員 的場 章悟(まとば しょうご)
テクニカルスタッフⅡ 冨島 俊子(とみしま としこ)
専任技師 持田 慶司(もちだ けいじ)
テクニカルスタッフⅡ 長谷川 歩未(はせがわ あゆみ)
専任研究員 井上 貴美子(いのうえ きみこ)
室長 小倉 淳郎(おぐら あつお)
(理化学研究所 開拓研究本部 小倉発生遺伝工学研究室 主任研究員)
京都大学大学院 医学研究科 付属動物実験施設
准教授 本多 新(ほんだ あらた)
Institute of Molecular Genetics of the ASCRCAS
Institute of Experimental Medicine CAS
研究員 Fulka Helena(フルカ・ヘレナ)
筑波大学大学院 生命環境科学研究科 生物機能科学専攻 分子発生制御学研究室
大学院生(当時) 永島 聖(ながしま きよし)
教授 馬場 忠(ばば ただし)
東海大学 医学部 基礎医学系分子生命科学 遺伝子工学・ゲノム編集研究室
教授 大塚 正人(おおつか まさと)
国立国際医療センター研究所 共通実験室
上級研究員 中野(田村) 美和(たむら(なかの) みわ)
ハワイ大学 医学部
名誉教授 柳町 隆造(やなぎまち りゅうぞう)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究B「ゴールデンハムスターを用いた新たな遺伝子改変モデルプラットフォームの確立(研究代表者:小倉淳郎)」、同新学術領域研究「マウス核移植技術の開発による正常クローン胚・胎盤の構築(研究代表者:小倉淳郎)」、同国際共同研究強化(B)「受精/初期発生の場としての卵管:その生理機能の分子論的検証と臨床応用への基盤構築(研究代表者:荒木慶彦」、理研横断的研究プロジェクト「エピゲノム操作」(代表:眞貝洋一)による支援を受けて行われました。
原論文情報
Michiko Hirose, Arata Honda, Helena Fulka, Miwa Tamura-Nakano, Shogo Matoba, Toshiko Tomishima, Keiji Mochida, Ayumi Hasegawa, Kiyoshi Nagashima, Kimiko Inoue, Masato Ohtsuka, Tadashi Baba, Ryuzo Yanagimachi, Atsuo Ogura, “Acrosin is essential for sperm penetration through the zona pellucida in hamsters”, Proceedings of the National Academy of Sciences of the United States of America
発表者
理化学研究所
バイオリソース研究センター 遺伝工学基盤技術室
テクニカルスタッフⅡ 広瀬 美智子(ひろせ みちこ)
テクニカルスタッフⅡ 冨島 俊子(とみしま としこ)
室長 小倉 淳郎(おぐら あつお)
報道担当
理化学研究所 広報室 報道担当