酵素の超感度検出による疾患の早期診断法の確立に期待
2020-03-12 東京大学,理化学研究所,名古屋市立大学,国立がん研究センター,科学技術振興機構
ポイント
- 血液中に含まれるさまざまな酵素を「1分子」レベルで区別して検出する方法論を開発した。
- 酵素活性を高感度に検出する有機小分子蛍光プローブ技術と、1分子レベルの高精度計測を可能とするマイクロチップ技術を融合させることで、これまでの方法論では検出が困難であった血液中のごく微少量の疾患関連酵素を超高感度に検出することを実現した。
- 膵臓がん患者血漿を用いた解析によって、疾患の進行に伴い血液中に上昇する新たなバイオマーカー候補たんぱく質の発見に成功した。さらなる疾患バイオマーカー候補の発見や、これに基づく新たな疾患診断法の確立につながることが期待される。
東京大学 大学院薬学系研究科の坂本 眞伍 大学院生、小松 徹 特任助教、浦野 泰照 教授、理化学研究所 開拓研究本部 渡邉分子生理学研究室の渡邉 力也 主任研究員、東京大学 大学院工学系研究科の野地 博行 教授、名古屋市立大学 大学院薬学系研究科の中川 秀彦 教授、国立がん研究センター 研究所の本田 一文 部門長らの研究グループは、血液中の酵素を「1分子」レベルで区別して検出する新たな方法論を開発し、疾患と関わる酵素活性異常を超高感度に検出する病態診断法の可能性を示しました。
生体内には、数千種類を超える酵素が存在し、これらの中にはさまざまな疾患の発生と関連して活性異常が起こるものもあります。血液中の特定の酵素活性の異常を知ることは、疾患の有無を判断する際の指標(バイオマーカー注1))として広く用いられています。
しかしながら、現在、血液中の酵素を検出する方法論では、その感度の不十分さから血液中にごく微少量で存在する酵素を検出することが困難である場面がしばしば見られ、特に、疾患の早期診断に関わる酵素活性異常を見つけるためには、このような酵素の活性検出法の高感度化が求められています。小松特任助教、渡邉主任研究員らの研究グループは、酵素活性を高感度に検出する有機小分子蛍光プローブ技術と、1分子レベルの高精度計測を可能とするマイクロチップ技術という異なる分野の技術を融合させることで、生体サンプル中の多数の酵素の活性を1分子レベルで網羅的に検出する方法論を世界に先駆けて確立し、これまでの方法論では検出が困難であった血液中のごく微少量の疾患関連酵素を超高感度に検出することを可能としました。さらに、本手法の疾患診断およびその確立を目指す基礎研究への応用可能性を検証するため、膵臓がん患者血液中の酵素活性を解析し、疾患の進行に伴い血液中に上昇する新たなバイオマーカー候補たんぱく質を発見することに成功しました。今後、本手法を用いてさらなる疾患バイオマーカー候補の発見や、これに基づく新たな疾患診断法の確立につながることが強く期待されます。
本成果は、2020年3月11日(米国東部夏時間)に「Science Advances」オンライン版で公開される予定です。
本研究成果は、科学技術振興機構(JST) 戦略的創造研究推進事業(さきがけ「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」、「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」、さきがけネットワーク「1分子機能カウンティングから紐解く高次生命科学」、CREST「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」)、内閣府(革新的研究開発推進プログラム ImPACT「豊かで安全な社会と新しいバイオものづくりを実現する人工細胞リアクタ」)、AMED(革新的先端研究開発支援事業「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」、次世代がん医療創生研究事業(P-CREATE))、日本学術振興会(科研費 15H05371、15K14937、17K19477、18H04538、19H02846、15K18899、16H05103)、持田記念医学薬学振興財団、内藤記念科学振興財団、東京生化学研究会をはじめとする諸機関からの研究支援によって得られた成果です。
<発表内容>
生体サンプル中の1つの分子の挙動を観察する1分子計測技術注2)は、日本が世界に先駆けて確立した研究分野です。1分子酵素活性計測法は、希釈した酵素の溶液を数十フェムトリットルスケールのごく微小な反応容器が数十万個連結したマイクロチップ内に封入し、この中での酵素反応を観察することで1分子レベルの酵素活性を検出します。この方法論は個々のたんぱく質の構造的、機能的ゆらぎの理解などの高精度な生化学研究に活用されてきました。しかしながら、これまでの1分子計測法では、血液のように機能未解明のものを含めて数千種類を超える異なる酵素が含まれるサンプル中で、選択的な酵素活性評価を行うことは困難でした。その理由として、これまでの解析法では、マイクロチップ内の個々の反応容器にどのような酵素が導入されているかが分からず、類似の活性を持つ酵素を見分けられないという問題がありました。小松特任助教、渡邉主任研究者らの研究グループは、科学技術振興機構「さきがけネットワーク」事業などの支援を受け、異分野技術の融合によってこの問題を解決することを目指し、個々の酵素が持つ活性の違いを見分けることによって、反応容器内の酵素の種類を区別するというアイデアを考案し、複数の異なる色の有機小分子蛍光プローブ(酵素の活性を蛍光シグナルの増大によって検出する機能性有機小分子)を用いて、これらの活性の違いをパラメーター化することで分離検出を行う方法論を確立しました(図1)。これにより、血液中に存在する多様な酵素の働きを1分子レベルで理解することが世界で初めて可能となり、これに基づくバイオマーカーの探索や利用への端緒が拓かれました。現在、酵素活性に基づくたんぱく質探索(enzymomics)注3)の研究手法においては、1ピコグラム(分子数に換算すると1千万分子を超える)以下のごく微少量のたんぱく質を検出することは困難でしたが、本手法によって1分子レベルの酵素活性検出による探索研究が可能となることで、これまでの技術の感度では見いだせなかった新たなバイオマーカーの発見の端緒となることが期待されます。
本研究では、肝臓障害と関わるアルカリホスファターゼ(ALP)をはじめさまざまな疾患の進行に伴って血液中の酵素活性が変化することが知られているリン酸エステル加水分解酵素注4)に着目し、この活性を網羅的に1分子検出する実験系を開発しました。ALPは、由来組織に応じて異なるサブタイプが血液中に放出されますが、従来の酵素活性検出による診断ではこれらを区別して検出できませんでした。特に、血液中で観察される代表的なサブタイプである臓器非特異的ALP(TNAP)、小腸型ALP(ALPI)は、その配列相同性が50~60パーセント程度と高く、これを本手法によって区別して1分子検出することを第一の技術目標として設定しました。そして、3色の異なる波長を持つ蛍光色素を合成し、ALPとの反応性を示しながらも異なる構造を持つ蛍光プローブ群を開発し、これらのプローブを組み合わせることで、サブタイプのわずかな反応性の違いを見分けて検出可能であることが確かめられました(図2)。これらの酵素の1分子レベルの検出を血液中で実現したのは世界で初めてのことです。解析の結果、血液中に存在するこれらの酵素の構造的特徴が、大腸菌などによって人工的に作られた酵素の構造的特徴とは大きく異なることも明らかになりました(図3)。
そして、この高感度検出系を用いることで、従来の解析では検出されないレベルで血液中に存在するさまざまなリン酸エステル加水分解酵素の活性を発見し、これらのパターンの違いを多変量解析によって分類する技術プラットフォームを確立しました。これを用いて糖尿病患者血清中のリン酸エステル加水分解酵素の網羅的1分子解析を行ったところ、ALPIの活性が糖尿病患者血清において増大している様子が観察されました(図4)。
さらに、この技術プラットフォームの拡充を目指し、名古屋市立大学の中川教授らの研究グループと共同で、より多様な酵素群の活性を検出する蛍光プローブ群を開発し、ENPP(ectonucleotide pyrophosphatase/phosphodiesterase)注5)と呼ばれる酵素群の活性を1分子レベルで検出する方法へと発展させました。国立がんセンター研究所の本田部門長らの研究グループと共同し、膵臓がん患者由来の血漿サンプル中からこれらの酵素を検出する実験を行ったところ、ENPPのサブタイプの1つであるENPP3の発現量が、がん患者由来の血漿サンプルにおいて有意に向上していることが見いだされました(図5)。これまでに本たんぱく質の存在が血液中で検出された報告はなく、本研究によって初めて発見された新規のバイオマーカー候補として、さらなる検証と応用を目指した研究を進めていく予定です。
本研究成果は、「たんぱく質の機能を1分子レベルで見分けることによって個別に『数える』」という概念と方法論を世界に先駆けて発表した点で大きな意義があります。本手法は、これまで開発されてきたさまざまな網羅的探索系と並び、疾患の実態を反映する疾患関連酵素の発見を支える新たな基盤技術として発展していくことが期待されるものです。
既存の臨床検査技術では1千万分子程度を解析できる技術でありましたが、今回の革新的な技術開発によって理論的には1分子の酵素活性を解析することができるようになり、解析感度が飛躍的に増大しました。
また、今回、膵臓がん患者血漿中での活性異常が見られたENPP3は、これまで血中でその存在が確認されておらず、疾患との関連がほとんど研究されていなかった酵素です。AMED次世代がん医療創生研究事業の研究班の支援として国立がん研究センターとの共同研究でその活性が確認されました。今後は、見いだされた酵素の機能と疾患の関わりを探るとともに、今回開発された高感度解析法を駆使することで、さらなる革新的なバイオマーカーの探索と、確度の高い診断技術の開発を進め、疾患の早期診断を可能とする新たな診断プラットフォームの確立を目指します。
<参考図>
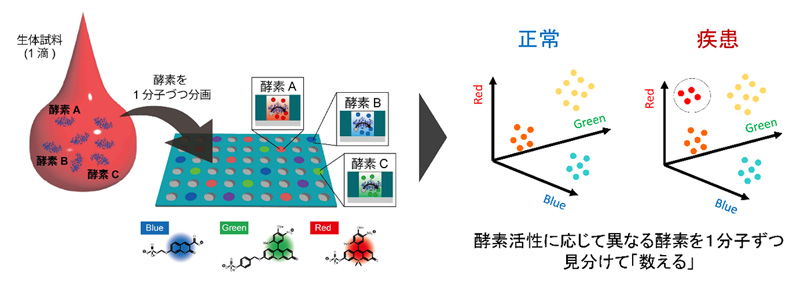
図1 本実験系(Single-molecule enzyme activity-based protein profiling;SEAP)の概念図
(左)マイクロチップ中に1分子ごとに封入される酵素の活性を3色の蛍光プローブによって検出することで、その反応性の違いから含まれる酵素種の違いを見分けることができる。
(右)活性に応じて酵素を「数える」方法論の模式図。これによって、疾患時、正常時に異なる酵素活性のパターンを容易に見つけることが可能となる。
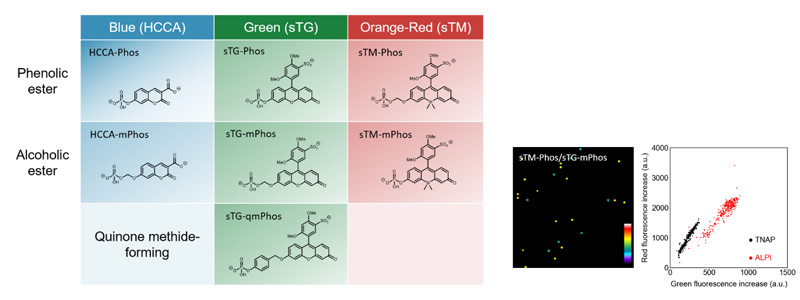
図2
(左)開発したALPプローブ群。青色、緑色、赤色の3色の蛍光を示す蛍光物質を基に、異なるリン酸エステル加水分解酵素への反応性を持つ官能基を結合させた。
(右)TNAP、ALPIの個別検出。個々の反応容器内に含まれるTNAP、ALPIを、それぞれのプローブとの反応性の違いによって見分けることができた(青色がTNAP、黄色がALPI)。
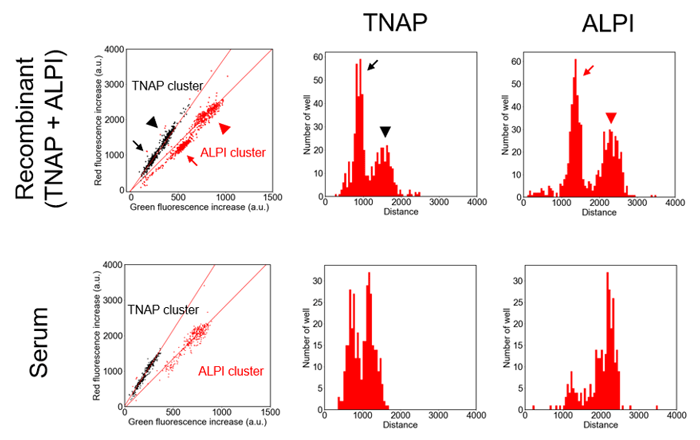
図3
人工的に作られた酵素(上)と血清中(下)におけるエステル加水分解酵素(TNAP、ALPI)の1分子レベルの構造的特徴の違い。矢印(→)が単量体、矢頭(▲)が二量体の状態にある酵素に相当し、両者の比率が由来によって大きく異なることが明らかになった。
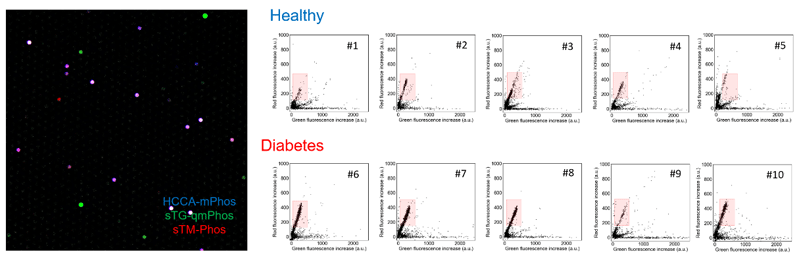
図4 糖尿病患者血清中のリン酸エステル加水分解酵素群の1分子活性検出
(左)3色の蛍光プローブを用いた計測におけるマイクロチップの蛍光像。各反応容器の色は3色の蛍光像の重ね合わせ。
(右)糖尿病患者の血清における活性の検出。赤枠で囲った部分の酵素の数を数えると、糖尿病患者のグループでALPIに相当する酵素が増えている様子が観察された。
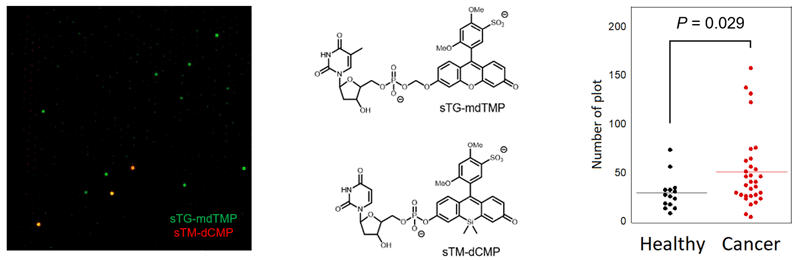
図5 膵臓がん患者血漿中のENPP活性の1分子活性検出
(左)2色の蛍光プローブを用いた計測におけるマイクロチップの蛍光像。
(中央)蛍光プローブの分子構造。
(右)膵臓がん患者由来血漿、健常人血漿におけるENPP3活性の違いの検出。
<用語解説>
注1)バイオマーカー
- 疾患の発見や治療の効果を知るための指標となる生体分子。血液、尿などの体液中で検出されるものが主に用いられ、診断、治療方針の決定に役立てられる。
注2)1分子計測技術
- 高感度な測定系を用いてたんぱく質、核酸などの分子の挙動を1分子ごとに解析する方法論。1990年代にエバネッセント場を利用した1分子観察用の蛍光顕微鏡が開発されるなどの技術開発が進み、さまざまな分子の挙動を分子レベルで開発する方法論が確立されてきた。
注3)酵素活性に基づくたんぱく質探索(enzymomics)
- たんぱく質の機能は、生体内のさまざまな要因によって動的に制御されていることを受けて、機能レベルの網羅的理解から、特に疾患と関わるたんぱく質の機能異常を見いだすことを目指す研究。
注4)リン酸エステル加水分解酵素
- 生体内に存在するさまざまなリン酸エステル構造を加水分解する活性を持つ酵素。代表的なものに、血中のバイオマーカーとして用いられるアルカリホスファターゼ(ALP)、酸性ホスファターゼや、たんぱく質の翻訳後修飾を制御し、その機能を制御するたんぱく質リン酸エステル加水分解酵素(EGF受容体などのチロシンホスファターゼを含む)などが存在する。
注5)ENPP(ectonucleotide pyrophosphatase/phosphodiesterase)
- 細胞外の核酸や脂質の代謝に関わる酵素群で、現在までにENPP1-7までのサブタイプの存在が知られている。ENPP2はオートタキシンとも呼ばれ、細胞遊走などの生命現象や疾患との関係も多く知られているが、他のサブタイプの機能の多くは分かっていない。
<論文タイトル>
“Multiplexed single-molecule enzyme activity analysis for counting disease-related proteins in biological samples”
- 著者名:Shingo Sakamoto, Toru Komatsu*, Rikiya Watanabe*, Yi Zhang, Taiki Inoue, Mitsuyasu Kawaguchi, Hidehiko Nakagawa, Takaaki Ueno, Takuji Okusaka, Kazufumi Honda, Hiroyuki Noji*, and Yasuteru Urano*
- DOI:10.1126/sciadv.aay0888
<お問い合わせ先>
<研究内容に関すること>
小松 徹(コマツ トオル)
東京大学 大学院薬学系研究科 薬品代謝化学教室 特任助教
渡邉 力也(ワタナベ リキヤ)
理化学研究所 開拓研究本部 渡邉分子生理学研究室 主任研究員
中川 秀彦(ナカガワ ヒデヒコ)
名古屋市立大学 大学院薬学研究科 創薬生命科学専攻 医薬化学講座 薬化学分野 教授
本田 一文(ホンダ カズフミ)
国立がん研究センター 研究所 早期診断バイオマーカー開発部門 部門長
野地 博行(ノジ ヒロユキ)
東京大学 大学院工学系研究科 教授
浦野 泰照(ウラノ ヤステル)
東京大学 大学院薬学系研究科 薬品代謝化学教室 教授
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
<報道担当>
科学技術振興機構 広報課