2018-04-18 東京大学,自然科学研究機構 生理学研究所,科学技術振興機構(JST)
ポイント
- てんかんの原因となる分子LGI1とその受容体であるADAM22が結合した状態のタンパク質立体構造を決定することで、LGI1を介してADAM22ファミリーのタンパク質が神経細胞間の橋渡しをする様子を明らかにしました。
- これまでに知られていたLGI1の変異の中で発症の仕組みが不明であった変異に関して、新たな発症の仕組みを明らかにしました。
- 本成果は、てんかん病態とそれに関連する神経活動の分子機構に関わる今後の研究に役立つ知見になると期待されます。
東京大学 定量生命科学研究所(白髭 克彦 所長)の深井 周也 准教授と山形 敦史 助教、自然科学研究機構 生理学研究所の深田 正紀 教授の共同研究グループは、てんかんの原因となる分子LGI1注1)とその受容体であるADAM22注2)が結合した状態の立体構造を決定し、変異マウスを用いた実験を行うことで、発症原因が不明であったLGI1の変異に関して、新たな発症の仕組みを明らかにしました(図1)。遺伝性てんかんの1つである常染色体優性外側側頭葉てんかん(Autosomal Dominant Lateral Temporal Lobe Epilepsy:ADLTE)の原因となる分子LGI1は、神経細胞が分泌するタンパク質の1つで、ADAM22ファミリーのタンパク質(ADAM22、ADAM23、ADAM11)と結合して機能することが知られています。自然科学研究機構 生理学研究所の深田 正紀 教授らのグループは、LGI1の変異が分泌不全あるいはADAM22ファミリーとの結合の異常を引き起こすことで、てんかんの発症につながることを明らかにしてきました。しかし、本病態の全容解明に必要なLGI1–ADAM22複合体の分子構造基盤は明らかになっていませんでした。今回、深井准教授らの研究グループは、LGI1とADAM22が結合した状態のタンパク質立体構造(図2)をX線結晶構造解析注3)、低温電子顕微鏡注4)、X線小角散乱注5)や多角度光散乱注6)を組み合わせて解析することによって、LGI1同士の結合を介してADAM22ファミリーのタンパク質が神経細胞間の橋渡しをする様子を明らかにしました。さらに、ヒトてんかん変異を有するてんかんモデルマウスでは、この神経細胞間の橋渡しが破綻していることを明らかにしました。本成果は、てんかん病態とそれに関連する神経活動の分子機構に関わる今後の研究に役立つ知見になると期待されます。
本研究成果は2018年4月18日(水)午前10時(英国時間)に英国科学雑誌「Nature Communications」に公開される予定です。
本成果は、科学技術振興機構(JST) 戦略的創造研究推進事業チーム型研究(CREST)「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域(田中 啓二 研究総括)における研究課題「シナプス形成を誘導する膜受容体複合体と下流シグナルの構造生命科学」(研究代表者:深井 周也)の一環として行われました。また、本研究は、創薬等ライフサイエンス研究支援基盤事業(創薬等支援技術基盤プラットフォーム事業)、文部科学省 科学研究費補助金 若手研究(B)、特別研究員奨励費、基盤研究(B)、新学術領域研究、精神・神経疾患研究開発費、てんかん治療研究振興財団、加藤記念バイオサイエンス振興財団、武田科学振興財団、堀科学芸術振興財団の支援により行われました。
てんかんは、人口の1%程度に発症する頻度の高い神経疾患であり、反復性のけいれんや時には意識消失を伴います。神経細胞が分泌するタンパク質の1つであるLGI1の遺伝子異常は、遺伝性てんかんの1つである常染色体優性外側側頭葉てんかん(Autosomal Dominant Lateral Temporal Lobe Epilepsy:ADLTE)の原因となることが知られており、タンパク質の折り畳み異常による分泌不全や受容体であるADAM22との相互作用の欠失がてんかん発症の仕組みとして明らかになっていました。しかし、てんかん病態の全容解明に必要なLGI1–ADAM22複合体の分子構造基盤は明らかになっていませんでした。
深井准教授らの研究グループは、LGI1とADAM22が結合した複合体の結晶を作製し、大型放射光施設SPring-8(兵庫県佐用郡)の高輝度X線を利用したX線結晶構造解析により、LGI1–ADAM22複合体の立体構造を決定しました。2つのLGI1分子と2つのADAM22分子で構成された複合体の立体構造は、LGI1とADAM22との選択的な相互作用の詳細を明らかにすると同時に、LGI1同士の相互作用を介してADAM22ファミリーのタンパク質が神経細胞間の橋渡しをすることを示唆していました。低温電子顕微鏡やX線小角散乱、多角度光散乱を用いた解析では、3つのLGI1分子と3つのADAM22分子で構成された複合体も存在することを示唆していましたが、いずれの複合体においてもLGI1同士の相互作用を介した橋渡しが行われていました。さらに、精製タンパク質を用いた多角度光散乱解析と変異マウスを用いた生化学実験により、LGI1同士の相互作用に異常を引きおこすヒトLGI1変異を見いだしました。LGI1同士の相互作用の異常によるてんかん発症の仕組みは、これまでに知られていなかった新たな知見です。
これまで知られているヒトのてんかん原因遺伝子の多くは神経細胞間の情報伝達(シナプス伝達)を直接担うイオンチャネルタンパク質でした。そのため、現在使用されている抗てんかん薬の多くはイオンチャネルを標的として開発されてきました。しかし、一部のてんかん症例ではこれら薬剤だけではコントロールが難しい場合もあり、新たな治療戦略が求められています。深田教授らのグループは、LGI1の折り畳み異常に対して、ケミカルシャペロンと呼ばれるタンパク質の折り畳みを助ける薬剤の投与によって、モデルマウスのてんかん症状が改善することを以前に報告しています。今回、LGI1を原因とするてんかん発症の新たな仕組みがわかったことで、この仕組みに対して働く別の薬剤が症状の改善に役立つ可能性が出てきました。
![]()
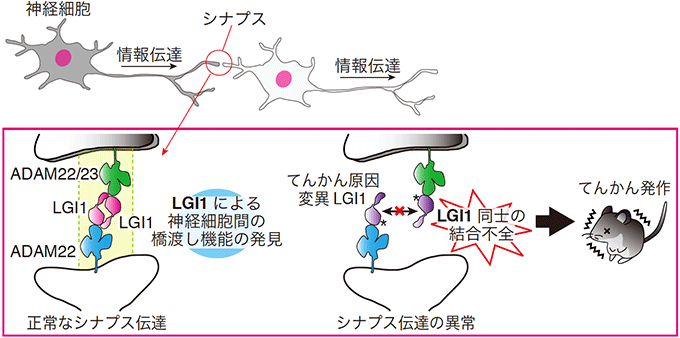
図1 LGI1-ADAM22によるシナプス伝達制御とLGI1変異によるてんかんの発症機構
LGI1-ADAM22複合体のX線結晶構造解析を基に、2つのLGI1分子がADAM22ファミリータンパク質との結合を介して、神経細胞間の橋渡しをすることみいだしました(左)。また、LGI1変異(ヒトてんかんモデル)マウスを使った検討により、LGI1同士の結合不全は神経細胞間の橋渡しを破綻させ、てんかんを誘発することが新たに分かりました(右)。
![]()
図2 LGI1–ADAM22複合体の立体構造
- a.X線結晶構造解析で決定した二分子のLGI1と二分子のADAM22が結合した複合体の立体構造
- b.aに示した立体構造で明らかになったLGI1とADAM22およびLGI1同士の相互作用インターフェースと、低温電子顕微鏡(c)とX線小角散乱(d)からの構造情報を元にして推測した三分子のLGI1と三分子のADAM22が結合した複合体の立体構造
- 注1)LGI1
- 神経細胞から放出される分泌タンパク質。常染色体優性外側側頭葉てんかんの原因遺伝子産物の1つであり、ADAM22ファミリーのタンパク質のリガンドとして働くことが知られている。
- 注2)ADAM22ファミリー
- 分泌型あるいは膜結合型の金属プロテアーゼファミリー(ADAMファミリー)の1つ。ADAM22ファミリーは、ADAM22、ADAM23、ADAM11の3種類のタンパク質を含み、いずれもプロテアーゼとしての活性は持たず、受容体分子としての役割を担う。
- 注3)X線結晶構造解析
- 分子の三次元構造を高分解能で決定する手法の1つ。分子が規則正しく並んだ結晶にX線を照射すると回折という現象が起きる。回折データを解析することで、結晶を構成する分子の構造を原子レベルで決定することができる。
- 注4)低温電子顕微鏡
- 液体窒素温度下での電子顕微鏡法。氷に包埋した試料を透過電子顕微鏡で観察して得られる大量の投影像から立体構造を計算により求めることが可能である。近年の技術革新により、条件が揃えば分子の三次元構造を原子レベルで決定することも可能になった。
- 注5)X線小角散乱
- 散乱角が小さな散乱X線を観測することにより、数ナノから数百ナノメートルレベル(1ナノメートルは1ミリメートルの100万分の1)の構造情報を得る手法。分析対象となる試料は、ポリマー・液晶・合金などの無機・有機材料からタンパク質や核酸などの生体分子まで幅広い。生体分子の大きな構造変化や会合(集合)状態を分析するのに適している。
- 注6)多角度光散乱
- 散乱角の異なる複数の散乱光の強度から高分子試料の分子量を求める手法。光源には可視光レーザーが利用される。分子量から生体高分子の会合(集合)状態を推定することができる。
タイトル:“Structural basis of epilepsy-related ligand–receptor complex LGI1–ADAM22”
著者名:Atsushi Yamagata, Yuri Miyazaki, Norihiko Yokoi, Hideki Shigematsu, Yusuke Sato, Sakurako Goto-Ito, Asami Maeda, Teppei Goto, Makoto Sanbo, Masumi Hirabayashi, Mikako Shirouzu, Yuko Fukata, Masaki Fukata & Shuya Fukai
doi:10.1038/s41467-018-03947-w
<研究に関すること>
深井 周也(フカイ シュウヤ)
東京大学 定量生命科学研究所 准教授
深田 正紀(フカタ マサキ)
自然科学研究機構 生理学研究所 教授
川口 哲(かわぐち てつ)
科学技術振興機構 戦略研究推進部
<報道担当>
黒野 優菜(クロノ ユウナ)
東京大学 定量生命科学研究所 事務部 総務チーム
自然科学研究機構 生理学研究所 研究力強化戦略室
科学技術振興機構 広報課