汎用性T細胞製剤の臨床応用に向けて一歩前進
2020-04-15 京都大学
河本宏 ウイルス・再生医科学研究所教授らの研究グループは、嘉島相輝 医学部附属病院助教(現・秋田大学医学部附属病院助教)らと共同で、患者のがん組織を移植したマウスモデルを用いて、ヒトiPS細胞から再生した汎用性の高いキラーT細胞が、固形がんの一種である腎がんに効果があることを示しました。
これまでに、T細胞を患者から採取して、遺伝子を操作した上で患者に戻す方法が、がんの治療に有効であることが示されてきました。しかし、そのような自家移植で行う治療法は、コストが高く、時間がかかり、T細胞の品質が不安定であるなどの問題がありました。
本研究グループは、この問題を解決するためiPS細胞技術を使用し、他家移植用iPS細胞に臨床試験済みのT細胞レセプター遺伝子を導入し、そのiPS細胞からWT1抗原(がん抗原の一種)を認識できる再生キラーT細胞を再生しました。そして、その効果を検証する固形がんモデルとして、腎がんを対象としました。腎がん患者2人から、それぞれWT1抗原陽性と陰性の腫瘍組織を採取し、免疫不全マウスの背中にどちらも移植しました。このマウスに上記の再生キラーT細胞を投与した結果、WT1抗原陽性腫瘍の方で増大を抑制することが確認できました。
本研究成果は、固形がんを対象として他家移植用の再生キラーT細胞を用いるがん治療戦略を、臨床応用に向けて大きく前進させるものと考えられます。
本研究成果は、2020年4月7日に、国際学術誌「iScience」のオンライン版に掲載されました。
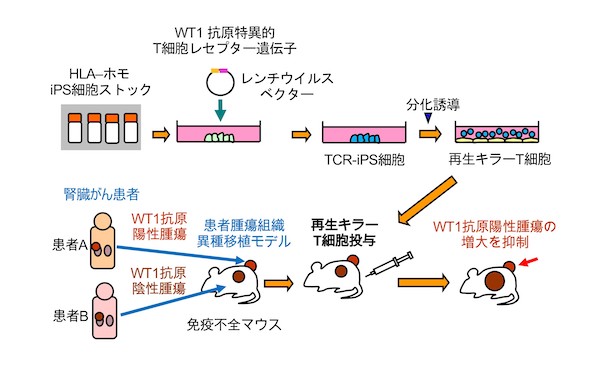
図:本研究の概要図
書誌情報
【DOI】 https://doi.org/10.1016/j.isci.2020.100998
【KURENAIアクセスURL】 http://hdl.handle.net/2433/250312
Soki Kashima, Takuya Maeda, Kyoko Masuda, Seiji Nagano, Takamitsu Inoue, Masashi Takeda, Yuka Kono, Takashi Kobayashi, Shigeyoshi Saito, Takahiro Higuchi, Hiroshi Ichise, Yuka Kobayashi, Keiko Iwaisako, Koji Terada, Yasutoshi Agata, Kazuyuki Numakura, Mitsuru Saito, Shintaro Narita, Masaki Yasukawa, Osamu Ogawa, Tomonori Habuchi, Hiroshi Kawamoto (2020). Cytotoxic T Lymphocytes Regenerated from iPS Cells Have Therapeutic Efficacy in a Patient-Derived Xenograft Solid Tumor Model. iScience.
詳しい研究内容について
—汎用性 T 細胞製剤の臨床応用に向けて一歩前進— 概要
これまでに、T 細胞を患者から採取して、遺伝子を操作した上で患者に戻す方法が、がんの治療に有効であることが示されてきました。しかし、そのような自家移植で行う治療法は、コストがかかる、時間がかかる、患者の T 細胞の質に依存するので投与する T 細胞の品質が不安定、などの問題がありました。
京都大学ウイルス・再生医科学研究所 河本宏 教授らのグループは、iPS 細胞技術を用いて T 細胞を量産することにより、上記の問題の解決に取り組んできました。今回は、京都大学医学部附属病院泌尿器科 嘉島相輝 助教(研究当時、現秋田大学医学部附属病院腎泌尿器科助教)らとの共同研究で、二つの新しいことに取り組みました。一つは、iPS 細胞に T 細胞レセプター遺伝子を導入するという方法の採用で、もう一つは、固形がんを対象とすることです。この方法を用いて再生したキラーT 細胞は、患者由来腎細胞がん組織を移植して作製したモデルで、治療効果を発揮しました。今回の成果は、他家移植用の再生キラーT 細胞を用いたがん治療戦略を、固形がんを対象にした臨床応用に向けて、大きく前進させるものと考えられます。
本研究成果は、2020 年 4 月 7 日に米国の科学雑誌「iScience」のオンライン版に掲載されました。
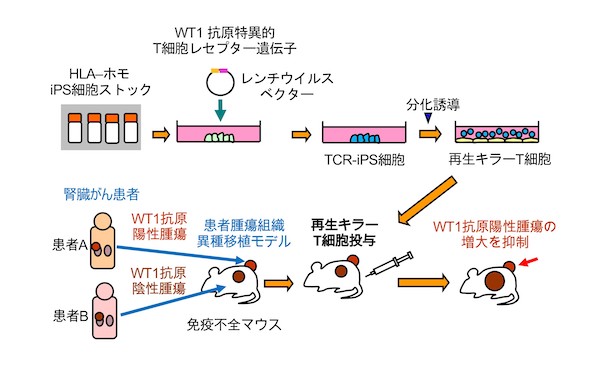
図1 今回の成果の概要:再生キラーT 細胞の有効性を患者由来固形がんモデルで実証京都大学 iPS 細胞研究センターが他家移植用再生組織の材料として配布している HLA ハプロタイプホモ型の iPS 細胞に、WT1 抗原を認識できる T 細胞レセプター遺伝子を強制発現させた。この WT1 抗原特異的 T 細胞レセプター遺伝子は、患者由来 T 細胞に T 細胞レセプター遺伝子を導入するという方法により臨床試験で使われてきており、すでに効果が確認されているものである。その iPS 細胞からキラーT 細胞を再生した。腎がん患者 2 人から、それぞれ WT1 抗原陽性と陰性の腫瘍組織を採取し、免疫不全マウスの背中にどちらも移植した。このマウスに再生したキラーT 細胞を投与すると、WT1 抗原陽性腫瘍の方では増大を抑制することができた。
本研究成果のポイント
● 他家移植用 iPS 細胞に臨床試験済みの T 細胞レセプター遺伝子を導入
● その iPS 細胞から WT1 抗原を認識できる再生キラーT 細胞を再生
● 免疫不全マウスを用いたヒト患者由来腎がんモデルで治療効果を確認
● 再生キラーT 細胞を用いた免疫細胞療法の臨床応用に向けて一歩前進
1. 背景
抗 PD-1 抗体や抗 CTLA-4 抗体などの免疫チェックポイント阻害剤*1 が一部のがんに奏効することは、がん患者の体の中にはがん細胞を殺す力を有しているキラーT 細胞*2 が存在していることを示しています。 実際に、これまでに、T 細胞を患者から採取して、遺伝子を操作した上で患者に戻す方法(養子免疫療法*3)が、がんの治療に有効であることが示されてきました。しかし、そのような自家移植で行う治療法は、コストがかかる、時間がかかる、患者の T 細胞の質に依存するので投与する T 細胞の品質が不安定、などの問題がありました。
私達のグループは、この問題を解析するために、iPS 細胞技術を用いようと考えました。T 細胞は、T 細胞レセプター*4 を細胞表面に出していて、このレセプターを使って標的になる分子を認識します。この T 細胞レセプターは、「 遺伝子再構成*5」とよばれる仕組みによって作り出された遺伝子からつくられます。がん細胞に特有の抗原(がん抗原)を認識できる T 細胞レセプターを有する T 細胞から iPS 細胞を作製すると、その iPS 細胞には再構成された T 細胞レセプター遺伝子の構造が受け継がれます(図2)。その iPS 細胞から T 細胞を再生すると、がん抗原を認識できる T 細胞だけをつくることができるというアイデアです。この方法では新鮮で元気な T 細胞を必要なだけつくることができます。
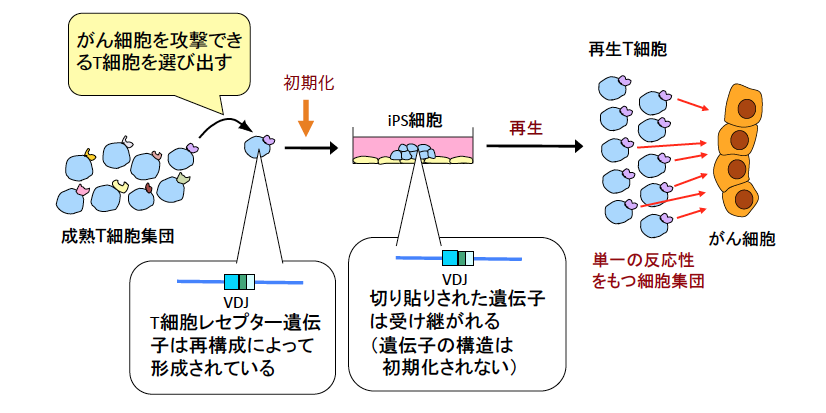
図2 iPS 細胞技術を用いて T 細胞を再生する戦略のコンセプト
がん細胞を攻撃できるキラーT 細胞から iPS 細胞を作製すると、T 細胞レセプター遺伝子は再構成されているので、その構造は iPS 細胞化しても受け継がれる。そのため、その iPS 細胞から T 細胞を再生すると、全てが同じ反応性をもつことになる。
このアイデアに基づいて、2013 年に、世界で初めてがん抗原に反応するヒトのキラーT 細胞の再生に成功し、論文発表しました(Cell Stem Cell, 12:31, 2013)。この論文では、悪性黒色腫に特有のがん抗原である MART-1 抗原を標的にしました。しかし、この時点での技術では、再生したキラーT 細胞の品質はあまりよくありませんでした。
そこで、この問題を解決するため、2016 年に、培養法の改良を行いました。新しい培養法によって、高品質なキラーT 細胞が効率よく誘導できることがわかりました。さらにこの方法を、WT1 抗原*6 というがん抗原に応用しました(Cancer Research, 76:6839, 2016)。再生キラーT 細胞は WT1 抗原を有している白血病細胞株を効率よく殺傷しました。また、ヒト白血病細胞を免疫不全マウス*7 に注入して作製する白血病モデルを用いた実験で、再生キラーT 細胞を投与することにより、治療効果がみられました(図3)。
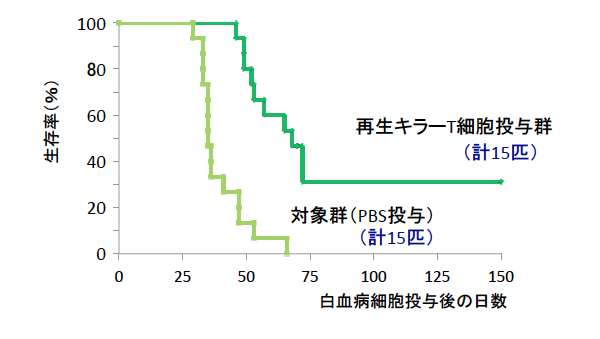
図3 WT1 抗原特異的再生キラーT 細胞は白血病モデルマウスで治療効果を認めた
免疫不全マウスに WT1 抗原を発現するヒト白血病細胞を2x104 個腹腔内に播種した。翌日から 1 週間ごとに計 4 回再生キラーT 細胞5x106個をリン酸緩衝生理食塩水(PBS)に懸濁して腹腔内投与した(Cancer Research, 2016)。
2. 研究手法と成果
ここまでは T 細胞から iPS 細胞を作製する方法( T-iPS 細胞法)を書いてきましたが、今回は、異なる方法を用いました。iPS 細胞に外来の TCR 遺伝子を導入するという方法です(TCR-iPS 細胞法)(図4)。この方法は 2014 年に出願し*8、最近、欧州で特許査定を受けました。この方法を他家移植の系で使えば、再生 T 細胞を用いる戦略の汎用性が格段に高くなると考えています。それは、1)すでに効果や安全性が確かめられた TCR 遺伝子を用いる事ができる、2)他家移植用の iPS 細胞を用いる事ができる、という 2 つの理由からです。
他家移植用の iPS 細胞としては、京都大学 iPS 細胞研究所が作製している HLA*9 ハプロタイプホモ(HLA ホモ)の iPS 細胞ストックを用いることにしました。HLA ホモ iPS 細胞から再生した組織や細胞は、同じ HLA ハプロタイプをヘテロで有する患者に移植した時に免疫拒絶が起こりにくいと期待できます。現在頻度の高い順に上位4種類の株が入手可能で、この4種類で日本人の 35%をカバーできます。
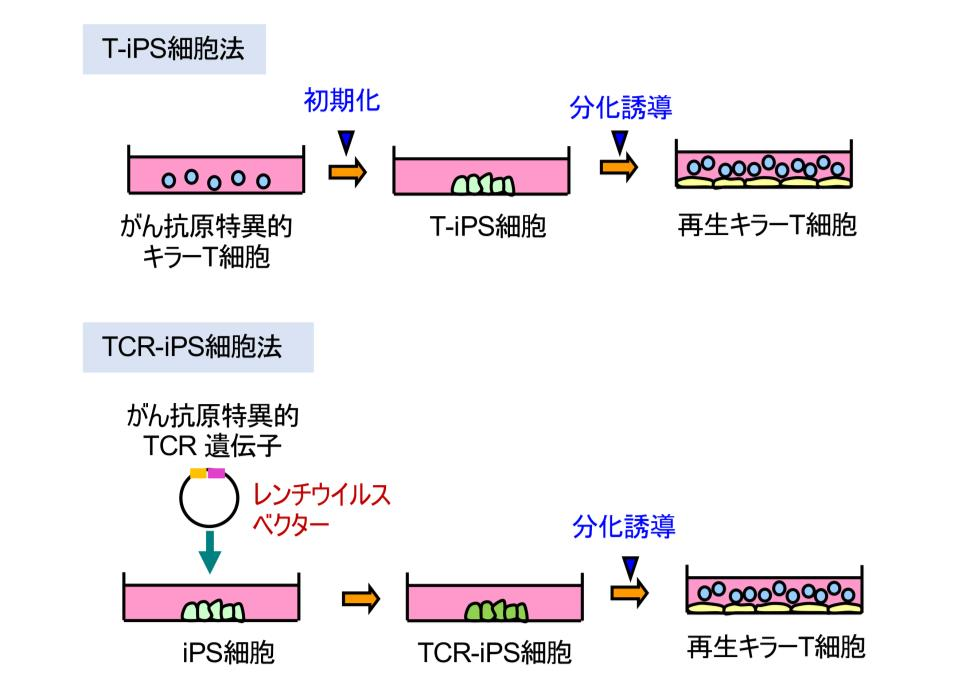
図4 TCR-iPS細胞を用いる戦略
上段にはT細胞からiPS細胞を作製する方法(T-iPS細胞法)、下段にはiPS細胞にTCR遺伝子を導入する方法(TCR-iPS細胞法)を示す。TCR-iPS細胞法ではiPS細胞ストックを母体となるiPS細胞として使用する。このiPS細胞ストックに、安全性と有効性が認められているがん抗原特異的TCR遺伝子を導入する事により、TCR-iPS細胞を作製する。
今回の研究では、まず iPS 細胞研究所から入手した最も頻度の高い HLA ホモ iPS 細胞株に、レンチウイルスを用いて WT1-TCR 遺伝子( TAK1)を導入しました( WT1-TCR-iPS 細胞)( 図5A)。WT1-TCR 遺伝子は安川( 愛媛大学)らが樹立した TAK1 というキラーT 細胞クローンから単離された TCR で、この TCR を用いた TCR 遺伝子導入療法の臨床試験が急性白血病あるいは骨髄異形成症候群に対して行われ、一定の治療効果が報告されています(Blood, 130:1985, 2017)。
この WT1-TCR-iPS 細胞を OP9 細胞、引き続いて OP9/DLL1 細胞と共培養すると、35 日目には CD4CD8 共陽性細胞( DP 細胞)が生成しました( 図5B)。磁気ビーズを用いて DP 細胞を単離し、WT1 ペプチドを負荷した抗原提示細胞( B リンパ芽球様細胞株)を用いて刺激を入れると、キラーT 細胞が生成しました。生成したキラーT 細胞は、CD8αβヘテロダイマーを発現する CD8T 細胞で、ほぼ全てが WT1 テトラマーに反応する TCR を発現していました(図5C)。
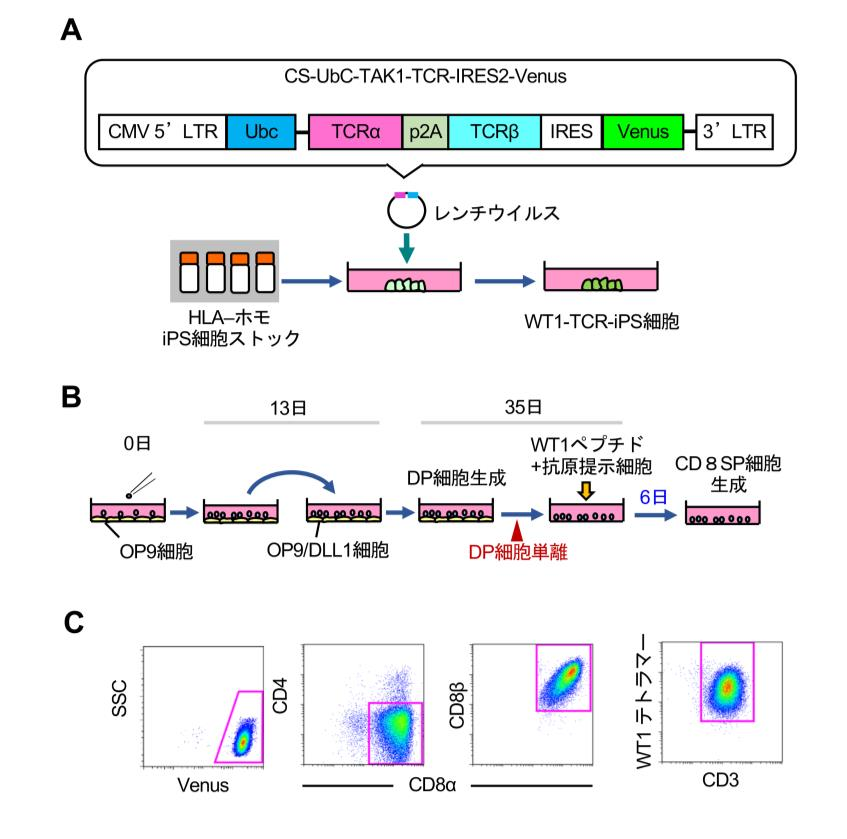
図5 WT1特異的TCRを導入したiPS細胞からキラーT細胞を再生
A. WT1-TCR-iPS 細胞の作製。iPS 細胞研究所が作製した HLA ホモ iPS 細胞に、レンチイルスを用いて WT1-TCR 遺伝子を導入した。TCR-iPS 細胞の材料として用いた TCR としては、愛媛大学の安川らが単離した TCR 遺伝子(TAK1)を用いた。
B. 再生 T 細胞の分化誘導法。iPS 細胞をまずOP9 細胞と、13 日目以後はOP9/DLL1 細胞と共 培 養す る と、35 日 目に は培 養 中にCD4CD8 共陽性細胞 (DP 細胞)が生成する。DP 細胞のみを単離して抗原特異的な刺激を入れると、CD4 陰性 CD8 陽性細胞(CD8SP)細胞が生成する。
C. WT1-TCR-iPS 細胞から再生した T 細胞のプロファイル。CD8αβヘテロダイマーを発現し、ほぼ全てが WT1 テトラマーに反応する TCR を発現している。
今回は、再生 CTL を用いた戦略をより一般化するために、固形がんを対象とした開発研究を行いました。治療モデルとしては、WT1 抗原を発現している腎がんを標的として用いることにしました。腎がんは、悪性黒色腫や非小細胞性肺がんと同様、免疫原性の高いがんとして知られています。固形がんに対象を拡げるに際して、最初の標的疾患として適切であると考えました。
臨床試験に近い条件にするために、細胞株を用いるのではなく、患者腫瘍組織移植モデル(Patient-derived xenograft model:PDX)を用いました。PDX モデルでは患者がん組織が有している不均質性や階層性が維持されているため、元のがん組織の性質に近いと考えられています。この腎がん PDX モデルを用いて、再生キラーT 細胞の治療効果を測定しました。WT1陽性腫瘍組織を免疫不全マウス(NOG マウス)の背中の右側、 WT1 陰性腫瘍組織を左側に皮下移植しました(図6A)。移植1週間後から、再生 CTL107細胞/回を週3回、計 12 回腹腔内投与しました( 図6B)。結果として、治癒にはいたりませんでしたが、腫瘍の増大を抑制する効果を認めました(図6C,D)。
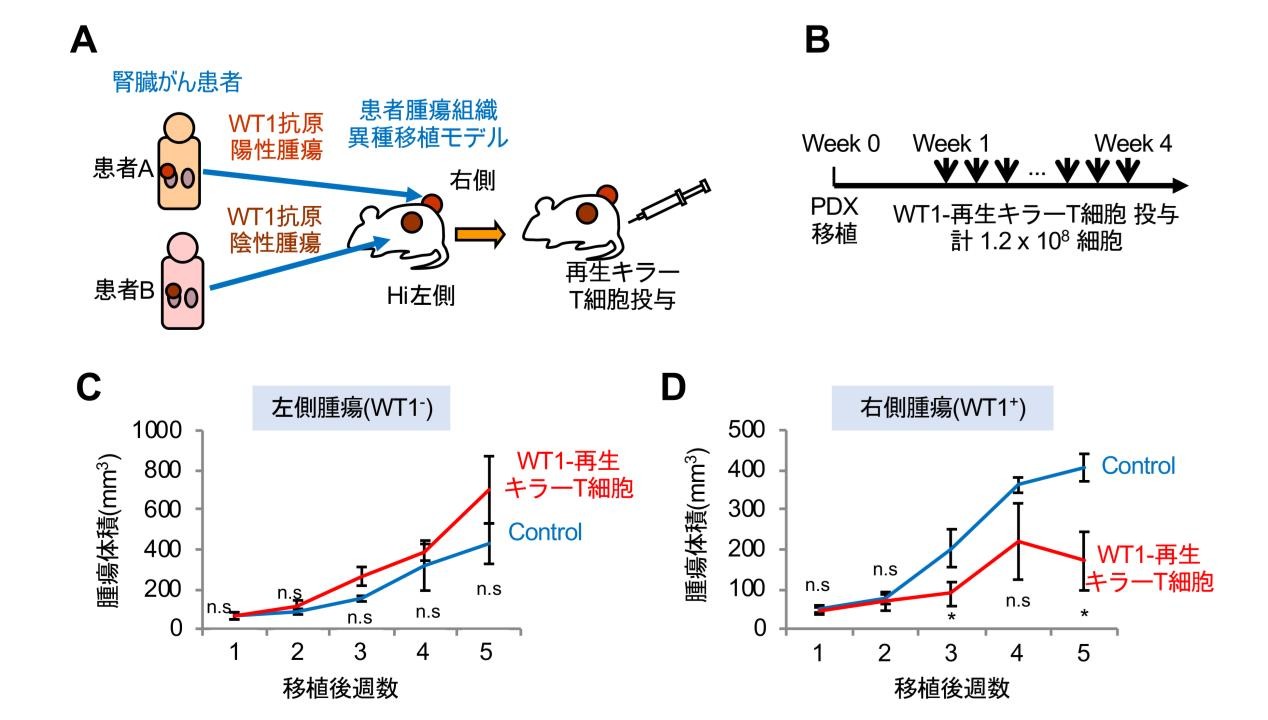
図6 WT1 特異的再生キラーT 細胞は腎がん PDX モデルで治療効果を示した
A. 腎がん PDX(patient-derived xenograft)の作製法。腎がん患者の手術検体の一部を免疫不全マウス(NOG マウス)に移植する。PDX は NOG マウス間で継代して維持する。腎がん PDX を用いた in vivo 治療モデル。異なる患者から作製した 2 種類の PDX を NOG マウスの背中に皮下移植した(WT1 陰性腫瘍:左側、WT1陽性腫瘍:右側)。
B. PDX モデル治療実験プロトコール。PDX 移植1週間後から、1 回につき 107個の再生キラーT 細胞を、週3回、計 12 回、腹腔内投与した。
C. 左側に移植した WT1 陰性腫瘍の増殖曲線。再生キラーT 細胞投与群とコントロール群で、差を認めなかった。
D. 右側に移植した WT1 陽性腫瘍の増殖曲線。治癒には至らなかったが、再生 CTL 投与群で腫瘍の増大を抑制する効果を認めた。(*p < 0.05)
3. 波及効果・今後の予定
この結果により、固形がんに対する TCR-iPS 細胞を用いた筆者らの戦略は、臨床応用に向けて大きく前進したと考えています。
今回開発した方法の将来的な応用法について述べます。
今回、T 細胞の材料として用いたのは HLA を出している iPS 細胞です。型が合う人は 6 人に 1 人しかいません。しかし、将来的には誰にでも使える iPS 細胞が作られると考えられます。
そのような iPS 細胞に、今回のような方法で TCR 遺伝子を導入して、その iPS 細胞から再生 T 細胞を作製すれば、誰にでも使えるがん抗原特異的な T 細胞を作製できると考えています(図7)。
一方、iPS 細胞自体は誰にでも投与することができても、T 細胞レセプターは特定の HLA を持っている人にしか使えません。今回使用した WT1 抗原特異的 T 細胞レセプターは、日本人の 6 割に使えるものです。今後、色々な T 細胞レセプターを用いれば、幅広く多くの人に使えるようになると期待できます。
日本は抗体製剤の開発競争では世界に大きく遅れをとりましたが、私達が進めている再生 T 細胞療法は、現時点では世界をリードしています。今後も日本発のこの技術を発展させ、優位性を保ちたいと考えています。

図7 本研究のゴール:汎用性の高い即納型 T 細胞製剤をがん治療に用いる
汎用性の iPS 細胞を材料にして、TCR-iPS 細胞方を用いて汎用性 T 細胞を量産し、凍結保存しておく。その T 細胞が使える患者がいた時には、解凍して、投与する。ん患者からすると、がんだという診断が下ってすぐに治療を受けることができる。
4. 研究プロジェクトについて
今回の研究成果は、AMED の p-direct 事業、レグセル株式会社、リバーセル株式会社の支援を受けて達成したものです。
<用語解説>
*1 免疫チェックポイント阻害剤
PD1 や CTLA4 などのような免疫を抑制する分子を、抗体を用いて阻害することにより、免疫を活性化させることができる。このような阻害抗体の製剤を免疫チェックポイント阻害剤と呼ぶ。日本では抗 PD1 抗体が悪性黒色腫、肺がんなどに対して承認されている。
*2 キラーT 細胞
ウイルスに感染した細胞やがん細胞を殺すことのできる T 細胞。
*3 養子免疫療法
樹状細胞、T 細胞などの免疫細胞を体外に取り出して一定の処理をしてからがん患者に戻すという治療法。抗原を提示する樹状細胞を取り出してがん抗原を取り込ませてから体に戻す、あるいは腫瘍組織に浸潤している T 細胞を取り出してサイトカインなどを加えて活性化してから体に戻す、などの方法が用いられている。
*4 T 細胞レセプター
T 細胞が抗原を認識するために用いる T 細胞の表面に存在する受容体。受容体とは外界や外部からの何らかの刺激を受け取り、情報として利用できるように変換する仕組みを持った構造のこと。
*5 遺伝子再構成
T 細胞レセプター遺伝子はアルファ鎖とベータ鎖というふたつの分子が会合して構成されている。アルファ鎖は V と J、ベータ鎖は V、D、J の3つの部品を組み合わせて形成される。体細胞のゲノムではこれらの部品の遺伝子が数十種類ずつ離れて並んでいる。T 細胞は分化の過程で、それぞれから 1 個の部品を選び、それらをゲノム上でつなぎ合わせることで、個々の細胞が特異的な T 細胞レセプターの遺伝子を新たに作りだす。この再構成により個々の細胞が異なる形状のレセプター分子を有するようになる。1976 年に利根川進が発見した現象で、利根川はこれにより 1987 年にノーベル医学生理学賞を受賞した。
*6 WT1 抗原
急性骨髄性白血病で高発現しているがん抗原。その他の固形がんでも高発現していることが知られており、がんワクチン療法の対象としてよく用いられている。
*7 免疫不全マウス
通常ヒトの細胞はマウスに移植しても拒絶されるが、T 細胞や B 細胞などの免疫細胞が欠損した免疫不全マウスは、ヒトの細胞を移植することができる。このため、ヒトのがん細胞を用いた生体内での治療効果を判定する実験に用いられる。
*8
「抗原特異的T細胞受容体遺伝子を有する多能性幹細胞の製造方法」WO 2016010154
*9 HLA
ヒトの白血球の血液型にあたる。抗原提示細胞が T 細胞に抗原を提示する機能を有しており、HLA にはクラス I とクラス II の2種類がある。主にクラス I には A、B、C の3種類、クラス II には DR、DQ、DP の 3 種類があり、それぞれについて、人類で数百~千種類ずつの多型性が確認されている。そのため、他人と HLA 型が一致する確率は低い。HLA 型が不一致である他人からの移植では、HLA が標的となることが拒絶反応の主要な要因である。通常、個人では父方由来と母方由来の HLA 型のセットを 2 セット有しており、ひとつのセットをハプロタイプと呼ぶ。父方および母方由来が同じハプロタイプを有する場合を、ホモ接合型と呼び、異なる場合をヘテロ接合型と呼ぶ。京都大学 iPS 細胞研究所が作製している HLA ハプロタイプホモ接合型(HLA ホモ)のドナーから作製した iPS 細胞をストックとして備蓄している。HLA ホモ iPS 細胞から再生した組織や細胞は、同じ HLA ハプロタイプをヘテロで有する患者に移植した時に免疫拒絶が起こりにくいと期待できる。
現在頻度の高い順に上位4種類の株が入手可能で、この4種類で日本人の 35%をカバーできる。
<研究者のコメント>
がん患者の体の中にはがん細胞を殺傷することができるキラーT 細胞が存在します。私達は、iPS 細胞技術を利用してそのようなキラーT 細胞を再生するという研究を世界にさきがけて進めてきました。この戦略の利点は、1種類作ってそれを多くの人に使うという用い方ができることです。今回は、そのような汎用性の高い方法で作製した T 細胞が、固形がんに対して有効であることを示しました。今回用いた患者腫瘍組織異種移植モデルで使われたがん組織は、がん患者のがん組織に類似しており、そのモデルで効果が見られたことから、臨床応用に向けて確実に一歩進んだと考えています。
<論文タイトルと著者>
タイトル: Cytotoxic T lymphocytes regenerated from iPS cells have therapeutic efficacy in a patient-derived xenograft solid tumor model
iPS 細胞から再生したキラーT 細胞が固形がんを用いた患者腫瘍組織異種移植モデルで治療効果を示した
著 者:Soki Kashima1, 2, 3, Takuya Maeda1, Kyoko Masuda1, Seiji Nagano1, Takamitsu Inoue2, Masashi
Takeda3, Yuka Kono1, 3, Takashi Kobayashi3, Shigeyoshi Saito4, Takahiro Higuchi5, Hiroshi Ichise1, Yuka Kobayashi1, Keiko Iwaisako6, Koji Terada , Yasutoshi Agata7, Kazuyuki Numakura , Mitsuru Saito2, Shintaro Narita2, Masaki Yasukawa8, Osamu Ogawa3, Tomonori Habuchi2, Hiroshi Kawamoto *
1Laboratory of Immunology, Institute for Frontier Life and Medical Sciences, Kyoto University
2Department of Urology, Akita University Graduate School of Medicine
3Department of Urology, Kyoto University Graduate School of Medicine
4Department of Medical Physics and Engineering, Division of Health Sciences, Osaka University
5Dentistry and Pharmaceutical Sciences, Okayama University Graduate School of Medicine
6Department of Medical Life Systems, Faculty of Life and Medical Sciences, Doshisha University
7Department of Biochemistry and Molecular Biology, Shiga University of Medical School
8Department of Hematology, Clinical Immunology and Infectious Diseases, Graduate School of Medicine, Ehime University, Ehime
嘉島相輝 1, 2, 3、前田卓也 1、増田喬子 1、永野誠治 1、井上高光 2、武田将司 3、河野有香 1, 3、小林恭
3、齋藤茂芳 4、樋口隆弘 5、一瀬大志 1、小林由佳 1、祝迫恵子 6、寺田晃士 7、縣保年 7、沼倉一幸2、齋藤満 2、成田伸太郎 2、安川正貴 8、小川修 3、羽渕友則 2、河本宏 1
1京都大学 ウイルス・再生医学研究所 再生免疫学分野
2秋田大学 医学部附属病院 腎泌尿器科
3京都大学 医学部附属病院 泌尿器科
4大阪大学 大学院医学系研究科 保健学専攻 医用物理工学講座
5岡山大学 医師薬学総合研究科 分子イメージング国際研究拠点形成プロジェクト
6 同志社大学 生命医科学研究所 医生命システム学科
7 滋賀医科大学 生化学・分子生物学講座
8 愛媛大学 医学部 血液・免疫・感染症内科学
掲 載 誌:iScience DOI:未定