2018-05-04 理化学研究所
理化学研究所(理研)脳神経科学研究センター神経老化制御研究チームの西道隆臣チームリーダー、永田健一研究員らの研究チームは、ゲノム編集技術[1]を駆使した実験により、アルツハイマー病[2]発症の原因となるアミロイドβペプチド(Aβ)[3]の蓄積を抑制する遺伝的な欠失を発見しました(図)。
本研究成果は、ヒト集団での新しい保護的変異[4]同定の土台になるとともに、核酸医薬[5]などの予防的治療法の開発につながると期待できます。
アルツハイマー病は、認知症の半数以上を占める進行性の神経変性疾患[6]です。患者の脳では約40個のアミノ酸からなるAβが凝集・蓄積し、これが疾患発症の引き金となります。これまでのヒト臨床研究から、300を超える遺伝子変異が疾患発症の原因となることが報告されており、同定された遺伝子変異の多くはAβの凝集・蓄積を高める作用を持つと考えられています。一方で、アルツハイマー病の発症リスクを低下させる遺伝子変異はほとんど同定されていませんでした。
今回、研究チームはアルツハイマー病モデルマウスの作製過程で出てきたネガティブデータをヒントに、ゲノム編集技術を駆使して特定の遺伝子領域を700塩基および400塩基欠失させました。脳切片を作製し、定量的に評価したところ、どちらの場合でもモデルマウスの特徴であるAβの蓄積が欠失の程度に依存して低下していました。最終的に、わずか34塩基の配列を欠失させただけでAβの蓄積が抑制されることが明らかになりました。
本研究は、英国のオンライン科学雑誌『Nature Communications』(5月4日付:日本時間5月4日)に掲載されます。
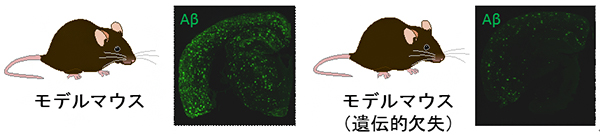
図 アミロイドβペプチド(Aβ)を軽減する遺伝的欠失
背景
アルツハイマー病(Alzheimer’s Disease; AD)は、認知症の半数以上を占める進行性の神経変性疾患です。病状の進行とともに記憶や認知機能が低下し、やがて自立した生活を送ることが困難になります。世界中で疾患克服のための研究が盛んに行われていますが、進行を抑制する治療法はまだ開発されていません。
ADには、割合は少ないながらも遺伝的な素因が強く作用する家族性のADが存在します。ほとんどのADは高齢期に発症しますが、家族性のAD患者では、30代~50代と早期の発症例が多くみられます。
AD患者の脳には、約40個のアミノ酸からなるアミロイドβペプチド(Aβ)が凝集・蓄積した老人斑と呼ばれる特徴的な病理変化が認められます。Aβは「前駆体タンパク質(APP)[7]」から産生されます(図1左)。家族性のAD患者では、APP遺伝子やAPPの切断に関わる遺伝子に変異が認められ、結果として生じるAβの産生増加または凝集性上昇がAD発症の引き金となります(図1右)。1990年前後からの家族性のAD患者の家系に着目した遺伝学的な解析によって、発症原因となる遺伝子変異が300以上見つかっています。
一方、ヒト遺伝情報の大規模解析によって、Aβの産生を減らし発症リスクを軽減する保護的変異が2012年に同定されています注1)。保護的変異は未発症者のリスク評価の改善、さらには新しい治療法の開発につながる可能性があるため、より多くの同定が望まれています。
注1)Jonsson T, et.al. Thorsteinsdottir U, Watts RJ, Stefansson K. A mutation in APP protects against Alzheimer’s disease and age-related cognitive decline.Nature, 488, 96-99 (2012).
研究手法と成果
西道隆臣チームリーダーらは2014年、遺伝子ノックイン技法[8]により次世代型ADモデルマウスの作製に成功しました注2)。従来型のADモデルマウスには、外来遺伝子が過剰に発現するためヒト患者脳との類似性に乏しい、原因不明の突然死などの副作用が出るという二つの問題がありました。この問題を改善するため、複数の家族性AD患者の遺伝子変異をマウスのAPP遺伝子領域に導入し、さらにマウスのAβのアミノ酸配列をヒトと同じにしました。その結果、ヒト患者脳と似たAβの蓄積が認められました。
また、次世代型ADモデルマウス完成までの試行錯誤の中で、意図した通りに複数の遺伝子変異が導入されているにもかかわらず、脳内へのAβの蓄積が全く認められない系統が見つかりました(図2)。この系統では、APP遺伝子の配列の一部が欠失していたため、欠失した遺伝子領域が何らかの役割を担っていると予想しました。欠失した領域の中で、非翻訳領域(遺伝子配列の中でメッセンジャーRNA[mRNA]に転写されるが、タンパク質には翻訳されない領域)は、特にマウス・ヒト間で遺伝子配列の類似性が高いことが知られています。そこで、今回の研究では非翻訳領域に着目しました。
まず、次世代型ADモデルマウスの受精卵の非翻訳領域のうち700塩基をゲノム編集技術によって欠失させました。700塩基はAPP遺伝子の非翻訳領域の大部分に相当します。その結果、脳内でのAβの蓄積が抑制されました。次に、脳内Aβの定量的な評価を行なったところ、ゲノム編集の効率に依存してAβ産生量が下がることが分かりました。これらのマウスでは、APPのタンパクレベル(翻訳後の発現量)およびmRNAレベル(転写後の発現量)に応じてAβ蓄積量が変動していました(図3)。このことから、欠失させた遺伝子領域はAPPの発現量を調節していることが明らかになりました。
さらに、欠失させる遺伝子領域を短くして、同様の実験を行ったところ、約400塩基を欠失させた場合でも、Aβ産生量の低下が認められました。最終的には、34塩基を欠失させただけで同様の現象が確認され、この34塩基がAβの蓄積の抑制に重要であることが分かりました。
注2)2014年4月14日プレスリリース「次世代型アルツハイマー病モデルマウスの開発に成功」
今後の期待
本研究では、次世代型ADモデルマウス作製の過程で偶然見つかった現象を出発点とし、ゲノム編集技術を駆使することでADに対して保護的な遺伝的欠失を発見しました。ゲノム編集の対象にした非翻訳領域はマウス・ヒト間で配列の類似性が高いため、今回の結果はヒト集団における実際の保護的変異の同定につながる可能性があります。
例えばエイズのように保護的変異の同定によって、効果のある薬剤が開発された疾患も存在します。ADにおいても保護的変異の同定をきっかけとし、新しい核酸医薬などの予防的治療法の開発につながると期待できます。
原論文情報
- Kenichi Nagata*, Mika Takahashi, Yukio Matsuba, Fumi Okuyama-Uchimura, Kaori Sato, Shoko Hashimoto, Takashi Saito, and Takaomi C. Saido* (*co-corresponding authors), “Generation of App knock-in mice reveals deletion mutations protective against Alzheimer’s disease-like pathology”, Nature Communications, 10.1038/s41467-018-04238-0
発表者
理化学研究所
脳神経科学研究センター 神経老化制御研究チーム
チームリーダー 西道 隆臣(さいどう たかおみ)
研究員 永田 健一(ながた けんいち)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- ゲノム編集技術
- 配列特異的にDNAを切断する酵素を用いて、ゲノム上の目的の配列に変異を生じさせる技術の総称。本研究では2012年に報告されたCRISPR/Cas9を利用している。
-
- アルツハイマー病
- Alzheimer’s Disease; AD。ドイツの精神科医、アルツハイマー博士により1905年に報告された進行性の記憶障害を伴う認知症。主に中高年で発症し、徐々に進行して生活に支障をきたすようになり、最終的には意思疎通ができなくなる。日本を含む先進国では、高齢期発症の認知症のうちで最も多いタイプの疾患となっている。大部分は家族歴を伴わない孤発性である。
-
- アミロイドβペプチド(Aβ)
- アミロイドβ前駆体タンパク質からプロテアーゼにより切断されて産生される生理的ペプチド。アルツハイマー病で見られるアミロイド斑の構成成分として発見されたことから、Aβの過剰な蓄積がアルツハイマー病発症の引き金と考えられている。
-
- 保護的変異
- ある疾患の発症リスクを軽減するような遺伝的変異。疾患発症の原因変異に比べると同定数は少ないものの多数の変異が見つかっている。例えばCCR5遺伝子の32塩基の欠失はエイズ発症の原因となるHIV感染に耐性をもたらすことが知られる。
-
- 核酸医薬
- DNAやRNAの構成成分である核酸を基本骨格とする医薬品。天然型の他に化学修飾されたものも使われる。
-
- 神経変性疾患
- 神経組織の変性を伴う病気で、異常なタンパク質の凝集などを伴い、神経細胞が損傷するために起きると考えられている。アルツハイマー型認知症やパーキンソン病、プリオン病、筋萎縮性側索硬化症(ALS)などが知られている。
-
- アミロイド前駆体タンパク質(APP)
- Aβの前駆体タンパク質。Aβは2種類のプロテアーゼによってAPPから切り出されて産生される。家族性アルツハイマー病患者より約50の遺伝子変異が同定されているが、変異のタイプによってAβの産生増加、凝集性促進、毒性の強いサブタイプの産生亢進が生じる。逆に、遺伝子変異によりAβの産生が抑えられ、アルツハイマー病を発症しにくいケースも報告されている。このことからも、アルツハイマー病の発症には、Aβの蓄積が引き金になっていると推察される。APPはAmyloid precursor proteinの略。
-
- ノックイン技法
- 遺伝子組み換え法の一つで、標的遺伝子の目的とする塩基のみを置換する方法。トランスジェニックのように過剰発現を行わず、また、ノックアウトのように遺伝子を欠損させることもない。
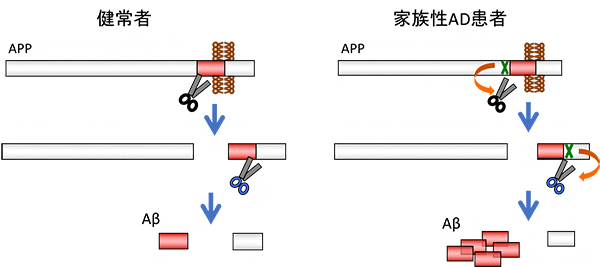
図1 アミロイドβペプチド(Aβ)の産生プロセス
Aβは2種類のプロテアーゼ(タンパク質中のペプチド結合を加水分解する酵素)によってAPPから切り出される(左)。家族性AD患者では、遺伝子上の変異(緑の×印)によってAβが切り出されやすくなり(オレンジの矢印)、脳内でのAβ蓄積が亢進する(右)。

図2 アミロイドが蓄積しないモデルマウス系統
A. 野生型マウスとAβ蓄積なしのモデルマウスのAPP遺伝子領域(適宜簡略化している)を示す。モデルマウスでは、家族性AD患者の遺伝子変異導入の際に三つのエクソン(タンパク質をコードしている部分)、E16~18を連結し、非翻訳領域の大部分を別の配列に置き換えた。
B. 遺伝子変異のみを導入したモデルマウスでは、Aβの蓄積(緑)が認められた(左)。一方、遺伝子変異導入の際に遺伝子領域を欠失させた系統では蓄積がみられなかった(中、右)。いずれも24カ月齢の脳切片。
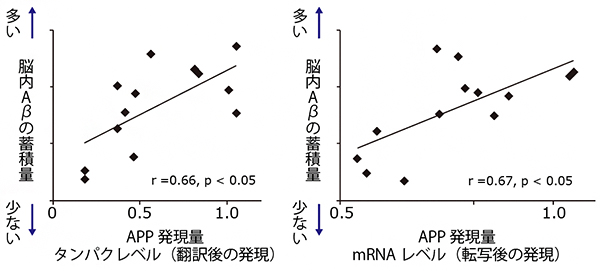
図3 ゲノム編集したモデルマウスのAPP発現量とAβ蓄積量
ゲノム編集技術によって次世代型ADモデルマウスの受精卵の非翻訳領域のうち700塩基を欠失させた際のAPP発現量と脳内Aβ蓄積量との関係をプロットした図。左はタンパクレベル(翻訳後の発現)、右はmRNAレベル(転写後の発現)のAPP発現量でプロットした。各ドットは1個体のデータ。多くの場合、APPの発現量がタンパクレベル、mRNAレベルでともに低下していた(図ではゲノム編集なしの同月齢のモデルマウスのAPP発現量を1と表している)。また、APP発現量とAβ蓄積量はよく相関していた。