2020-04-22 理化学研究所,国立感染症研究所,群馬大学,日本医療研究開発機構
理化学研究所(理研)生命医科学研究センター粘膜システム研究チームの下川周子客員研究員(国立感染症研究所寄生動物部主任研究官、群馬大学大学院医学系研究科生体防御学協力研究員)と大野博司チームリーダー、国立感染症研究所寄生動物部の久枝一部長らの共同研究グループ※は、自己免疫疾患[1]の1型糖尿病(Type 1 diabetes;T1D)発症の抑制に関わるCD8陽性制御性T細胞(CD8Treg)[2]の誘導メカニズムを発見しました。
本研究成果は、現代病(花粉症や自己免疫疾患)が増加したのは感染症が減少したからだとする「衛生仮説[3]」を科学的に証明するとともに、T1Dの新たな予防・治療法の開発につながると期待できます。T1Dは、インスリンを分泌する膵臓の細胞が自分の免疫細胞によって破壊され、高血糖が引き起こされる自己免疫疾患で、近年患者が増加しています。
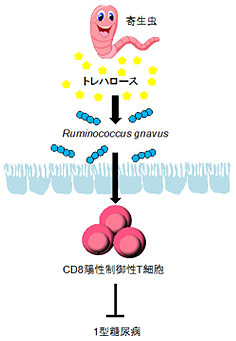
今回、共同研究グループはマウスを用いて、腸管寄生線虫のHeligmosomoides polygyrus [4]が感染すると、T1Dの発症が抑制されることを見いだしました。そしてそのメカニズムとして、寄生虫がトレハロース[5]という糖を分泌することでRuminococcus属[6]の腸内細菌が増殖し、この菌によってCD8Tregが誘導されることにより、膵臓の細胞の破壊が食い止められ、T1Dの発症が抑えられることを明らかにしました。さらに、T1Dの患者では血液中のCD8Tregが減少しており、Ruminococcus属の腸内細菌が少ないことも明らかにしました。
本研究は、オンライン科学雑誌『Nature Communications』(4月22日付)に掲載されます。
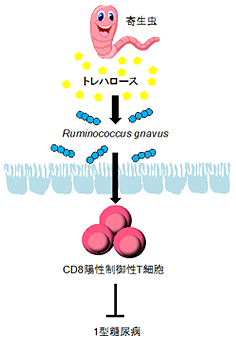
寄生虫を介したCD8陽性制御性T細胞の誘導により、1型糖尿病の発症が抑制される
- ※共同研究グループ
-
- 理化学研究所 生命医科学研究センター
-
- 粘膜システム研究チーム
- 客員研究員 下川 周子(しもかわ ちかこ)
(国立感染症研究所 寄生動物部主任研究官、群馬大学大学院医学系研究科生体防御学協力研究員) - 研究員 加藤 完(かとう たもつ)
- 研究生 竹内 直志(たけうち ただし)
- チームリーダー 大野 博司(おおの ひろし)
- 群馬大学大学院医学系研究科
-
- 生体防御学
- 医学部6年(研究当時)小尾 誠司(おび せいじ)
- 助教 今井 孝(いまい たかし)
- 講師 鈴江 一友(すずえ かずとも)
- 生化学
- 助教 大嶋 紀安 (おおしま のりやす)
- 特任教授 和泉 孝志(いずみ たかし)
(帝京平成大学 ヒューマンケア学部 教授) - 小児科学
- 助教 大津 義晃(おおつ よしあき)
- 教授(研究当時) 荒川 浩一(あらかわ ひろかず)
(社会福祉法人 希望の家附属北関東アレルギー研究所 所長)
- 東京工業大学
- 助教 古木 隆生(ふるき たかお)
- 教授 櫻井 実(さくらい みのる)
- 国立感染症研究所 寄生動物部
- 研究員 Alex Olia(アレックス・オリア)
- 部長 久枝 一(ひさえだ はじめ)
- 研究支援
- 本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究「自己免疫疾患制御へ向けた新規制御性細胞の誘導メカニズムの解明(研究代表者:下川周子)」、武田科学振興財団研究助成金、上原記念生命科学財団、ヤクルトバイオサイエンス研究財団、中島記念国際交流財団、内藤記念科学振興財団、金原一郎記念医学医療振興財団、株式会社資生堂(代表者:下川周子)、日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」研究開発領域(研究開発総括:清水 孝雄)研究開発課題名「オミクス解析に基づくアレルギー発症機構の理解と制御基盤の構築」(研究開発代表者:大野博司)、日本学術振興会(JSPS)科学研究費補助金基盤研究A「自己免疫疾患における腸内細菌叢の役割の研究(研究代表者:大野博司)」による支援を受けて行われました。
背景
近年、衛生環境の改善によって、寄生虫病や結核などの感染症は減少しましたが、アレルギーや自己免疫疾患などの現代病は増加の一途をたどっています。特に、薬剤の普及により寄生虫の感染者数が劇的に減少した地域では、自己免疫疾患の患者数が増加していることが疫学的に証明されています注1)。このように、現代病が増加したのは、感染症が減少したためではないかという考えを「衛生仮説」といいます。
寄生虫に感染すると、宿主(ヒト、マウスなど)は免疫機能を発達させ、寄生虫を体外へ排出しようとします。これに対して、寄生虫は宿主の免疫機能を低下させるシステムを持つため、宿主の攻撃を回避できると考えられています。したがって、寄生虫の感染症の予防・治療にはそのシステムの解明が重要であり、寄生虫が誘導する(免疫抑制性の)細胞の種類や分泌する物質を同定する研究が世界中で盛んに行われています。
そこで、共同研究グループは、自己免疫疾患の中でも、近年特に発症者が増加している1型糖尿病(Type 1 diabetes;T1D)をターゲットとし、寄生虫の一種である腸管寄生線虫の感染がT1Dに与える影響を調べました。T1Dとは、膵臓ランゲルハンス島[7]のβ細胞が自己の免疫細胞によって破壊され、そこから分泌されるインスリンの絶対的な不足が原因となり、高血糖が引き起こされる疾患です。ちなみに、いわゆる生活習慣病である2型糖尿病(Type 2 diabetes;T2D)は、肥満などによってインスリンが出ていても十分に効かない、つまりインスリン抵抗性によって血糖値が上昇する病気であり、T1Dとは病態が全く異なります。
注1)Bach JF., N Engl J Med., 347(12):911-20, (2002)
研究手法と成果
T1Dのマウスモデルは、ストレプトゾトシン(STZ)[8]を低濃度で繰り返し投与することで作製しました。STZは膵臓のβ細胞を特異的に破壊するため、マウスに投与するとインスリンが産生されなくなり、その結果、高血糖が引き起こされます。しかし、あらかじめ腸管寄生線虫であるHeligmosomoides polygyrus (H. polygyrus)をマウスに感染させると、T1Dを誘導しても血糖値の上昇が抑えられ、β細胞の破壊も見られませんでした(図1左)。このことから、H. polygyrusはT1Dの発症を抑制することが分かりました。
次に、そのメカニズムを調べるために、H. polygyrusが感染した際の免疫応答を調べました。これまでH. polygyrusの感染において、さまざまな免疫抑制性の細胞が誘導されることが報告されていましたが、共同研究グループは、その中でCD8陽性制御性T細胞(CD8Treg)に着目しました。実際、マウスにH. polygyrusが感染するとCD8Tregが増加し、感染マウスからその細胞を除去するとT1Dを発症しました。また逆に、非感染マウスにCD8Tregを移入することで、T1Dの発症が抑制されました(図1右)。これらの結果から、H. polygyrusによるT1D 発症の抑制にはCD8Tregが重要であることが明らかになりました。
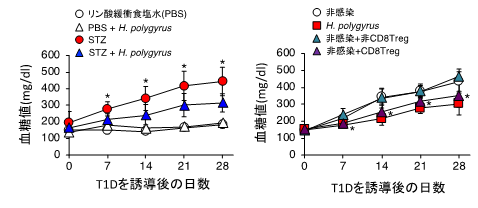
図1 H.polygyrusによる1型糖尿病(T1D)の発症抑制とCD8Tregの関係左:STZを投与すると血糖値が上昇しT1Dを発症するが(赤丸)、あらかじめH. polygyrusを感染させたマウスにSTZを投与すると血糖値の上昇が抑えられた(青三角)。
右:H. polygyrus感染マウスからCD8陽性制御性T細胞(CD8Treg)を単離し、非感染マウスに移入すると感染マウス(赤四角)と同様に血糖値の上昇が抑えられた(紫三角)。
次に、H. polygyrusがどのようにCD8Tregを誘導するのか調べました。H. polygyrusは、主に小腸上部(十二指腸)に寄生する寄生虫です。そこで、H. polygyrus感染マウスの小腸内容物に存在する代謝産物を、ガスクロマトグラフ質量分析計(GC/MS)[9]を用いて解析しました。すると、感染マウスでは腸管内で糖のトレハロースが増加していること、そのトレハロースはH. polygyrus自身が分泌していることが分かりました(図2)。
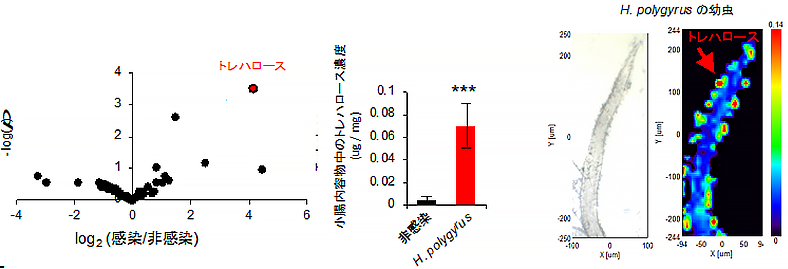 図2 H. polygyrusによるトレハロースの分泌左:H. polygyrus感染マウスの小腸内容物をGC/MSにて解析すると、トレハロース(赤丸)が最も増加していた。
図2 H. polygyrusによるトレハロースの分泌左:H. polygyrus感染マウスの小腸内容物をGC/MSにて解析すると、トレハロース(赤丸)が最も増加していた。
中:トレハロースの濃度を測定すると、非感染マウスと比べて14倍ほど増加していた。
右:トレハロース を特異的に検出できるFTIR顕微鏡を用いてH. polygyrusを観察すると、虫体からトレハロースが分泌されている様子(暖色の部分ほど高濃度)が認められた。
トレハロースは腸内細菌の餌になることから、次世代シーケンサー[10]を用いて腸内細菌叢の変化を解析したところ、H. polygyrusが感染することでRuminococcus属の細菌が増加していることを突き止めました。その中でも特にトレハロースを投与したマウスで増加したRuminococcus gnavus(R. gnavus)を野生型マウスに経口投与すると、CD8Tregが誘導され、さらにSTZを投与することでT1Dの発症を誘導しても血糖値の上昇が抑えられることが分かりました(図3)。この結果から、H. polygyrusによるT1Dの発症抑制に関わるCD8Tregは、寄生虫が分泌するトレハロースで増殖したR. gnavusによって誘導される可能性が示されました。
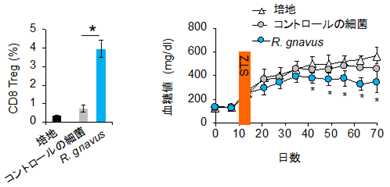
図3 CD8Tregの増加とR. gnavusの関係左:マウスに一定期間R. gnavusを投与すると、H. polygyrusの感染なしでもCD8Tregを誘導できた(青棒)。
右:R. gnavus投与マウスでは、STZを投与しても血糖値の上昇が見られず、T1Dの発症が抑制された(青丸)。
さらに、T1Dの患者では血液中のCD8Tregが減少しているとともに、CD8Tregを誘導するRuminococcus属の腸内細菌が少ないことも明らかにしました(図4)。
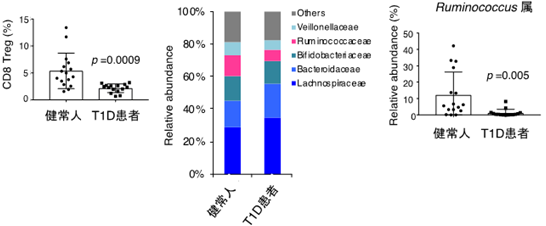
図4 T1Dの患者における血中CD8Treg量と糞便中のRuminococcus属の腸内細菌左:T1D患者の血液中のCD8Tregをフローサイトメトリーで解析すると、健常人と比べて少なかった。
中・右:T1D患者の糞便を回収し、次世代シーケンサーを用いて腸内細菌叢の解析を行うと、ピンクで示すRuminococcaceae科に含まれるRuminococcus属も少なかった。
今後の期待
CD8Tregはこれまでに、多発性硬化症や全身性エリテマトーデスなどの自己免疫疾患に効果があることが動物モデルで示されています注2)が、その誘導メカニズムは分かっていませんでした。今回の研究で、CD8Tregの誘導には、寄生虫が分泌するトレハロースとそれによって増殖した腸内細菌が必要であることが明らかになりました。
T1Dには膵移植や膵島移植といった治療も選択肢の一つとして考えられますが、ドナー不足などの問題から現実的ではなく、現時点では一生涯にわたるインスリンの注射による投与という、生活の質(QOL)に対する悪影響が極めて大きい治療法しかありません。今後、このCD8Tregの誘導メカニズムや膵臓での抑制メカニズムが明らかになることで、T1Dの新たな予防・治療法の開発へつながると期待できます。
注2)Dinesh RK et.al., Autoimmun Rev., 8:560-568,(2010)
論文情報
- タイトル
- CD8+ regulatory T cells play a critical role in prevention of autoimmune-mediated diabetes
- 著者名
- Chikako Shimokawa, Tamotsu Kato, Tadashi Takeuchi, Noriyasu Ohshima, Takao Furuki, Yoshiaki Ohtsu, Kazutomo Suzue, Takashi Imai, Seiji Obi, Alex Olia, Takashi Izumi, Minoru Sakurai, Hirokazu Arakawa, Hiroshi Ohno* and Hajime Hisaeda*
* Equal contribution - 雑誌
- Nature Communications
補足説明
- [1] 自己免疫疾患
- 本来は、外来から侵入してくる全ての異物から生体を守るはずの免疫システムが異常を来し、誤って自分自身の細胞や組織を攻撃してしまう疾患。
- [2] CD8陽性制御性細胞(CD8Treg)
- 1970年に報告された白血球の一種で、これまでのさまざまな研究から炎症性疾患、腫瘍免疫、移植寛容、自己免疫疾患などに対する新たな治療戦略の糸口になると考えられている。しかし、いまだにその機能などの全貌は明らかになっていない。
- [3] 衛生仮説
- 乳幼児期の衛生環境が、個体の免疫系の発達に影響を及ぼしているという仮説。近年アレルギーや自己免疫疾患の患者が増加している背景には、衛生環境の改善や生活水準の向上、予防接種の普及、食生活・栄養の変化、抗生物質の乱用による幼少時の感染症の減少が関与していることが、多くの疫学調査でも証明されている。
- [4] Heligmosomoides polygyrus
- 齧歯類に感染する腸管寄生性線虫の一種。さまざまな免疫応答を引き起こしながら数カ月以上感染しているため、慢性感染のモデルとして使用される。
- [5] トレハロース
- グルコースがグリコシド結合してできた二糖の一種である。食品以外に化粧品、飼料などに使用されている。また、耐糖能改善の効果、神経変性疾患抑制の効果、細胞保護の作用など、多種多様な生理機能があることが知られている。
- [6] Ruminococcus属
- セルロース分解能を持つグラム陽性菌。培養には強い嫌気度を要求する。
- [7] 膵臓ランゲルハンス島
- 膵臓の内部に島状に散財する内分泌を司る細胞群であり、様々なホルモンを分泌している。
- [8] ストレプトゾトシン(STZ)
- 天然由来の有機化合物であり、特に哺乳類の膵臓のβ細胞への毒性を持つ。アルキル化剤系の抗がん剤としても使用される。
- [9] ガスクロマトグラフ質量分析計(GC/MS)
- 試料を注入口で加熱して気化させたガスをキャピラリーカラム(中空の細長いガラス管)に送り出し、ガスとカラム内部との親和性による移動スピードの違いやカラムを昇温加熱した時の沸点の違いを利用してガス中の成分を分離させ、質量分析計で測定する装置。
- [10] 次世代シーケンサー
- 大量のDNA配列を高速で決定する実験機器。数千から数百万ものDNA分子配列を同時に決定できる。
発表者・機関窓口
*今般の新型コロナウイルス感染症対策として、理化学研究所では全職員在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
発表者
理化学研究所 統合生命医科学研究センター 粘膜システム研究チーム
客員研究員 下川 周子(しもかわ ちかこ)
(国立感染症研究所寄生動物部主任研究官、群馬大学大学院医学系研究科生体防御学協力研究員)
チームリーダー 大野 博司(おおの ひろし)
国立感染症研究所 寄生動物部
部長 久枝 一(ひさえだ はじめ)
機関窓口
理化学研究所 広報室 報道担当
国立大学法人群馬大学
昭和地区事務部総務課広報係
AMEDに関すること
日本医療研究開発機構
基盤シーズ開発・研究基盤事業部 革新的先端研究企画開発課