患者由来iPS細胞を用いた薬剤スクリーニングシステム
2020-06-17 順天堂大学,日本医療研究開発機構
概要
順天堂大学大学院医学研究科ゲノム・再生医療センターの赤松和土教授、石川景一助教、神経学の服部信孝教授らの共同研究グループは、家族性パーキンソン病患者由来のiPS細胞*1から作製したドーパミン神経細胞を用いた病態検出システムの自動化に成功し、一度に多くの薬剤スクリーニングを行うことを可能にしました。この結果としてiPS細胞の病態を改善させる4種類の化合物を同定しました。本研究ではさらに、このシステムで同定した薬剤がパーキンソン病モデル動物のショウジョウバエと一部の孤発性パーキンソン病患者由来細胞に対しても病態改善効果を持つことを確認しました。原因遺伝子と細胞での表現型が明らかである家族性症例の細胞を用いて同定した化合物が、原因不明で症例の大部分を占める孤発性症例由来の細胞でも効果があるという結果は、パーキンソン病に対するiPS細胞を用いた創薬の有用性を示しています。本研究は国際幹細胞学会(ISSCR)の科学誌Stem Cell Reportsのオンライン版に2020年5月28日付(日本時間:2020年5月29日)で公開されました。
本研究成果のポイント
- 損傷ミトコンドリアの除去機能に異常がある家族性パーキンソン病患者由来iPS細胞を用いて、病態検出システムの自動化による薬剤スクリーニングを可能とした。
- 薬剤スクリーニングにより病態改善効果をもつ化合物を複数同定し、一部の孤発性症例由来の細胞でも病態改善効果を確認した。
- 家族性パーキンソン病の病態解明と創薬が、孤発性症例の治療法開発につながる可能性がある。
背景
パーキンソン病は、ドーパミン神経細胞の減少により手足のふるえやこわばり、動作の緩慢、姿勢の不安定性(転びやすくなる)といった運動症状や自律神経障害を示す疾患です。現在のところ治療はいずれも失われたドーパミン神経細胞の機能を補う対症療法であり、根本的な治療法がないのが現状です。およそ90%のパーキンソン病患者さんは原因が明らかでない孤発性パーキンソン病ですが、10%の患者さんは家族性パーキンソン病であり、研究グループは原因遺伝子が明らかな家族性パーキンソン病患者さんからiPS細胞を作製し、発症メカニズムの解明を進めてきました。これまでの研究で家族性パーキンソン病の中でもPARK2とPARK6と呼ばれるタイプ*2では、損傷したミトコンドリア*3を除去する働きに異常があることが明らかとなっており、これはPARK2とPARK6の患者さんから作製したiPS細胞を神経細胞に分化させた場合でも同様であることが分かっています。この損傷ミトコンドリア除去機能の低下を薬剤で回復させることができれば、パーキンソン病の発症予防や進行抑制が可能になると予想されます。しかしながら、これまでの解析法では研究者が1つ1つの細胞を丁寧に観察する必要があり、数百種類の薬剤による効果を一度に検証することは困難でした。また、家族性パーキンソン病の発症メカニズムが孤発性症例と、どの程度共通するのかは全く不明でした。そこで、本研究ではまず家族性パーキンソン病に対して改善効果のある薬剤を明らかにするスクリーニングシステムを確立することを目的として、解析手法の自動化の検討を始めました。
内容
今回の研究では、順天堂医院に通院するPARK2の患者さん2名及びPARK6の患者さん1名から作製されたiPS細胞を、研究グループがこれまで開発してきたiPS細胞からドーパミン神経細胞を誘導する複数の手法を組み合わせて、96個の小さな穴を持つプレート上でドーパミン神経細胞へと分化誘導しました。そして、患者iPS細胞から分化させたドーパミン神経細胞における損傷ミトコンドリア除去機能の低下や細胞死の増加といった病態を、イメージングサイトメーター*4と呼ばれる機器を用いて自動的・定量的に検出する方法を確立しました(図)。
この手法を用いて、既に臨床応用されている薬剤を含む320種類もの化合物を用いて損傷ミトコンドリア除去機能改善効果などの病態改善効果を検証しました。その結果、PARK2及びPARK6の病態を改善させる治療薬候補の化合物として、MRS1220、トラニルシプロミン、フルナリジンの3種類の化合物を同定しました。また、320種類の化合物のうち逆にミトコンドリアの蓄積傾向を示し病態を悪化させたものの中で、ドーパミンの働きを抑制するピモジドという薬剤が見つかったことから、その反対の作用を持つ化合物を探しました。その結果、すでにパーキンソン病治療薬として過去に使われていたブロモクリプチンが従来のドーパミン作動薬としての作用とは異なる作用で病態を改善させることを明らかにしました。これら同定された4種類の化合物をPARK6パーキンソン病ショウジョウバエモデルに投与したところ、すべての化合物で症状の改善傾向が見られました。さらにこれらの化合物が特定の家族性パーキンソン病のタイプのみならず、症例の90%を占める孤発性パーキンソン病でも効果があるかを検討しました。順天堂医院に通院する4名の孤発性パーキンソン病の患者さん由来のiPS細胞から分化させたドーパミン神経細胞ではそのうち2名にPARK2/PARK6と同様のミトコンドリア除去機能低下を認めたため、4種類の化合物の効果を検証したところ、そのうちの1名のドーパミン神経細胞においても、これらの化合物に病態改善効果があることがわかりました。これらの化合物は副作用などの問題から使用されなくなったものもあり、そのまま治療薬に使うことはできませんが、構造が近い薬物をさらに調べたり、最適な濃度を検討することによって新たな治療薬候補の開発につながる可能性があります。
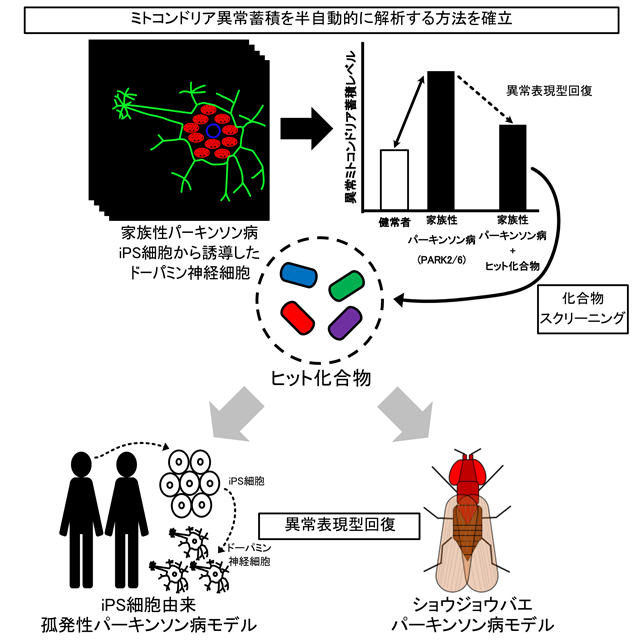
図:本研究の概要患者由来のiPS細胞から96穴プレート上で分化させたドーパミン神経細胞におけるミトコンドリア除去機能障害の定量の方法をイメージングサイトメーターを用いて自動化することに成功した。確立した方法を用いて、化合物ライブラリによるスクリーニングを実施し、ヒットした化合物を4種類同定することに成功した。ヒット化合物はショウジョウバエモデル・孤発性パーキンソン病モデルの一部においても表現型(症状)の回復である病態改善効果を示し、このシステムで同定した化合物が、治療候補化合物として有用である可能性が示唆された。
今後の展開
今回の研究では、患者由来iPS細胞を用いた薬剤スクリーニングシステムによって同定された薬剤が、家族性パーキンソン病患者由来細胞のみならず、孤発性パーキンソン病患者由来細胞の一部に対しても病態改善効果があることがわかりました。研究グループはこれまで原因遺伝子が明らかである家族性パーキンソン病のiPS細胞を用いて病態解明や治療薬の候補の探索を進めてきましたが、パーキンソン病の症例の大部分を占める孤発性症例にどのぐらい共通しているか、どのぐらい応用できるかは全く不明でした。今回の研究結果によって、家族性症例と孤発性症例に共通の病態メカニズムがあることが示唆され、家族性パーキンソン病の細胞を用いて同定した病態改善効果のある化合物を見つけることが、症例の大部分を占める孤発性症例にも有効な薬剤開発につながる可能性があることが示されました。ただ、今回の化合物が有効であった孤発性症例は一部の症例に限られたことから、今後は多様性に富む孤発性症例をより詳細に検討し分類することが必要であり、それぞれの患者に即した治療薬を用いたオーダーメイドのパーキンソン病治療戦略を展開していきたいと考えています。
用語解説
- *1 iPS細胞(人工多能性幹細胞):
- 皮膚や白血球に特定の因子(例:Oct3/4, KLF4, SOX2, c-Myc)を導入することにより作製された、自己複製能とあらゆる細胞に分化することのできる多分化能を有する細胞。脳の神経細胞のような直接採取することが困難な細胞を用いた病態解析や再生医療の分野で有用性が大きく期待されている。
- *2 PARK2・PARK6:
- いずれも常染色体劣性(潜性)遺伝形式により発症する家族性パーキンソン病で、PARK2はParkin遺伝子、PARK6はPINK1遺伝子の変異により発症する。損傷ミトコンドリアはParkinにより分解への目印となるユビキチン鎖をミトコンドリアに繋げられ、PINK1によりそのユビキチン鎖がリン酸化されることにより分解へと進行する。
- *3 ミトコンドリア:
- 細胞の活動に必要なエネルギー(ATP)を産生する細胞内小器官。損傷ミトコンドリアは何らかの刺激によりそのエネルギー産生機能などが低下した状態で、これが蓄積することにより酸化ストレスの増加、細胞脆弱性の亢進につながる。
- *4 イメージングサイトメーター:
- プレート上で培養した神経細胞を顕微鏡で半自動的に画像を撮影し、定量化する機器。これを用いることにより多くのサンプルを一括で解析でき、解析プロセスの高速化が可能となる。
原著論文
本研究はStem Cell Reports誌のオンライン版で2020年5月28日付(日本時間:2020年5月29日)で先行公開されました。
- タイトル:
- Identifying therapeutic agents for amelioration of mitochondrial clearance disorder in neurons of familial Parkinson’s disease
- タイトル(日本語訳):
- 家族性パーキンソン病におけるミトコンドリア除去障害を改善させる治療候補化合物の同定
- 著者:
- Akihiro Yamaguchi1, Kei-ichi Ishikawa1,2*, Tsuyoshi Inoshita3, Kahori Shiba-Fukushima3, Shinji Saiki2, Taku Hatano2, Akio Mori2, Yutaka Oji2, Ayami Okuzumi2, Yuanzhe Li2, Manabu Funayama1,2, Yuzuru Imai2,4, Nobutaka Hattori2,4, Wado Akamatsu1*
- 著者(日本語表記):
- 山口昂大1、石川景一1,2*、井下強3、柴-福嶋佳保里3、斉木臣二2、波多野琢2、森聡生2、王子悠2、奥住文美2、李元哲2、舩山学1,2、今居譲2,4、服部信孝2,4、赤松和土1* *責任著者
- 著者所属:
- 1順天堂大学大学院医学研究科ゲノム・再生医療センター、2順天堂大学大学院神経学講座、3多発性硬化症および神経難病治療・研究講座、4パーキンソン病病態解明研究講座
- DOI:
- 10.1016/j.stemcr.2020.04.011
本研究は文部科学省(MEXT)私立大学戦略的研究基盤形成支援事業(S1411007)、AMED難治性疾患実用化研究事業(JP17ek0109244)、AMED創薬基盤推進研究事業(産学官共同創薬研究プロジェクト, GAPFREE; JP19ak0101112)、AMEDゲノム医療実現推進プラットフォーム事業先端ゲノム研究開発(GRIFIN; JP19km0405206s0104)、JSPS科研費(JP18K15463, JP17H04049, JP18H02744, JP18H04043)の支援を受け実施されました。本研究の筆頭著者である山口昂大(研究当時:医学部学生)は文部科学省「基礎・臨床を両輪とした医学教育改革によるグローバルな医師養成」の「基礎研究医養成のための順天堂型教育改革」の支援を受けました。
なお、本研究にご協力いただいた皆様には深謝いたします。
お問い合わせ先
研究内容に関するお問い合せ先
順天堂大学大学院医学研究科
ゲノム・再生医療センター
教授 赤松 和土(あかまつ わど)
取材に関するお問い合せ先
順天堂大学 総務局 総務部 文書・広報課
担当:長嶋 文乃(ながしま あやの)
AMED事業に関するお問い合せ先
日本医療研究開発機構(AMED)
創薬事業部 創薬企画・評価課
難治性疾患実用化研究事業