2020-06-19 理化学研究所
理化学研究所(理研)開拓研究本部鈴木糖鎖代謝生化学研究室の鈴木匡主任研究員とグローバル研究クラスタシステム糖鎖生物学研究グループの細見昭協力研究員(研究当時、現 信州大学学術研究院(農学系)助教)らの共同研究グループは、真核生物のモデル生物である出芽酵母(Saccharomyces cerevisiae)で、小胞体シグナルペプチド(以下、シグナルペプチド)を持たないタンパク質の小胞体内への輸送を抑制する因子としてSte24タンパク質[1]を同定しました。
本研究成果は、シグナルペプチドに依存しない輸送機構のより詳しい解析につながると期待できます。
可溶性タンパク質[2]の小胞体[3]への輸送は、輸送されるタンパク質自身が持っている小胞体シグナルペプチド[4]によって規定されており、シグナルペプチドを持たないタンパク質は小胞体内へ輸送されないと考えられてきました。一方で、シグナルペプチドを持たないにもかかわらず、小胞体内へ輸送される可溶性タンパク質が一部報告されてきました。しかし、このシグナルペプチドに依存しないタンパク質輸送の詳細は分かっていませんでした。
今回、共同研究グループは出芽酵母を用いて、シグナルペプチドに依存しない小胞体へのタンパク質輸送の抑制因子としてSte24タンパク質を同定しました。また、Ste24タンパク質を欠損した変異株を用いて、シグナルペプチドを持たない核タンパク質Rme1[5]が小胞体へ輸送されることを発見しました。
本研究は、科学雑誌『Journal of Biological Chemistry』の掲載に先立ち、オンライン版(6月8日付)に掲載されました。
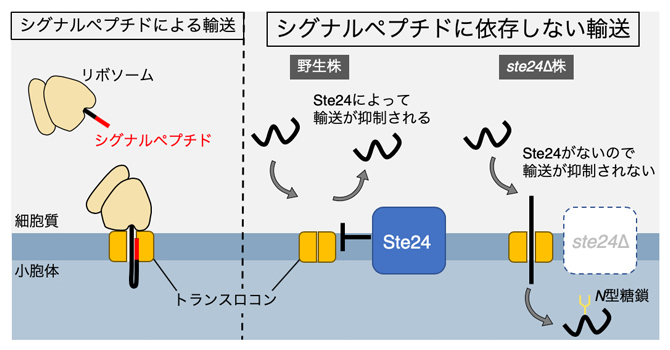
シグナルペプチドによるタンパク質輸送(左)とシグナルペプチドに依存しない輸送(右)
背景
真核生物において、分泌経路(小胞体→ゴルジ体→細胞外)で輸送される可溶性タンパク質は、小胞体内への輸送の目印として小胞体シグナルペプチド(以下、シグナルペプチド)を持っています。細胞質から小胞体内へのタンパク質の輸送は、小胞体膜上のトランスロコン[6]と呼ばれるタンパク質複合体が担っています。タンパク質がトランスロコンを通過するときに、シグナルペプチドがトランスロコンの孔を開くことが明らかにされており注1)、シグナルペプチドを持たない可溶性タンパク質はトランスロコンを通過できないと考えられてきました。
一方で、一部の可溶性タンパク質がシグナルペプチドを持たないにもかかわらず、小胞体内に輸送されることが報告されてきました注2,3)。しかし、輸送に関わる因子が同定されておらず、シグナルペプチドを持たないタンパク質がどのようにして小胞体内へ輸送されるのかは全く分かっていませんでした。
注1)Voorhees RM and Hegde RS., Structure of the Sec61 channel opened by a signal sequence., Science, 351, 88-91, 2016
注2)Blachly-Dyson E and Stevens TH., Yeast Carboxypeptidase Y Can Be Translocated and Glycosylated Without Its Amino-Terminal Signal Sequence., J Cell Biol., 104, 1183-91, 1987
注3)Iida K, et al., Post-translational processing and membrane translocation of the yeast regulatory Mid1 subunit of the Cch1/VGCC/NALCN cation channel family. J. Biol. Chem. 292, 20570-20582, 2017
研究手法と成果
タンパク質の翻訳後修飾[7]の一つであるN型糖鎖修飾[8]は、小胞体内でのみ起こることから、タンパク質にN型糖鎖が付加されていれば、そのタンパク質が小胞体内に輸送されたことが分かります。出芽酵母(Saccharomyces cerevisiae)のMid1タンパク質[9]はシグナルペプチドを持つタンパク質ですが、シグナルペプチドを含むN末端領域を削除してもN型糖鎖修飾されることが分かっており、シグナルペプチドが無くても小胞体内に輸送されるタンパク質の一つとして知られていました注3)。
そこで、共同研究グループは、シグナルペプチドを人工的に削除したMid1タンパク質(シグナルペプチド削除型Mid1)のN型糖鎖修飾を指標にして、シグナルペプチドに依存しないタンパク質輸送に関わる因子の同定を試みました。まず、小胞体内でタンパク質の分解やフォールディングに関わることが分かっている8種類のタンパク質をそれぞれ欠損させた酵母株を作製して、シグナルペプチド削除型Mid1のN型糖鎖修飾の違いを調べました。すると、Ste24タンパク質を欠損した株(ste24遺伝子破壊株、以下ste24Δ)では、N型糖鎖が付加された糖鎖付加型Mid1は見られたものの、N型糖鎖が付加されていない非糖鎖付加型Mid1はほとんど見られませんでした(図1)。この結果は、Ste24がシグナルペプチド削除型Mid1の輸送に関与している可能性があることを示しています。
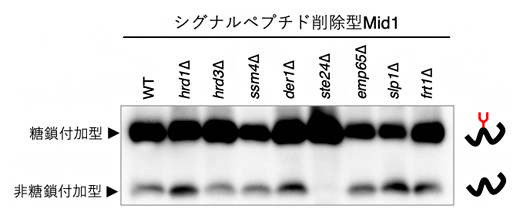
図1 シグナルペプチド削除型Midのウエスタンブロッティング
小胞体で機能するタンパク質の遺伝子破壊株にシグナルペプチド削除型Mid 1を発現させて、ウエスタンブロッティングで糖鎖付加の程度を比較した。その結果、ste24遺伝子破壊株(ste24Δ)では、非糖鎖付加型がほとんど見られなかった。
次に、Ste24の関与をより詳しく知るために、CPY*(カルボキシペプチダーゼY[10][CPY]の1アミノ酸変異体)を用いました。CPYもシグナルペプチドを持つタンパク質ですが、シグナルペプチドを削除しても一部がN型糖鎖修飾されることが分かっていました注2)。シグナルペプチド削除型CPY*を作製して、N型糖鎖修飾の度合いを野生株とste24Δで比較しました。すると、ste24Δにおいて、N型糖鎖が付加されている糖鎖付加型のシグナルペプチド削除型CPY*が著しく増加していることが分かりました(図2)。この結果から、Ste24タンパク質がシグナルペプチドに依存しない輸送の抑制因子であることが明らかになりました。
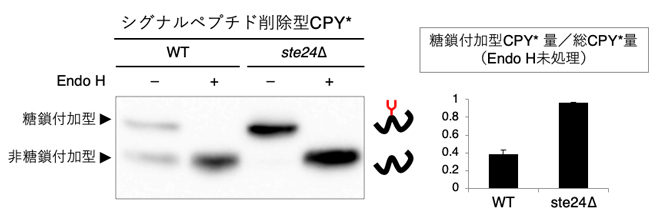
図2 Endo H処理したシグナルペプチド削除型CPY*のウエスタンブロッティング
野生株とste24遺伝子破壊株(ste24Δ)に発現させたシグナルペプチドを抽出してEndo H処理(エンドグリコシダーゼH処理)を行った後に、ウエスタンブロッティングで糖鎖付加の程度を比較した。その結果、ste24Δで糖鎖付加が促進されることが分かった。なお、Endo Hは糖タンパク質から高マンノース型のN結合型糖鎖を切断する酵素である。
シグナルペプチドを持つタンパク質は、小胞体膜上に存在するトランスロコンによって小胞体内へ輸送されます。共同研究グループは、シグナルペプチドを持たないタンパク質も同様にトランスロコンを通って小胞体内へ輸送されるかを調べるために、Sec61変異株(sec61-41)を用いました。実験の結果、ste24Δで促進されたシグナルペプチド削除型CPY*のN型糖鎖付加が、Sec61の変異で抑制されることが分かりました(図3)。この結果は、シグナルペプチドに依存しないタンパク質輸送もトランスロコンを介して行われることを示唆しています。
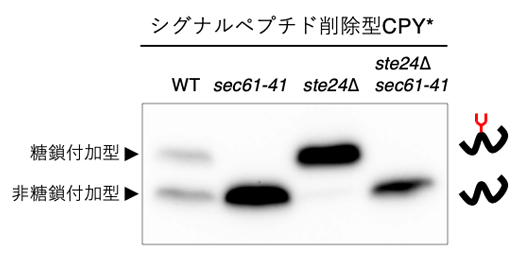
図3 Sec61変異体に発現させたシグナルペプチド削除型CPY*のウエスタンブロッティング
各株に発現させたシグナルペプチド削除型CPY*の糖鎖付加の程度を、ウエスタンブロッティングで比較した。その結果、Sec61変異株(sec61-41)で糖鎖付加が抑制されることが分かった。
これまで、出芽酵母においてシグナルペプチドに依存せずに小胞体内へ輸送されることが明らかにされたタンパク質は、全てシグナルペプチドを人工的に削除したタンパク質であり、元々シグナルペプチドを持たないタンパク質は同定されていませんでした。輸送機構の解明のためには、元々シグナルペプチドを持たないが小胞体内へ輸送されるオリジナルタンパク質が有用であると考えられました。そこで、シグナルペプチドに依存しない輸送が促進されるste24Δを用いて同定を試みたところ、核タンパク質Rme1がN型糖鎖修飾されることが分かりました(図4)。つまり、出芽酵母において、元々シグナルペプチドを持たないにもかかわらず小胞体内へ輸送されるタンパク質として、Rme1を同定することができました。
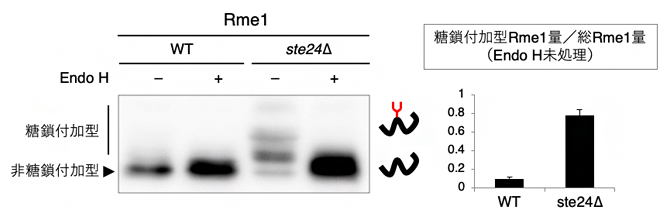
図4 Endo H処理した核タンパク質Rme1のウエスタンブロッティング
野生株とste24遺伝子破壊株(ste24Δ)に発現させたRme1を抽出して、Endo H処理(エンドグリコシダーゼ処理)を行った後に、ウエスタンブロッティングで糖鎖付加の程度を比較した。その結果、ste24Δで糖鎖付加が促進されることが分かった。
今後の期待
本研究によって、シグナルペプチドに依存しない小胞体内へのタンパク質輸送の抑制因子の一つがSte24タンパク質であることが明らかになりました。今後、ste24Δを用いることで、シグナルペプチドに依存せずに小胞体内へ輸送されるタンパク質の検出が容易になり、詳細なタンパク質輸送機構の解明につながると期待されます。
また、シグナルペプチドを持たないタンパク質の小胞体内への輸送はヒトなどの哺乳類でも知られており、今後は、本輸送機構が真核生物でどの程度共通しているのか解明されると考えられます。
補足説明
1.Ste24タンパク質
小胞体に存在する膜貫通タンパク質。出芽酵母接合因子aファクターの成熟化に関わるプロテアーゼ(ペプチド結合の加水分解酵素)。
2.可溶性タンパク質
本研究では、膜貫通領域を持たないタンパク質の総称として用いている。
3.小胞体
真核生物に存在する細胞内小器官の一つ。分泌経路で輸送されるタンパク質は、輸送の第一段階として、細胞質から小胞体内腔へ輸送される。
4.小胞体シグナルペプチド
タンパク質のN末端に存在するアミノ酸配列であり、タンパク質の小胞体への輸送を規定する。
5.Rme1
核に局在するタンパク質であり、減数分裂を抑制する働きを持つ。
6.トランスロコン
Sec61タンパク質を中心とした複合体で、タンパク質が小胞体膜を通過できるようにする働きをもつ。小胞体シグナルペプチドを持つタンパク質は、トランスロコンを通って小胞体内腔へ輸送される。
7.翻訳後修飾
翻訳後のタンパク質に起こる化学的修飾。糖鎖修飾やリン酸化修飾などがある。
8.N型糖鎖修飾
タンパク質を構成するアミノ酸の一つであるアスパラギン酸の側鎖に起こる、種々の糖による翻訳後修飾。
9.Mid1タンパク質
カルシウムチャネルCch1と複合体を形成し、細胞へのカルシウム流入に関与する制御タンパク質。
10.カルボキシペプチダーゼY
細胞内小器官の一つである液胞に局在するプロテアーゼ。
共同研究グループ
理化学研究所
開拓研究本部 鈴木糖鎖代謝生化学研究室
主任研究員 鈴木 匡(すずき ただし)
グローバル研究クラスタ システム糖鎖生物学研究グループ(研究当時)
協力研究員(研究当時) 細見 昭(ほそみ あきら)
(現 信州大学学術研究院(農学系) 助教)
東京都医学総合研究所 細胞膜研究室
協力研究員 飯田 和子(いいだ かずこ)
東京学芸大学 教育学部
名誉教授 飯田 秀利(いいだ ひでとし)
大学院生(研究当時) 長 敏彦(ちょう としひこ)
信州大学総合理工学研究科
大学院生(研究当時) 金子 昌史(かねこ まさし)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「プロテアソームに入る前の異常タンパク質の切断機構の解明(研究代表者:細見昭)」、同基盤研究(C)「出芽酵母カルシウムチャネルの制御サブユニットの翻訳開始コドン選択機構と膜輸送機構(研究代表者:飯田秀利)」、同基盤研究(B)「出芽酵母における糖タンパク質糖鎖代謝の分子機構の全容解明(研究代表者:鈴木匡)」、同若手研究(B)「シグナルペプチド非依存的に小胞体へ輸送されるタンパク質の同定と機能解析(研究代表者:細見昭)」による支援を受けて行われました。
原論文情報
Akira Hosomi, Kazuko Iida, Toshihiko Cho, Hidetoshi Iida, Masashi Kaneko, Tadashi Suzuki, “The ER-associated protease Ste24 prevents N-terminal signal peptide-independent translocation into the ER in Saccharomyces cerevisiae”, The Journal of Biological Chemistry, 10.1074/jbc.RA120.012575
発表者
理化学研究所
開拓研究本部 鈴木糖鎖代謝生化学研究室
主任研究員 鈴木 匡(すずき ただし)
グローバル研究クラスタ システム糖鎖生物学研究グループ(研究当時)
協力研究員(研究当時) 細見 昭(ほそみ あきら)
(現 信州大学学術研究院(農学系)助教)
報道担当
理化学研究所 広報室 報道担当