オーダーメードの治療計画で、より安全で効果的な治療法の確立を目指す
2021-01-14 日本原子力研究開発機構,大阪大学
【発表のポイント】
- がん細胞を選択的に攻撃可能なα線を用いた標的核医学治療は、高い治療効果と低い副作用を兼ね備えた新しいがん治療方法として注目を集めている。しかし、その治療計画に患者の個性(体格や薬剤集積性など)は反映されていない。
- 今回、原子力機構が開発した最新のシミュレーション技術(放射線挙動解析コードPHITS)を活用し、患者個人のPET-CT画像から体内の吸収線量を精緻に計算して治療効果や副作用の大きさを推定するシステムを開発した。
- このシステムを使えば、最適な投与量や分割回数の決定など、患者の個性を反映したオーダーメードの治療計画が可能となり、より安全で効果的なα線核医学治療が実現できる。
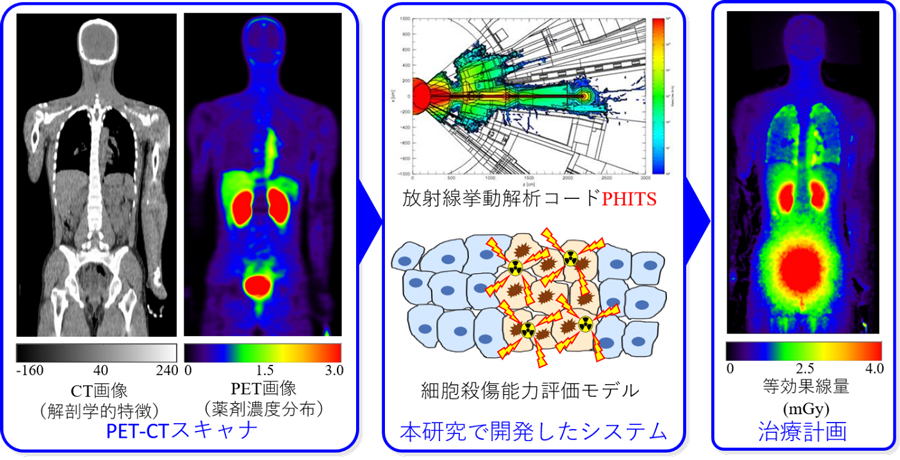
図1 本研究で開発した核医学用線量評価システムの概要とその検証結果の例
【概要】
国立研究開発法人日本原子力研究開発機構(理事長 児玉敏雄、以下「原子力機構」という。)原子力基礎工学研究センター放射線挙動解析研究グループの佐藤達彦研究主席(国立大学法人大阪大学(総長 西尾章治郎、以下「大阪大学」という。)核物理研究センター特任教授(常勤)を兼任)、大阪大学大学院医学系研究科の渡部直史助教らの研究チームは、患者のPET-CT画像から自動で体内の積算放射能分布を推定し、放射線挙動解析コードPHITSを用いて吸収線量や治療効果を推定するα線核医学治療用の線量評価システムの開発に成功しました。
短い飛程で高いエネルギーを放出するα線を用いた標的核医学治療(Targeted Alpha Therapy、以下「TAT」という。)は、高い治療効果と低い副作用を兼ね備えた新しいがん治療方法として社会の大きな注目を集めています。大阪大学でも、医理核連携プロジェクトとして、加速器を用いたα核種製造、創薬研究、臨床試験など、様々な部局が協力してTATの治療法確立に向け取り組んでいます。しかし、X線治療など従来の放射線治療で使われてきた線量評価システムはTATには適用できず、その開発が望まれていました。
そこで、本研究では、患者個人のPET-CT画像から自動で体内の積算放射能分布を推定し、原子力機構が中心となって開発した放射線挙動解析コードPHITSを用いて吸収線量分布を計算するTAT用の線量評価システムを構築しました。また、α線の高い細胞殺傷効果や腫瘍内における薬剤不均一性を考慮して等効果線量(同じ効果を与えるX線治療の線量)を推定する新しいモデルを確立し、構築したシステムに搭載しました。これにより、これまで膨大に蓄積されたX線治療の臨床結果からTATの治療効果や副作用の大きさが推定できるようになり、オーダーメードの治療計画が可能となりました。
また、PET用核種(18F [フッ素18])をラベルした新しいプローブ(NKO-035)を健常者に投与した臨床試験結果を用いて、構築したシステムの検証を実施しました。その結果、図1最右図に示すように、陽電子を放出するPET核種の場合は、等効果線量は本来の線源の位置からかなり離れた場所まで拡がっていることが分かりました。さらに、核種をα線源(211At [アスタチン211])に変更して計算したところ、線量の拡散は少ないものの、臓器内の線量不均一性が高く、薬剤の投与量を増やしても等効果線量が単調に増加しないことが判明しました。これは、腫瘍内にできるだけ均一に拡がる薬剤開発がTATの成功のため極めて重要となることを示唆しています。
本研究において、原子力機構はシステム開発、大阪大学は臨床試験とその医学的な検証を主に担当しました。本研究成果は、欧州核医学物理誌(EJNMMI Physics)に2021年1月12日付けでオンライン掲載されました。今後は、構築したシステムを大阪大学医学部附属病院で実施予定の新しい薬剤を用いたTAT臨床研究に応用し、最適な投与量や分割回数の決定など、より安全で効果的な治療法の確立を目指す予定です。
【研究開発の背景と目的】
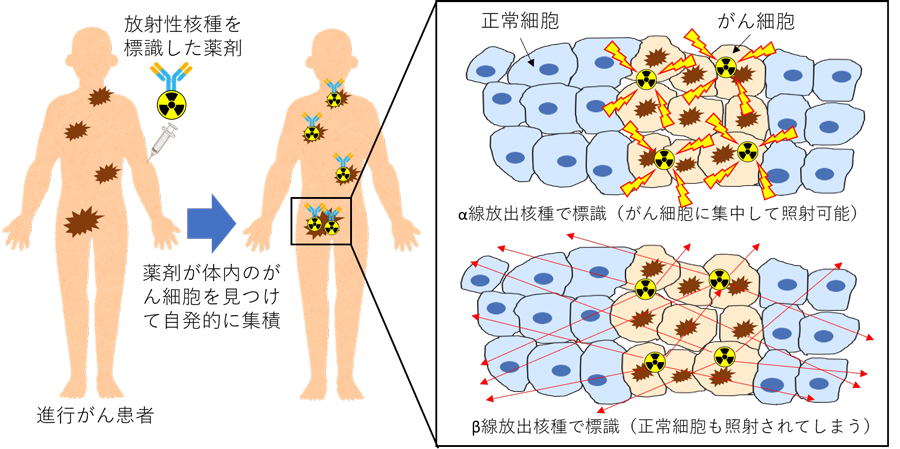
がん細胞に集まる性質を持つ薬剤に放射性核種を標識し、そこから放出される放射線で選択的にがん細胞を殺傷する治療法を標的核医学治療と呼びます。その概要を図2に示します。標的核医学治療の対象となるのは、主に、外照射による局所の放射線治療が困難な多発転移のある進行がん患者です。これまで、全身に転移した甲状腺がん、悪性リンパ腫、神経内分泌腫瘍、神経芽細胞腫などに対して、β線放出核種1)で標識された薬剤が利用されてきました。しかし、β線は人体内での飛程が長く、せっかく薬剤ががん細胞に集積されても治療効果が十分でない弱点がありました。そこで、TATの研究が世界各地で進められています。例えば、これまで不治の病とされてきた難治性の転移性前立腺がんがTATにより完全寛解したという奇跡のような結果が2016年にドイツから報告されました。我が国でも、産学共創プラットフォーム共同研究推進プログラム(OPERA)の枠組みのもと、大阪大学核物理研究センターなど複数の大学や企業が連携してα核種製造、創薬研究、臨床試験などを実施し、TATの治療法確立に向け取り組んでいます。
図2 標的核医学治療の概要
放射線治療を行うためには、一般に、腫瘍や正常組織の大きさ・位置など患者個人の解剖学的特徴を考慮して治療計画を立てる必要があります。例えば、外照射による放射線治療では、患者個人のCT画像に基づいたコンピュータシミュレーションにより腫瘍や正常組織の吸収線量2)を正確に評価するシステムが開発され、臨床現場で活用されています。一方、TATなど標的核医学治療では、これまで患者個人の解剖学的特徴を考慮した線量評価システムは存在せず、その治療計画は、単純に患者の体重から投与可能な放射能を決定する手法が一般的でした。しかし、この手法では、思うような治療効果が得られなかったり想定外の副作用が生じてしまったりした場合に、薬剤の集積性が不十分であったためなのか、がん細胞が耐放射線性だったのかなど、その原因を究明することができず、信頼性の高い治療法を確立する上で大きな障害となっていました。また、α線は、同じ吸収線量のβ線やX線と比べて細胞殺傷能力が高いことが知られていますが、その違いは経験的にしか治療計画に反映されていませんでした。このような背景から、TATの高い細胞殺傷能力も考慮可能な標的核医学治療用線量評価システムの開発が切望されていました。
【研究の手法】
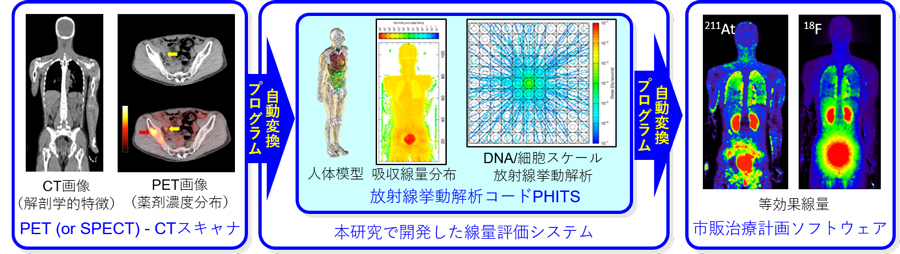
このような背景から、私たちの研究チームは、原子力機構が中心となって開発した放射線挙動解析コードPHITS3)を用いて、TATにも適用可能な標的核医学治療用の線量評価システムを開発しました。その概要を図3に示します。まず、通常の標的核医学治療と同じく、PET-CTスキャナもしくはSPECT-CTスキャナ4)で患者の解剖学的な特徴と薬剤濃度分布を測定します。そして、そのデータを本研究で開発した自動変換プログラムにより、PHITS入力形式での人体模型及び積算放射能分布に変換します。次に、その入力データをPHITSで読み込んで人体内での放射線挙動を解析し、吸収線量分布を計算します。また、DNAや細胞スケールの放射線挙動解析も実施し、α線とβ線の細胞殺傷能力の違いを理論的に推定します。最後に、計算した吸収線量分布に細胞殺傷能力の違いを考慮して、同じ効果を与えるX線治療の吸収線量(等効果線量)2)を評価し、市販の治療計画ソフトウェアで読み込める形式で出力します。開発したシステムの動作検証は、PET用核種(18F)を標識した新しいプローブ(18F-NKO-035)を健常者に投与した臨床試験結果(2019年12月24日に大阪大学大学院医学系研究科よりプレス発表)5)を用いて実施しました。
図3 本研究で開発した線量評価システムの概要
【得られた成果】
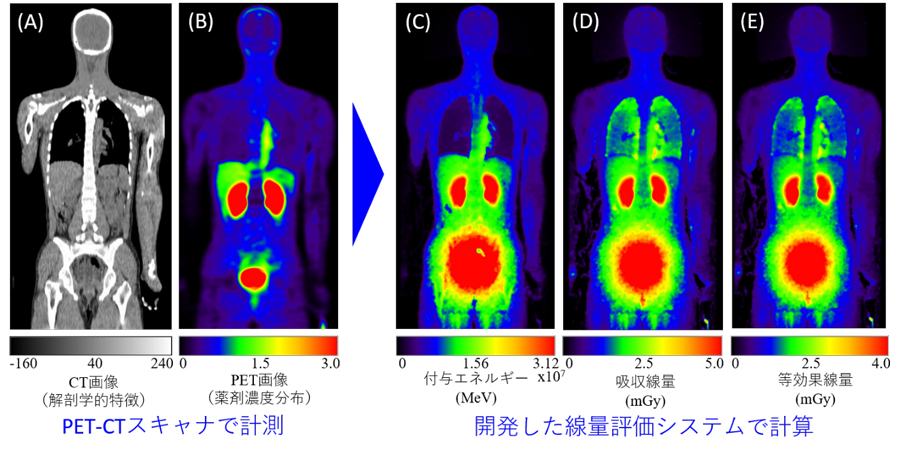
図4に、18F-NKO-035を投与した健常者に対する(A)CT及び(B)PET画像、並びにそれらのデータから本研究で開発した線量評価システムを用いて計算した(C)人体内の付与エネルギー、(D)吸収線量、(E)等効果線量を示します。図より、本システムで計算した線量分布は、薬剤濃度分布と比較して広範囲に拡がっていることが分かります。これは、18Fから放出された陽電子が人体内で消滅して透過力の高いγ線を生成しているためです。また、肺など密度の低い領域は、薬剤濃度が低くても吸収線量や等効果線量が高くなることが分かります。
図4 18F-NKO-035を投与した健常者に対する(A)CT及び(B)PET画像、並びにそれらのデータから本研究で開発した線量評価システムを用いて計算した(C)人体内の付与エネルギー、(D)吸収線量、(E)等効果線量
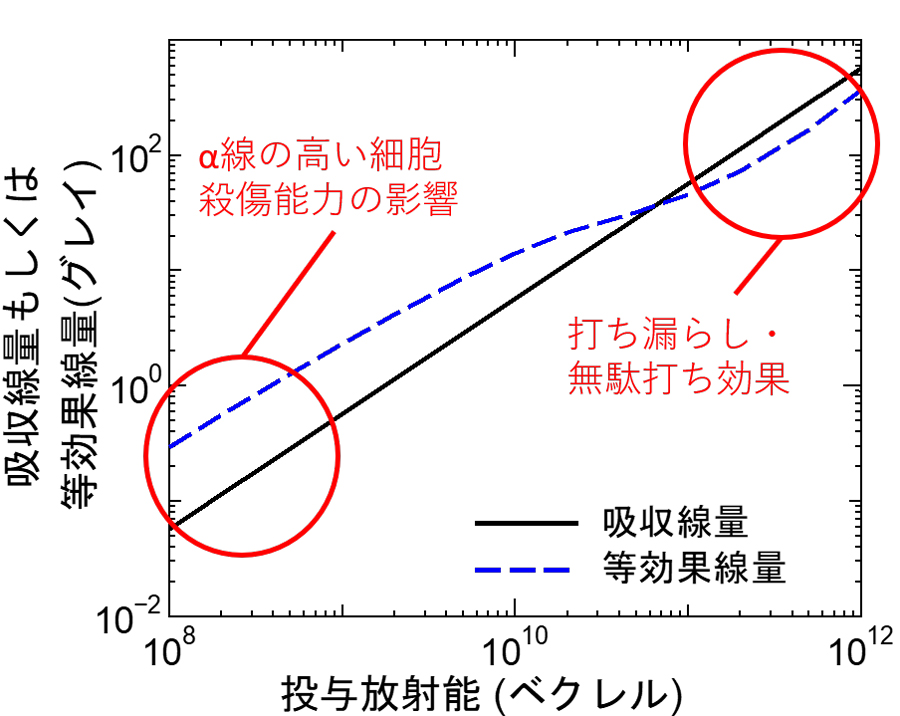
また、開発したシステムを用いて、α線源(211At)の投与放射能と吸収線量及び等効果線量の関係を推定しました。その際、人体内の薬剤濃度分布は標識する放射性核種に依存せず、18F-NKO-035の分布と同じと仮定しました。その結果を図5に示します。図より、投与放射能が少ない場合は、α線の細胞殺傷能力が高いため等効果線量は吸収線量よりも大きい、すなわちTATは同じ吸収線量のX線治療と比べて効果が高いことが分かります。一方、投与量が増えると両者の関係が逆転してしまうことも分かりました。これは、α線の飛程が短いため、投与量が増えるに従って薬剤の不均一性による「打ち漏らし・無駄打ち効果」6)が顕著に現れるためだと考えられます。したがって、本結果は、腫瘍内にできるだけ均一に拡がる薬剤開発がTATの成功のため極めて重要となることを示唆しています。
図5 α線源(211At)の投与放射能と吸収線量及び等効果線量の関係
【本研究の意義と今後の予定】
本研究により、これまで膨大に蓄積されたX線治療の臨床結果からTATの治療効果や副作用の大きさが推定できるようになり、外照射による放射線治療と同じく患者個人の個性を反映したオーダーメードの治療計画が原理的に可能となりました。しかし、その信頼性に関しては、国内におけるTAT研究が黎明期であることからまだ十分に検証されておらず、今後の課題として残っています。その課題を克服する第一歩として、まずは、近日中に大阪大学医学部附属病院で開始予定の肺がん患者を対象とした211At-NKO-035の特定臨床研究の線量評価に本システムを活用予定で、計算した等効果線量と実際の治療効果や副作用発生頻度を比較することにより、臨床研究でのPOC(Proof of Concept)取得を目指します。その後、他のがんや薬剤に対する臨床研究でも検証を実施し、最終的には、TATの標準的な治療計画システムとして、より安全で効果的な治療法の確立に役立てたいと考えています。
開発したシステムは、2021年3月頃に公開予定のPHITS次期バージョンに含まれる予定で、PHITS講習会等に参加することにより無償で入手することが可能です。本研究の一部は、科学技術振興機構・産学共創プラットフォーム共同研究推進プログラム「安全・安心・スマートな長寿社会実現のための高度な量子アプリケーション技術の創出」の一環として実施しました。
1) α線、β線、γ線、X線
放射線には様々な種類があり、それぞれ特徴が異なります。以下、その特徴をまとめます。
| 通称 | 粒子名 | 特徴 |
|---|---|---|
| α線 | ヘリウム原子核 | 透過力がほとんどなく、紙1枚で止めることができます。人体内では細胞数個分しか飛ばない代わりに、その周辺に強い電離を引き起こすため、高い細胞殺傷能力を有します。 |
| β線 | 電子もしくは陽電子 | 透過力が弱く、アルミ板1枚で止めることができます。ただし、人体内では数mm飛ぶことができるため、遠くの細胞まで攻撃してしまう場合もあります。細胞殺傷能力はそれほど高くありません。 |
| γ線 X線 |
光子 | 透過力が高く、人体を簡単に突き抜けることができます。その特徴を活かして、外照射による放射線治療で標準的に使われています。細胞殺傷能力はそれほど高くありません。 |
2) 吸収線量、等効果線量
吸収線量とは、単位質量あたりに放射線により付与されるエネルギーを表し、放射線による人体への影響を表す指標として用いられます。その単位は、Gy(グレイ)で1Gy = 1J/kgです。等効果線量は、α線などX線治療と比べて細胞殺傷能力の高い放射線による治療効果をX線治療の効果と比較するために導入された量で、通常、モデル計算などで推定したα線とX線の細胞殺傷能力の比を吸収線量に乗じて評価します。
3) PHITS
あらゆる物質中での放射線の振る舞いを第一原理的に計算するシミュレーションコード。原子力機構が中心となって開発を進めており、放射線施設の設計、医学物理計算、宇宙線科学など、工学・医学・理学の様々な分野で国内外5,000名以上のユーザーに利用されています。
参考URL (http://phits.jaea.go.jp/indexj.html)
4) CT、PET、SPECT
医療用撮影機器の一種で、CT(Computed Tomography)は、X線の吸収力から人体内の密度を測定してその解剖学的特徴を調べる装置、PET(Positron Emission Tomography)及びSPECT(Single Photon Emission Computed Tomography)は、放射性核種で標識した薬剤から放出される陽電子及びγ線をそれぞれ検出することにより、体内の薬剤濃度分布を測定する装置です。ただし、PETは、陽電子そのものを検出するわけではなく、陽電子が体内で消滅することにより生成されるγ線を検出しています。PET-CTやSPECT-CTスキャナは、CTとPETもしくはSPECTを同時に撮影可能な装置で、解剖学的特徴と薬剤濃度分布を重ね合わせた画像を取得することができます。
5) 18F-NKO-035
大阪大学が中心となって開発したがん細胞に高発現するアミノ酸トランスポーター(LAT1)に選択性の高いPETプローブ。従来のPETプローブと比較して選択的にがん細胞に集積されるため、より信頼性の高い診断が可能となると期待されています。
参考URL(http://www.med.osaka-u.ac.jp/archives/20419)
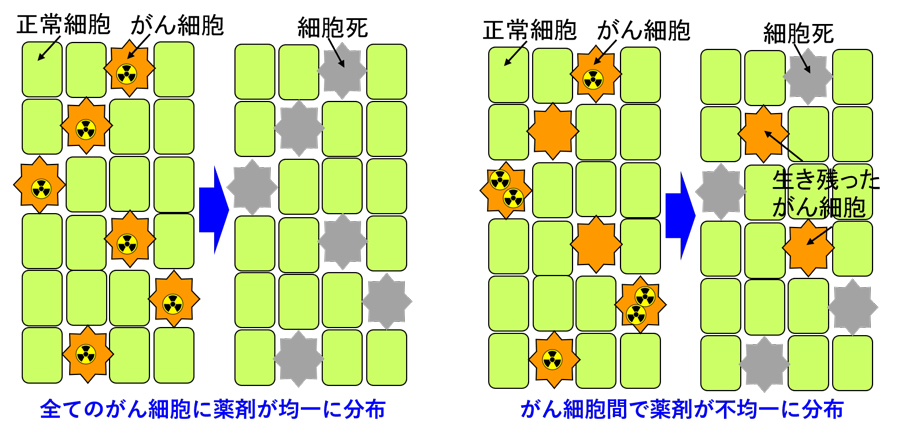
6) 打ち漏らし・無駄打ち効果
α線のように透過力が非常に弱い放射線の場合、一部のがん細胞に薬剤が集中してしまうと、高集積の細胞に無駄に多くの線量を与え低集積の細胞が生き残ってしまう打ち漏らし・無駄打ち効果が生じてしまいます。この効果は、同じく飛程の短いα線やLiイオンを使ってがん細胞を殺傷するホウ素中性子捕捉療法(BNCT)で既に報告されており、本研究により、同様の効果がTATにもあることが理論的に予測されました。
図6 打ち漏らし・無駄打ち効果の概念図。同じ数の薬剤を投与しても、右図のようにその濃度に不均一性があると一部のがん細胞が生き残ってしまいます。