2021-03-25 横浜市立大学,日本医療研究開発機構
横浜市立大学附属病院遺伝子診療科宮武聡子講師、同大学大学院医学研究科遺伝学松本直通教授、昭和大学医学部小児科学講座加藤光広教授、公益財団法人・東京都医学総合研究所脳神経回路形成プロジェクト丸山千秋プロジェクトリーダー、隈元拓馬研究員、横浜市立大学大学院医学研究科分子生物学教室廣瀬智威講師、高橋秀尚教授、同生化学教室濱田恵輔助教、緒方一博教授、同神経内科竹内英之准教授、田中章景教授を中心とする研究グループは、「多小脳回」の新たな原因遺伝子ATP1A3を同定しました。ATP1A3遺伝子は小児交代性片麻痺の原因としてよく知られていますが、本遺伝子異常による新たな疾患が明らかになり、今後、「多小脳回」の病態の解明や治療法の開発に寄与することが期待されます。
本研究成果は、米国科学誌『Science Advances』に掲載されます。(日本時間2021年3月25日午前3時付オンライン)
研究成果のポイント
- 本研究では、従来、小児交代性片麻痺*1の原因としてよく知られたATP1A3遺伝子の変異によって、「多小脳回」を主徴とする全く異なる別の疾患が起こることを明らかにした。
- 「多小脳回」を呈する124人の患者さんの全エクソーム解析*2を行い、8人の患者さん(検出頻度6.5%)で、ATP1A3遺伝子の突然変異を同定した。
- ATP1A3遺伝子で今回見つかった変異は、従来知られていた変異とは異なる病的効果を持つことが示唆され、この変異を強制発現させた胎仔マウスでは、大脳形成異常を引き起こす病態が再現された。
- 本研究で、イオンチャンネル異常と「多小脳回」の関連が示唆され、今後の「多小脳回」の病態解明や、小児神経診療における診断率の向上、治療方法の開発に寄与することが期待される。
研究の背景
胎児の脳が形成される段階で何らかの異常が生じて、大脳の表面に近い部分にある大脳皮質と呼ばれる場所が正しい形に作られない疾患を「大脳皮質形成異常症」と総称し、病的に小さい脳回(脳の表面のしわの隆起部分)が多発する「多小脳回」はその中でも比較的頻度が高い病型です。脳の形態は正常とは異なり、小さい脳回が多数できて、それらが不規則に融合した結果、いろいろな大脳皮質の形態異常を呈し、臨床的には、てんかん、知的障害、構音障害(うまく発音できない)、嚥下障害(上手に飲みこめない)など様々な神経症状が出現します。大脳皮質の形成過程では、神経細胞が脳の中を移動して、本来あるべき場所に位置します。うまく移動できなかったり、移動し終わった後の様々な形成過程の障害があるとこの疾患が生じると考えられていますが、その病態はよくわかっていません。
胎児期のある種の感染症や低酸素症などでも起こりますが、遺伝学的な原因として、細胞の骨格や移動に関わるチュブリンという分子に関連した遺伝子群をはじめ、いくつかの遺伝子が知られています。まだ明らかになっていないものも多数あると考えられているため、本研究は「多小脳回」を呈する患者さんのうち、これまで知られている「多小脳回」の原因となる遺伝子に変異を持たない患者さんのサンプルを集めて、網羅的な遺伝子解析を行い、未知の遺伝学的要因を明らかにすることを目的として実施しました。
研究の内容
「多小脳回」を呈する124人の患者さんに対して全エクソーム解析を行い、8人でATP1A3遺伝子の突然変異を検出しました(検出率6.5%)。ATP1A3遺伝子は、その変異により小児交代性片麻痺(alternating hemiplegia of childhood:AHC)、急性発症ジストニア・パーキンソニズム(rapid-onset dystonia parkinsonism:RDP)、小脳失調症・深部腱反射消失・凹足・視神経萎縮・感覚神経障害性聴覚障害(cerebellar ataxia, areflexia, pes cavus, optic atrophy, and sensorineural hearing loss:CAPOS)が起こることがよく知られている遺伝子です。これらの3つの疾患は、それぞれに特有の症状が知られていますが互いの症状にオーバーラップも見られるため、最近では、病態的な観点から1つのまとまった疾患ではないかと考えられています。しかし、今回変異が見つかった8人の患者さんは、AHC、RDP、CAPOSの症状とは合致せず、脳は形態的に異常な「多小脳回」を呈し、臨床的には非常に重篤なてんかん、精神運動発達遅滞、知的障害が認められました。特に重度の患者さんでは、進行性の脳萎縮や心臓の症状も見られるという特徴がありました(図1)。
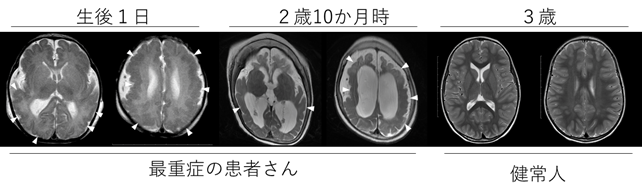
図1 患者さんで見られた脳大脳皮質形成異常(「多小脳回」)最重症の1例で、生後1日(左の2つ)、2歳10か月時(真中の2つ)に撮影された頭部MRI画像、および健常人で3歳時に撮影された頭部MRI画像(右の2つ)を示す。患者さんでは、矢頭で示した部位には、不規則で小さい脳回が見られ、大脳皮質が異常に厚くなっており、「多小脳回」と考えられる。生後1日のときに比べ、2歳10か月時では大脳が萎縮している。
今回、見つかった変異について、Na+/K+-ATPase*3のαサブユニットをコードするATP1A3遺伝子上の遺伝子変異の分布を立体的に調べると、AHC、RDP、CAPOSで報告されている変異の分布と異なり、βサブユニットとの相互作用部位に多くみられました(図2)。
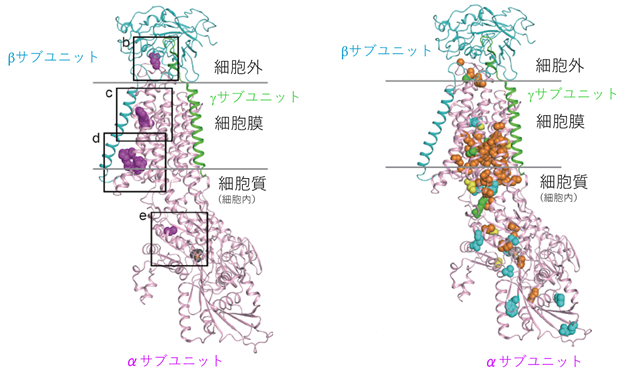
図2 Na+/K+-ATPaseのαサブユニット上における変異の分布左右の図は、アブラツノザメのNa+/K+-ATPaseの結晶構造解析のデータをもとに作成されたもの。中心に位置するピンク色の大きな構造物がNa+/K+-ATPase αサブユニット、左側~上方に位置する青い構造物がβサブユニット、右側の緑色の小構造物がγサブユニットを表している。左側の図に赤色でプロットした箇所が、今回見つかった「多小脳回」に関連する変異部分である。右側の図に、オレンジ色(AHCに関連する変異)、青色(RDPに関連する変異)、緑色(AHC、RDPの両方と関連する変異)、黄色(それ以外の症状と関連する変異)で、これまで報告された各々の疾患に関連する変異をプロットしている。今回見つかった変異は、βサブユニットとの相互作用部位に多い(左側の図のb、c、dのボックスで囲まれた領域。eのボックスは例外的に細胞質内に存在する変異を示している)。AHC、RDP、その他の症状と関連する既知変異は、βサブユニットからは遠い部位に変異が集簇している傾向がある。
また、細胞を使った実験により、「多小脳回」関連変異としてp.Gln895Proの変異がある細胞では、細胞膜におけるαサブユニットとβサブユニットとの相互作用が低下していることがわかりました(図3)。比較対象としてAHC、RDP、CAPOSで報告されている変異の中で、代表として、RDPで報告されている変異(p.Ile758Ser)について、同様の実験を行うと、RDP変異では、αサブユニットとβサブユニットとの相互作用の低下は見られませんでした。このことにより、「多小脳回」においては、Na+/K+-ATPaseのイオンチャンネルとしての機能がAHC、RDP、CAPOSとは異なる機序により障害されていることが想定されました。
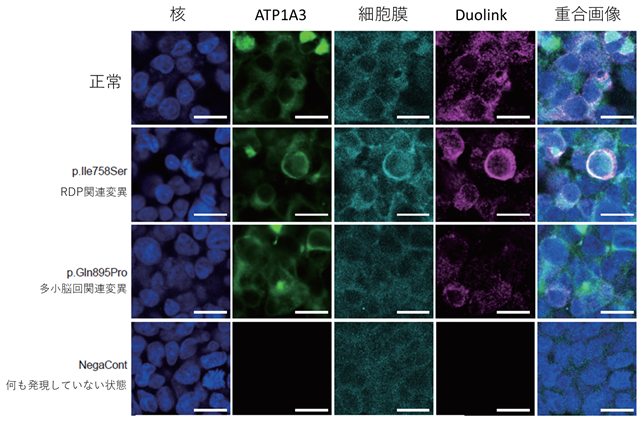
図3 細胞膜上における、Na+/K+-ATPaseのα/βサブユニットの相互作用In situ PLA fluorescence法*4を応用したDuolinkを用いて、細胞膜上でのNa+/K+-ATPaseのα/βサブユニットの相互作用を調べた。正常のATP1A3遺伝子を発現させた細胞(図の正常と書いてある行にある5つの図を見てください)、RDP関連変異をもつATP1A3遺伝子を発現させた細胞(図のRDP関連変異と書いてある行にある5つの図を見てください)に比べ、「多小脳回」関連ATP1A3遺伝子変異を発現させた細胞(図の「多小脳回」関連変異と書いてある行にある5つの図を見てください)では、細胞膜上のDuolinkシグナル(図のDuolinkと書いてある列にある上から3つの図を比較して見てください)が有意に減少しており、αサブユニットとβサブユニットとの相互作用が低下していることが確認された。(図の何も発現していない状態と書いてある行にある5つの図は、何も手を加えていない細胞の状態の場合にこれら5つの図がどう見えるかを示したもので比較対象として提示しています。)各図の右下の白線=20μm。
次に、マウスの胎仔で、今回見つかった変異のうち、最も重篤な症状を呈したATP1A3遺伝子変異を発現させると、マウスの大脳皮質の形成に関わるニューロンの移動が障害されました(図4)。
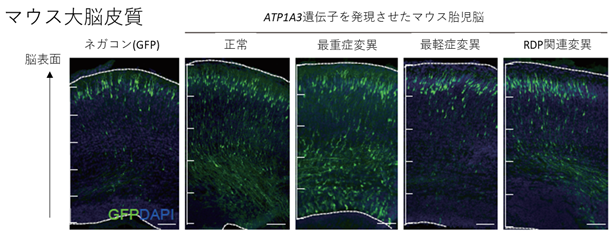
図4 ATP1A3遺伝子変異による神経細胞の移動障害胎生14.5日のマウス脳に、子宮内エレクトロポレーション法*5を用いて、ATP1A3遺伝子と蛍光たんぱく質をコードするGFP遺伝子を導入し、ATP1A3遺伝子を発現している神経細胞が緑色に光るようにしている。このコンディションで胎生18.5日の脳を観察した。神経細胞は、正常では脳表面に向かって移動し、皮質を形成することが知られている。「多小脳回」関連の最重症例に関連した変異(最重症変異)を発現させたマウス胎仔脳では、正常のATP1A3遺伝子、RDP関連変異を発現させた場合に比べて脳表面への移動が障害されている(脳の表面から遠いところに緑色に光る神経細胞が残留している)。
今後の展開
ATP1A3遺伝子の変異は、小児交代性片麻痺などの機能性の脳疾患を呈するというのがこれまでの一般的な理解でしたが、本研究成果は、本遺伝子変異によって脳形成異常を主徴とする全く別の疾患が起こることを明らかにしたものです。既知の疾患に関連したATP1A3変異では、主に脳の機能に異常をもたらすものだったのに対して、今回見つかったATP1A3変異では、主に脳の形成が異常になることが示された点が、これまでの常識を覆す成果です。また本研究で、イオンチャンネル異常と「多小脳回」の関連が示されました。今後の「多小脳回」の病態解明や、小児神経診療における診断率の向上、治療方法の開発に寄与することが期待されます。
用語説明
- *1 小児交代性片麻痺(alternating hemiplegia of childhood:AHC)、急性発症ジストニア・パーキンソニズム(rapid-onset dystonia parkinsonism:RDP)、小脳失調症・深部腱反射消失・凹足・視神経萎縮・感覚神経障害性聴覚障害(cerebellar ataxia, areflexia, pes cavus, optic atrophy, and sensorineural hearing loss:CAPOS)
- これらはすべてATP1A3遺伝子に変異があるとおこる疾患として知られている。それぞれに特有の症状が知られているが互いの症状にオーバーラップも見られるため、最近では、病態的な観点からは1つのまとまった疾患ではないかと考えられている。これらの疾患を持つ患者さんのうち、90%以上の患者さんでは、頭部MRIでは脳の異常は見られないとされている。
- 小児交代性片麻痺(AHC)
- 生後18か月ごろまでに、体が麻痺するような発作が、突然に、何回も起こることで発症する。麻痺は体の左右どちらか片側だけのこともあれば、反対側に移動する(交代性)こともある。また両側にでることもある。体が自分の意思とは無関係に固く不自然な形でこわばったり(ジストニア)、眼球の異常運動がみられたり、血圧や脈拍数、発汗などが不安定になったりといった自律神経症状を認めることがある。また発達障害、進行性の認知機能障害を合併することがある。寝ているときは、こうした発作性の症状が緩和する特徴がある。
- 急性発症ジストニア・パーキンソニズム(RDP)
- 発症年齢は4~58歳と報告されている。急性に発症し、自分の意思とは関係なく異常に力が入ってジストニアや、パーキンソン病で見られるような特有の症状を示す。
- 小脳失調症・深部腱反射消失・凹足・視神経萎縮・感覚神経障害性聴覚障害(CAPOS)
- 脳の中の小脳と呼ばれる部分の障害によって、乳児期~小児期に、発作的に何回も、体のバランス感覚が障害されて、ふらつくなどの症状を呈する(小脳失調の症状)。進行性に視力が障害されたり(視神経萎縮)や耳の聞こえが悪くなる(感覚神経障害性聴覚障害)場合がある。30%程度の患者さんには甲高な足の形(凹足)が観察される。
- *2 全エクソーム解析
- ゲノムの蛋白質を決める部分(エクソン)のDNA配列を次世代シーケンサーを用いて網羅的に解析する方法。
- *3 Na+/K+-ATPase
- Na+/K+-ATPaseは、イオンチャンネルの名前であり、このチャンネルは、動物の細胞であれば、どんな細胞でも持っているような基本的なイオンチャンネルである。このチャンネルはαサブユニット、βサブユニット、(時にはγサブユニットも)からできていて、細胞膜に局在している。このチャンネルは、Na+イオン3つを細胞外にくみ出すと同時に、K+イオン2つを細胞内に取り込む働きを持つ。ATP1A3遺伝子は、αサブユニットの中でα3と呼ばれるタイプのαサブユニットをコードしていて、ヒトの脳の神経細胞に発現していることが知られている。
- *4 In situ proximity ligation assay(PLA)fluorescence法
- 例えば、αサブユニットとβサブユニットに結合する性質を持つ、2つの抗体を準備する。この抗体に、それぞれ短い紐状の目印を付けておく。この紐状の目印は、互いに近くにあると(40nm以内の範囲に近接すると)、絡みついて1つの小さいリングのようになって結合し蛍光を発する性質がある。今、αサブユニットとβサブユニットが発現している細胞の標本上にこの2つの抗体を振りかけた場合、αサブユニットとβサブユニットが細胞膜上で互いに近接していると、2つの抗体が細胞内でたがいに近接するので、それぞれの抗体につけておいた紐状の目印がリング状に結合し蛍光を発するのが、点状に光って見えることになる。1つ1つの蛍光の点を数えたり、光の強さを調べたりすることで、αサブユニットとβサブユニットの結合の度合いがわかる仕組みである。
- *5 子宮内エレクトロポレーション法
- 哺乳類は、母体の子宮の中で、出産するまでの間、赤ちゃん(胎仔)を育てている。この実験は、DNAを含む液を外から子宮内の胎仔脳室に注入しておいて、胎仔の頭部をピンセットの形をした電極で挟み、電気刺激を与える。この電気刺激によって、DNA分子が赤ちゃんの脳に入り、その遺伝子が発現することで、脳にどのような変化が生じるかを調べることができる手法である。
掲載論文
- 論文タイトル
- De novo ATP1A3 variants cause polymicrogyria
- 著者
- Satoko Miyatake1,2, Mitsuhiro Kato3, Takuma Kumamoto4, Tomonori Hirose5, Eriko Koshimizu1, Takaaki Matsui6, Hideyuki Takeuchi7, Hiroshi Doi7, Keisuke Hamada8, Mitsuko Nakashima1,9, Kazunori Sasaki5, Akio Yamashita5, Atsushi Takata1, 10, Kohei Hamanaka1, Mai Satoh1, Takabumi Miyama1, Yuri Sonoda11, Momoko Sasazuki11, Hiroyuki Torisu11,12, Toshiro Hara11,13, Yasunari Sakai11, Yushi Noguchi14, Mazumi Miura14, Yoko Nishimura15, Kazuyuki Nakamura16, Hideyuki Asai3, Nodoka Hinokuma3, Fuyuki Miya17,18,19, Tatsuhiko Tsunoda17,18,19, Masami Togawa20, Yukihiro Ikeda21, Nobusuke Kimura22, Kaoru Amemiya23, Asako Horino24, Masataka Fukuoka24, Hiroko Ikeda24, Goni Merhav25, Nina Ekhilevitch26, Masaki Miura27, Takeshi Mizuguchi1, Noriko Miyake1, Atsushi Suzuki28, Shouichi Ohga11, Hirotomo Saitsu1,9, Hidehisa Takahashi5, Fumiaki Tanaka7, Kazuhiro Ogata8, Chiaki Ohtaka-Maruyama4 and Naomichi Matsumoto1
- 所属
-
- Department of Human Genetics, Yokohama City University Graduate School of Medicine, Yokohama, Kanagawa 236-0004, Japan.
- Clinical Genetics Department, Yokohama City University Hospital, Yokohama, Kanagawa 236-0004, Japan.
- Department of Pediatrics, Showa University School of Medicine, Tokyo 142-8666, Japan.
- Developmental Neuroscience Project, Department of Brain & Neurosciences, Tokyo Metropolitan Institute of Medical Science, Tokyo 156-8506, Japan.
- Department of Molecular Biology, Yokohama City University Graduate School of Medicine, Yokohama, Kanagawa 236-0004, Japan.
- Gene Regulation Research, Nara Institute of Science and Technology, Ikoma, Nara 630-0101, Japan.
- Department of Neurology and Stroke Medicine, Yokohama City University Graduate School of Medicine, Yokohama, Kanagawa 236-0004, Japan.
- Department of Biochemistry, Yokohama City University Graduate School of Medicine, Yokohama, Kanagawa 236-0004, Japan.
- Department of Biochemistry, Hamamatsu University School of Medicine, Shizuoka 431-3192, Japan.
- Laboratory for Molecular Pathology of Psychiatric Disorders, RIKEN Center for Brain Science, Wako, Saitama 351-0198, Japan
- Department of Pediatrics, Kyushu University, Fukuoka 812-8582, Japan.
- Section of Pediatrics, Department of Medicine, Fukuoka Dental College, Fukuoka 814-0193, Japan.
- Fukuoka Children’s Hospital, Fukuoka 813-0017, Japan.
- Division of Pediatrics and Perinatology, Faculty of Medicine, Tottori University, Yonago 683-8503, Japan.
- Division of Child Neurology, Institute of Neurological Sciences, Faculty of Medicine, Tottori University, Yonago 683-8503, Japan.
- Department of Pediatrics, Yamagata University Faculty of Medicine, Yamagata 990-9585, Japan.
- Department of Medical Science Mathematics, Medical Research Institute, Tokyo Medical and Dental University, Tokyo 113-8510, Japan.
- Laboratory for Medical Science Mathematics, RIKEN Center for Integrative Medical Sciences, Yokohama, Kanagawa 230-0045, Japan.
- Laboratory for Medical Science Mathematics, Department of Biological Sciences, Graduate School of Science, The University of Tokyo, Tokyo 113-0033, Japan.
- Department of Pediatrics, Tottori Prefectural Central Hospital, Tottori 680-0901, Japan.
- Department of Neonatology, Japanese Red Cross Otsu Hospital, Otsu, Shiga 520-8511, Japan.
- Department of Pediatrics, Naniwa Ikuno Hospital, Osaka, Shiga 556-0014, Japan.
- Department of Pediatrics, Saiwai Kodomo Clinic, Tachikawa 190-0002, Japan.
- Shizuoka Institute of Epilepsy and Neurological Disorders, Shizuoka 420-8688, Japan.
- Radiology Department, Rambam Health Care Campus, Haifa 3109601, Israel.
- The Genetics Institute, Rambam Health Care Campus, Haifa 3109601, Israel.
- Department of Pediatrics, Nagaoka Red Cross Hospital, Nagaoka, Niigata 940-2085, Japan
- Molecular Cellular Biology Laboratory, Yokohama City University Graduate School of Medical Life Science, Yokohama, Kanagawa 236-0004, Japan.
- 掲載誌
- Science Advances(2021)
- DOI
- 10.1126/sciadv.abd2368
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)の難治性疾患実用化研究事業「新技術を用いた難治性疾患の高精度診断法の開発」(研究代表者:松本直通)、厚生労働省、日本学術振興会、武田科学振興財団、内藤記念科学振興財団、サントリー生命科学財団の支援により実施されました。
お問い合わせ先
本資料の内容に関するお問い合わせ
横浜市立大学 学術院医学群 遺伝学 教授 松本直通
取材対応窓口、詳細の資料請求など
横浜市立大学 広報室 担当課長 上村一太郎
AMEDの事業について
国立研究開発法人日本医療研究開発機構
ゲノム・データ基盤事業部 医療技術研究開発課