2021-03-25 東京大学,日本医療研究開発機構
発表者
佐藤謙一郎(東京大学医学部附属病院 医師/日本学術振興会 特別研究員)
岩坪威(東京大学大学院医学系研究科 神経病理学 教授)
発表のポイント
- ウェブ上での簡単なテストにより、アルツハイマー病の前駆状態(プレクリニカル期(注1))に該当する可能性を予測するアルゴリズムを開発した。
- プレクリニカル期に該当するかどうかについてのスクリーニング効率を高めることが期待できる。
- アルツハイマー病の根本治療薬の開発促進につながる。
発表概要
東京大学大学院医学系研究科・佐藤謙一郎医師、岩坪威教授らのグループは、「ウェブ上での簡単なテスト(J-TRC(ジェイ・トラック) – 認知症予防薬の開発をめざすインターネット登録研究 )により、アルツハイマー病の前駆状態に該当する可能性を予測する」アルゴリズムを開発しました。アルツハイマー病に対する根本治療薬の開発において、認知機能が低下する前の前駆期に薬剤を投与することが重要と考えられるようになってきています。このアルツハイマー病前駆期(プレクリニカル期)に該当する方を適切に見出していくことが臨床試験を実施する上で必要になりますが、それに要する労力・コストがかかることが壁となっていました。本研究によってアルツハイマー病前駆期に該当するかどうかについてのスクリーニング効率を高めることが期待でき、ひいてはアルツハイマー病の根本治療薬の開発促進に貢献しうるものと考えられます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)・認知症研究開発事業における研究開発課題「認知症プレクリニカル期・プロドローマル期を対象とするトライアルレディコホート構築研究」(研究開発代表者:岩坪威)の一環として行われました。
本研究成果は、2021年3月24日に国際学術誌「Alzheimer’s & Dementia: Translational Research & Clinical Interventions」にオンライン掲載されます。
発表内容
背景
認知症の原因の約7割を占めるアルツハイマー病は、日本国内だけでも患者さんの数は2021年現在で600万人以上とも言われ、その根本的な治療法(疾患修飾薬(注2))の開発が急務です。アルツハイマー病が起きるメカニズムには今なお未解明な点が残されていますが、脳内にアミロイドβ(注3)という異常たんぱく質が貯まっていくことが最初のきっかけとして重要と考えられています。、物忘れなどの認知症状が始まる10~20年以上前からアミロイドβが蓄積してきていることが最近の研究で明らかになってきました。無症状ながらアミロイドβが蓄積している、いわば発症前の前駆状態の時期を、「プレクリニカル期」と呼び、この時期に治療を開始することで、根本的な治療が可能になるのではないかと近年考えられるようになってきました。2021年現在、このプレクリニカル期の方を対象として、アルツハイマー病の根本治療薬の開発を目指したいくつかの臨床試験が世界的に始められています。
一般に60~70代以上の方の約4~5人に1人程度はこのプレクリニカル期に該当すると見積もられていますが、プレクリニカル期の方は基本的にほとんど認知機能の低下症状がないため、臨床試験の対象となる方をどうやって見つけ出していくかは大きな課題です。脳内のアミロイドβの蓄積を判定するためには専用の脳PET検査等を行う必要がありますが一部の専門施設でしか可能でなく、また保険適応もなくきわめて高価な検査である等の理由から、簡単にできる検査ではありません。また認知機能が一定以上低下している方は臨床試験の対象になりにくいため、認知機能の状態を正確に判断するための専門的な心理検査も必要で、こちらも手軽にできるものではありません。ところが、プレクリニカル期に該当するのは上述のように約5人に1人程度ですから、手がかりなく闇雲に検査をしてしまえば、PET検査や心理検査などの詳しい検査をせっかく行っても無駄になってしまう、という懸念もありました。
研究成果
そこで我々は、このプレクリニカル期に該当する方を、インターネット上で年齢・性別などの他に簡単な認知機能検査などを行うことによって予測できるアルゴリズムを作成し、活用を開始しました(図1)。この簡単な認知機能検査をスクリーニングとして活用できるため、約5人にPET検査を行って、うち1人のプレクリニカル期の方を初めて見いだせるところを、より少ない人数のPET検査で済む、という資源効率的・費用経済的な効果が得られると期待されます。またウェブ上で完結してスクリーニング評価が行えるため、これまで対面での検査・聞き取りが中心であった従来型の臨床研究よりも多くの方に気軽にご参加いただいて、ご自身の認知機能に関心を持って頂く効果も期待できます。
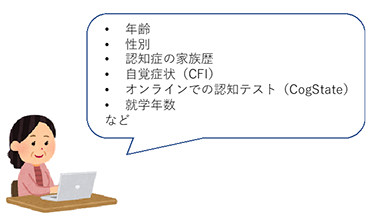
図1 インターネット上における簡単な認知機能検査吹き出しにある項目を加え、他に簡単な認知機能検査をインターネット上で実施。
CFIは「認知機能インデックス」の略。1年前と比較した自覚的な認知機能の変化について回答する。
この成果は、2019年秋から開始している「J-TRCウェブスタディ」(注4、https://www.j-trc.org )に登録いただいた約3,000人のデータに適用し、その中でプレクリニカル期に該当する可能性が高いと推測された方から順に、2020年秋からJ-TRCウェブスタディにつづく段階である「J-TRCオンサイト研究」(注5)へ参加をご案内する上での参考指標として活用を開始しています(図2)。
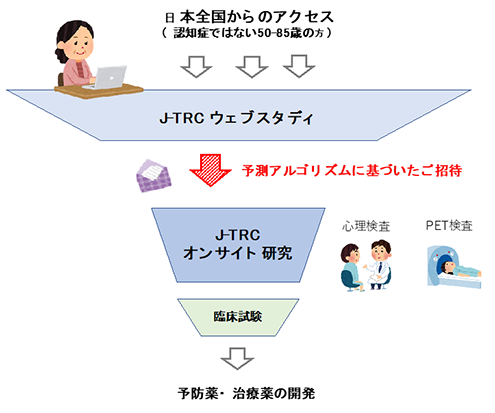
図2 開発した予測アルゴリズムのJ-TRCオンサイト研究への参加指標としての活用
この予測アルゴリズムは、プレクリニカル期の方を対象に、抗アミロイドβ抗体医薬を投与する国際的な官民パートナー型臨床試験「A4研究」(注6)のためのスクリーニングの過程で得られた公開データを学習データとして用いて構築しています。J-TRCウェブスタディ参加者のうち、一部の方の過去のPET検査結果と、本アルゴリズムによるアミロイド蓄積の程度に対する予測結果とを照合すると、AUC(注7)0.81程度とある程度良好なアルゴリズムの予測能が得られました。このアルゴリズムにおいては、年齢が高い、自覚症状(CFIスコア)が強い、あるいは認知症の家族歴がある方のほうがアミロイド蓄積の程度がより強い傾向にありました。一方で、性別や就学年数はあまり影響しないという傾向がありました。訓練データは大部分が米国人のデータで構成されているなどの限界点もありますが、本アルゴリズムを日本人に対して用いることにも、一定程度の妥当性があるものと考えられます。
図3 開発した予測アルゴリズムの精度評価
今後の展開
本アルゴリズムによる予測が最終的にどの程度正しいものであるか、またこのアルゴリズムを利用することによりプレクリニカル期アルツハイマー病の方の正しい診断が可能となるかは現在未だ不明であり、今後の研究から解答が得られるものと考えられます。本アルゴリズムの限界点も踏まえながら、精度を検証、また性能を継続的に向上させることにより、将来的に、プレクリニカル期に対する汎用性のある予測アルゴリズムが構築できるものと期待されます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)・認知症研究開発事業の研究開発課題「認知症プレクリニカル期・プロドローマル期を対象とするトライアルレディコホート構築研究」(研究開発代表者:岩坪威)の支援により行われました。
発表雑誌
- 雑誌名
- Alzheimer’s & Dementia: Translational Research & Clinical Interventions(オンライン版)
- 論文タイトル
- Predicting amyloid risk by machine learning algorithms based on the A4 screen data: application to the Japanese Trial-Ready Cohort study.
- 著者
- Kenichiro Sato, Ryoko Ihara, Kazushi Suzuki, Yoshiki Niimi, Tatsushi Toda, Gustavo Jimenez-Maggiora, Oliver Langford, Michael C. Donohue, Rema Raman, Paul S. Aisen, Reisa A. Sperling, Atsushi Iwata, Takeshi Iwatsubo
- DOI番号
- 10.1002/trc2.12135
用語解説
- (注1)プレクリニカル(期)AD
- 画像診断やバイオマーカーにより脳にアミロイドβ蓄積などADの病理学的変化の存在が疑われるが、認知機能は正常である状態をいう。MCI期(プロドローマル)ADと正常の中間状態とも考えられ、今後開発されるADの疾患修飾療法(疾患発症のメカニズムに基づく根本治療法)の最適な対象となるものと期待されている。
- (注2)疾患修飾薬
- 疾患の発症メカニズムに作用し、疾患の進行過程を遅延させる治療薬。ADに対する抗アミロイドβ薬などがその代表例。
- (注3)アミロイドβ
- アルツハイマー病主病変の1つであり、の大脳皮質などの神経細胞の外側の空間に線維状に蓄積し、その過程で神経細胞の変性・細胞死を招く原因となるタンパク質。最近、PETスキャンや脳脊髄液・血液検査などで脳内蓄積が推定可能となり、症状出現の十数年前のプレクリニカル期から蓄積がはじまることから、アルツハイマー病の予防、治療の標的分子として重要視されている。
- (注4)J-TRCウェブスタディ
- インターネットを介して認知機能やアルツハイマー病のリスク因子を調べ、より詳細な研究や治験に導くための臨床研究登録システム。2019年11月より開始され、現在までに5500名の登録を得ている。50~85歳までの方々がインターネットを介してホームページ(https://www.j-trc.org )から同意の取得、基本情報登録の後に、15分程度で実施可能な2種類の認知機能(記憶・思考力)テスト(認知機能指標:CFIとCogstate(コグステート))を受検、以降、3ヶ月ごとにインターネット上で検査を反復し、経時的なスコアの変化等に基づき追跡検査を行い、セルフモニタリングとしても活用いただく。将来的なAD発症のリスク上昇が疑われる方については、ご希望に応じて、医療研究機関に来院して行う第2段階の研究(J-TRCオンサイト研究)への参加を案内する。
- (注5)J-TRCオンサイト研究
- 脳にアミロイドβ蓄積が始まっているが認知機能が正常範囲にある「プレクリニカル期」の方を、アミロイドPET、血液検査、認知機能検査などで同定し、予防治験に導くための「治験即応コホート」を構築する研究。J-TRCウェブスタディから招聘された方を中心に、東京大学、国立精神・神経医療研究センター、国立長寿医療研究センター、都健康長寿医療センター、東北大、大阪大、神戸大などの主要医療機関で実施し、現在までに180名の登録と研究ならびに治験への紹介が進んでいる。
- (注6)A4研究
- プレクリニカル期のADの人を対象として、2014年に北米で開始されたADの薬剤予防治験。ADの病因タンパク質と考えられるアミロイドbに対する抗体医薬「ソラネズマブ」を、PETによるアミロイド陽性、認知機能が正常な参加者に4.5年間にわたり投与し、鋭敏な認知機能指標「Preclinical Alzheimer Cognitive Composite」(4種の認知機能検査の総合スコア)の改善により効果を判定する。日本では東京大学の当J-TRC研究の主要メンバーにより遂行中であり、2022年に効果判定が予定される。米国ではNIAの支援を受け、A4研究と同時期を対象とするA45研究、さらに先行する段階を対象とするA3研究が開始される。
- (注7)AUC
- area under the curveの略。ある指標の判別能をあらわす統計学的数値であり、0から1までの値をとる。判別能がランダムであるときAUC=0.5となり、その値が1に近いほど判別能が高いことを示す。
お問い合わせ先
研究内容に関するお問い合わせ先
東京大学 大学院医学系研究科
脳神経医学専攻 神経病理学分野
教授 岩坪威(いわつぼたけし)
取材に関するお問い合わせ先
東京大学 大学院医学系研究科 総務係
AMED事業について
国立研究開発法人日本医療研究開発機構(AMED)
ゲノム・データ基盤事業部 医療技術研究開発課