2021-04-06 理化学研究所
理化学研究所(理研)生命医科学研究センター骨関節疾患研究チームの池川志郎チームリーダー、郭竜研究員らの共同研究グループは、新たなタイプの骨の難病である「Ikegawa型頭蓋管状骨異形成症(Craniotubular dysplasia, Ikegawa type)」を発見し、その原因遺伝子TMEM53[1]を同定しました。
本研究成果は、骨の希少遺伝病や難病の治療法の開発、および骨形成シグナルの核膜での制御機構の解明につながると期待できます。
池川志郎チームリーダーらは、遺伝性難病の医療と研究のために「骨系統疾患コンソーシウム」を設立し、原因遺伝子が未知の骨関節難病の臨床データを全世界から収集しています。
今回、共同研究グループは、収集データの中に新たな疾患だと考えられる特徴的な骨格異常を持つ4家系5人の患者を発見しました。全エクソームシーケンス解析[2]により遺伝子変異を探索したところ、患者全員がTMEM53遺伝子の両方の対立遺伝子座位(アレル)[3]に遺伝子の機能喪失を引き起こすと考えられる変異を持つことが分かりました。TMEM53は細胞内の核膜外層に存在するタンパク質です。その機能やヒトの骨格形成における役割は分かっていませんでした。ノックアウトマウスなどを用いた機能解析により、TMEM53はBMP[4]シグナルを伝達するリン酸化SMAD[5]1/5/9が細胞質から核内に移行するのを制御する”門番”の役目をしていること、そしてその制御機能不全が新しい疾患の多彩な表現型を作り出していることを示しました。
本研究は、科学雑誌『Nature Communications』オンライン版(4月6日付)に掲載されます。
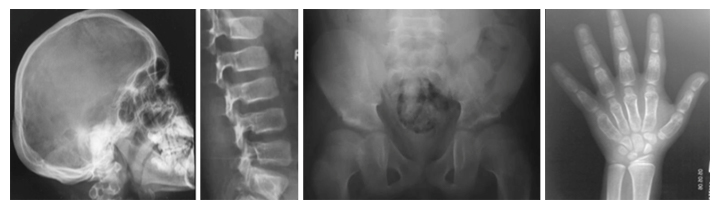
新たなタイプの骨の難病、Ikegawa型頭蓋管状骨異形成症のレントゲン像
背景
骨、関節をはじめとする運動器には、多くの遺伝性難病があります。池川志郎チームリーダーらは、運動器の遺伝性難病の原因遺伝子の同定を出発点に、原因遺伝子とその変異の機能解析を通じて、画期的な診断法・治療法を開発するとともに、骨格、運動器の成長・発達・維持のメカニズムを解明することを目指しています。これまで、29の運動器疾患の原因遺伝子を世界に先駆けて発見し、その分子病態を明らかにしてきました注1)。
また、運動器の遺伝性難病の医療と研究のために「骨系統疾患コンソーシウム」を設立し注2)、骨格、運動器の遺伝性難病の臨床データを世界中から収集してきました。その中に、共通の骨格異常を持つ4家系5人の患者を発見しました。これらの患者には、頭蓋骨の骨濃度の上昇、脊椎の形成異常、長管骨と短管骨の骨幹部の拡大などの特徴的な異常が認められました(図1)。このような骨格異常の組み合わせは過去に報告がなく、新たな疾患として「Ikegawa型頭蓋管状骨異形成症(Craniotubular dysplasia, Ikegawa type)」と名付けました。
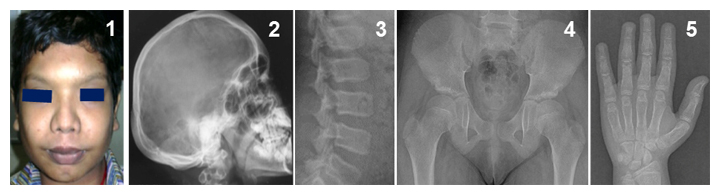
図1 Ikegawa型頭蓋管状異形成症の表現型
頭蓋骨と管状骨(長管骨、短管骨)の肥厚、骨濃度の上昇などの特徴が見られる。
1前額部突出、眼間距離の拡大など特徴的な顔貌。
2-5特徴的なX線像。2肥厚した頭蓋骨、3脊椎椎体の扁平化、4大腿骨骨幹端部の短縮、5手の短管骨の骨幹部の拡大。
注1)池川志郎.整形外科領域のケノム解析. 整形外科71(6):716-9, 2020.
注2)骨系統疾患コンソーシウム
研究手法と成果
この新たな疾患の原因遺伝子を同定するため、共同研究グループはまず、全エクソームシーケンス解析を用いて4家系(家系A~D)の遺伝子変異を探索しました。その結果、5人の患者全員がTMEM53タンパク質(transmembrane protein 53)をコードするTMEM53遺伝子の両方の対立遺伝子座位(アレル)に変異と思われる塩基配列の変化(劣性機能喪失変異)を持つことが分かりました。
TMEM53は核膜の外層に存在するタンパク質ですが、その機能や骨格形成や運動器疾患との関係についてはこれまで全く分かっていませんでした。家系Aには4塩基の挿入(c.222_223insCATG)、家系B~Dには3塩基の欠失(c.62-5_62-3delTTC)があり、全ての患者はホモ接合体[6]でした。これら二つの変異の機能解析を行ったところ、いずれもTMEM53遺伝子の機能を喪失する変異であることが分かりました。
そこで、Tmem53のノックアウトマウス(Tmem53-KOマウス)を作製し、その表現型を詳しく解析しました。ゲノム編集[7]により作製した3種類のKOマウスは、成長パターン、外見、骨格異常などいずれも患者と非常によく似た表現型を示しました(図2)。
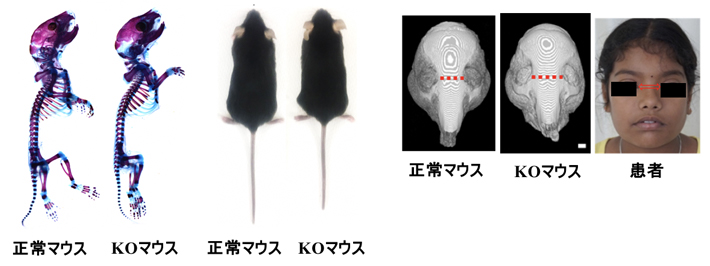
図2 Tmem3ノックアウト(KO)マウスの表現型
Tmem3-KOマウスには、成長障害、顔貌異常(眼間開離など)などの骨格異常が見られる。これは、患者と極めてよく似た描像である。
次に、Tmem53-KOマウスの頭蓋骨の骨芽細胞の網羅的RNAシーケンスデータをもとにビッグデータ解析を行ったところ、Tmem53-KOマウスでは、骨形成の主要なシグナルの一つであるBMPシグナルが増加していることが分かりました。そこで、TMEM53遺伝子をノックアウトしたヒト細胞株を作製し、BMPシグナルの異常を調べました。すると、BMPシグナルを細胞質から細胞核内に伝達するメディエーターであるリン酸化SMAD1/5/9というタンパク質が、TMEM53-KO細胞の核内で増加していることが分かりました。
リン酸化SMADなど細胞内のシグナルのメディエーターが細胞質から核内へ移行するには、核膜孔を通過しなければなりません。TMEM53は核膜孔において細胞核へのSMADの蓄積を防ぐことで、特異的にBMP-SMADシグナルの伝達を阻害する、いわば”門番”の役目をしていると考えられます。そのため、TMEM53遺伝子に変異が起こると、BMPシグナルが過剰に活性化され、骨芽細胞の分化が促進された結果、新たな疾患の多彩な表現型が作り出されていると考えられます(図3)。
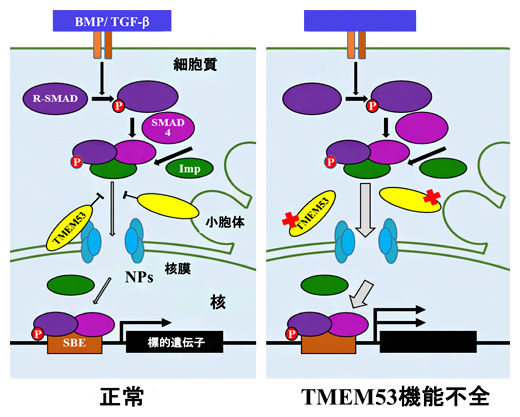
図3 TMEM53の役割の概念図
ImpはImportin(核輸送タンパク質)、NPはNucleoporin(核膜孔タンパク質)、SBEはSmad binding element(ゲノム上でSMADが結合する転写制御部位)を示す。TMEM53タンパク質は、核膜孔の外面で、細核へのSMADの移動を防ぐことで、特異的にBMP-SMADシグナルの伝達を阻害する”門番”の役目をしている。
今後の期待
次世代シーケンサー[8]を駆使した大規模シーケンス解析は、医療・医学分野においては、これまで原因が分からなかった希少遺伝病や難病の原因遺伝子の発見に、また生命科学分野においては、これら難病発症の裏に潜む未知の生命機構の発見に力を発揮しています。同様のアプローチにより、今後も多くの原因遺伝子が発見され、その遺伝子の変異の機能解析により、疾患の分子病態が明らかになり、画期的な治療法・予防法の開発や新たな生命機構が解明されると考えられます。
多くの細胞内シグナル分子は、核膜孔を通過するため、そこで、特異的、非特異的に制御されるはずです。しかし、これまでその制御過程にTMEM53のような核膜タンパク質がどのように関わっているかは分かっていませんでした。本発見をもとに、核膜孔での細胞内シグナルの制御機構の解明が進展すると期待できます。
補足説明
1.TMEM53
核膜の外層に存在するTMEM53タンパク質をコードする遺伝子。TMEM53の機能、ヒトの骨格における役割については分かっていなかった。transmembrane protein 53の略。
2.全エクソームシーケンス解析
大規模疾患遺伝子解析の手法の一つ。ゲノムの中のタンパク質に関する情報を含むエクソン部分(ゲノム全体の約3%)とその周辺のイントロン部分を、次世代シーケンサーを使って、網羅的包括的にシーケンスして解析する。
3.対立遺伝子座位(アレル)
哺乳類は母親と父親から同じ遺伝子セットを持つ染色体を1組ずつ受け継ぐ。この両親から受け継いだ1対の遺伝子セットを対立遺伝子座またはアレルと呼ぶ。
4.BMP
骨格形成に関与する一群のタンパク質(成長因子ファミリー)の総称。トランスフォーミング増殖因子β(TGF-β)スーパーファミリーに属している。BMPの細胞内のシグナルは、SMADによって伝えられる。BMPはbone morphogenic proteinの略。
5.SMAD
TGF-βスーパーファミリーの成長因子のシグナルを細胞内で伝達する一群の細胞内タンパク質。SMAD は、sma and mad (mothers against decapentaplegic) の略。
6.ホモ接合体
ある遺伝子の二つの対立遺伝子に同一の変異を持つ個体のこと。
7.ゲノム編集
核酸分解酵素(ヌクレアーゼ)などを部位特異的に作用させることで、遺伝情報を改変する技術。
8.次世代シーケンサー
9.
1990年代に普及した、サンガー法に基づく蛍光キャピラリー・シーケンサー以後に開発された、DNAシーケンサーの総称。従来の方法に比べ、超大量のDNAシーケンス反応を並列して行うことができる。
共同研究グループ
理化学研究所 生命医科学研究センター
骨関節疾患研究チーム
研究員 郭 竜(ゴウ・ロン)
研究員 王 錚(ワン・ジェン)
客員研究員(研究当時) 王 娟(ワン・ジェン)
大学院生リサーチ・アソシエイト 薛 婧怡(シュエ・チンイ)
チームリーダー 池川 志郎(いけがわ しろう)
免疫器官形成研究チーム
チームリーダー 古関 明彦(こせき はるひこ)
客員技師 長谷川 孝徳(はせがわ たかのり)
専門技術員 飯塚 裕介(いいずか ゆうすけ)
広島大学大学院医系科学研究科 生体分子機能学
教授 宿南 知佐(しゅくなみ ちさ)
東京医科歯科大学大学院医歯学総合研究科
分子情報伝達学
教授 中島 友紀(なかしま ともき)
分子発生学分野
講師 武智 正樹(たけち まさき)
教授 井関 祥子(いせき さちこ)
横浜市立大学大学院医学研究科 遺伝学
教授 松本 直通(まつもと なおみち)
准教授 三宅 紀子(みやけ のりこ)
研究支援
本研究は、日本医療研究開発機構(AMED)の難治性疾患実用化研究事業「希少難病の高精度診断と病態解明のためのオミックス拠点の構築」、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「メカニカルストレス病の原因遺伝子の同定(研究代表者:池川志郎)」による支援を受けて行われました。
原論文情報
Long Guo, Aritoshi Iida, Gandham SriLakshmi Bhavani, Kalpana Gowrishankar, Zheng Wang, Jing-yi Xue, Juan Wang, Noriko Miyake, Naomichi Matsumoto, Takanori Hasegawa, Yusuke Iizuka, Masashi Matsuda, Tomoki Nakashima, Masaki Takechi, Sachiko Iseki, Shinsei Yambe, Gen Nishimura, Haruhiko Koseki, Chisa Shukunami, Katta M. Girisha, Shiro Ikegawa, ” Deficiency of TMEM53 causes a previously unknown sclerosing bone disorder by dysregulation of BMP-SMAD signaling”, Nature Communications, 10.1038/s41467-021-22340-8
発表者
理化学研究所
生命医科学研究センター 骨関節疾患研究チーム
理化学研究所 生命医科学研究センター 骨関節疾患研究チーム
研究員 郭 竜(ゴウ・ロン)
チームリーダー 池川 志郎(いけがわ しろう)
報道担当
理化学研究所 広報室 報道担当