2021-07-29 京都大学大学院医学研究科,HiLung株式会社,株式会社セルファイバ,日本医療研究開発機構
概要
呼吸器疾患領域には、数多くの難治性疾患が存在します。外科的肺移植以外の有効な治療法がないため、細胞治療などの肺再生医療へのニーズが高まっています。ヒトiPS細胞は再生医療において有用なツールですが、これまでヒトiPS細胞由来細胞を肺に移植して肺胞上皮細胞として生着させた論文報告はありませんでした。
京都大学大学院医学研究科 呼吸器疾患創薬講座 後藤慎平特定准教授、同医学部附属病院呼吸器内科 池尾聡医員、同呼吸器疾患創薬講座 山本佑樹特定助教(当時・現HiLung株式会社 取締役)らは、ヒトiPS細胞から分化させた肺前駆細胞を免疫不全マウスの肺へ移植して長期生着させることに成功し、さらに株式会社セルファイバ 池田和弘CTOらとの共同研究で、細胞をファイバ化する技術を用いることで、ヒトiPS細胞から分化させた肺前駆細胞を幹細胞の性質を保った状態で拡大培養できることを発見し、その細胞を免疫不全マウスの肺へ移植して生着させることにも成功しました。生着した細胞を解析すると、マウス体内で肺胞をはじめとする様々な呼吸器上皮細胞に分化していることも証明しました。本研究成果はヒトiPS細胞を用いた肺の再生医療に向けた大きな一歩であり、難治性呼吸器疾患の治療法開発に向けて今後が期待されます。
本研究成果は2021年7月20日に国際学術誌「Biomaterials」にオンライン掲載されました。
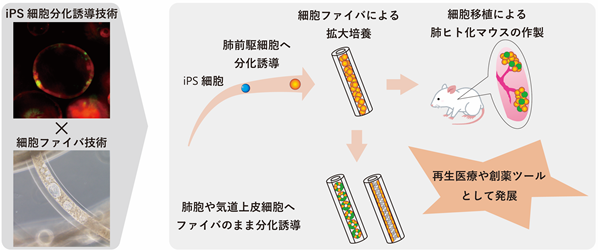
研究の概略図
背景
呼吸器疾患領域には、慢性閉塞性肺疾患や肺線維症、急性呼吸窮迫症候群など多くの難治性疾患が存在します。特に、急性呼吸窮迫症候群は極めて予後不良であり、新型コロナウイルス感染症にも合併するため、喫緊の課題とされています。外科的肺移植は呼吸器難治性疾患に対する究極的な治療法ですが、ドナー不足や拒絶反応などさまざまな課題があります。そのため、細胞治療など新たな肺再生医療の開発ニーズが高まっています。これまでに間葉系幹細胞や脂肪由来幹細胞などが細胞治療に用いられてきましたが、パラクライン作用注1を目的としたものであり、肺の再建を目的としたものではありませんでした。そして、肺の再建に必要と考えられる肺前駆細胞注2は入手だけでなく、培養による増殖や品質維持が困難であったため、再生医療での有用性はこれまで評価されていませんでした。
当研究グループはヒトiPS細胞から分化誘導した肺前駆細胞を用いて培養皿上で肺胞や気道上皮細胞注3を効率良く分化誘導する方法を報告してきましたが(参考文献1、2、3)、この肺前駆細胞が再生医療に応用可能かどうか、再生医療に十分な数の細胞数が得られるかどうか、という課題が残されていました。また近年、アルギン酸由来のハイドロゲル注4マイクロチューブの中に細胞を封入して培養できる技術(細胞ファイバ技術)が開発され、三次元組織構築やスケールアップ培養に適していることが報告されていました(参考文献4、5)。
研究手法・成果
私たちはヒトiPS細胞由来肺前駆細胞を再生医療に応用したいと考えて研究してきました。本研究では主に2つの成果を報告しています。
1.自己複製能と分化能を有したヒトiPS細胞由来肺前駆細胞の拡大培養に成功(図1)
肺前駆細胞の重要なマーカーとしてNKX2.1注5とSOX9注6が挙げられます。私たちが報告した従来法で作成された肺前駆細胞(参考文献2)ではNKX2.1の発現を認めますが、SOX9の発現は一部にとどまっていました。本研究では、多能性幹細胞からの分化誘導技術と細胞ファイバ技術を融合することで、ヒトiPS細胞から分化させた肺前駆細胞をファイバ状に拡大培養することに成功しました。この細胞ではNKX2.1の発現に加えて、9割近くの細胞がSOX9を発現していました。加えて、従来法ではマトリゲル注7という再生医療に応用することが困難な素材を使用していたのに対し、細胞ファイバ技術を使うとマトリゲルを含まなくても効率よく増殖しました。また、細胞増殖後の肺前駆細胞ファイバについて、分化誘導用の培地に変更するだけで、培養皿上で肺胞や気道上皮細胞へ分化誘導することにも成功しました。興味深いことに、肺の恒常性維持に特に重要な2型肺胞上皮細胞へ、従来法より2倍以上高い効率で分化していることもわかりました。以上より、量と質のいずれの点においても、従来法より優れた肺前駆細胞培養システムを作り上げました。
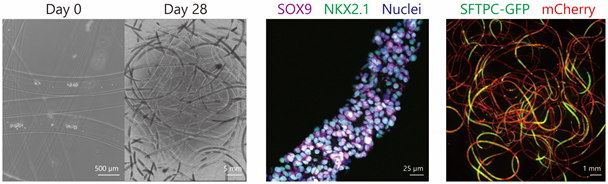
図1左:4週間培養した細胞ファイバ。中:NKX2.1とSOX9を共発現している肺前駆細胞。右:全細胞(赤色発光)のうち半分弱が2型肺胞上皮細胞(緑色発光)へ分化した細胞ファイバ。
2.ヒトiPS細胞由来肺前駆細胞のマウス肺への長期生着に成功(図2)
これまで、ヒトiPS細胞由来細胞をマウス肺に肺胞上皮細胞として生着させた報告はありませんでした。
私たちは小動物用内視鏡を用いた効率的なマウス肺への細胞投与方法を確立し、この方法を用いてナフタレン注8と放射線照射による肺障害を起こした免疫不全マウスの肺にヒトiPS細胞由来肺前駆細胞を移植し、2か月間マウス肺の肺胞領域に生着させることに成功しました。また、RNAシークエンス注9と蛍光免疫染色の2つの方法で、生着した細胞がマウス生体内で肺胞上皮細胞やクラブ細胞注10など様々な呼吸器上皮細胞へ分化していることを確認しました。そして、これまでの培養法による肺前駆細胞の生着に成功したことに加えて、先の1.で拡大培養した肺前駆細胞ファイバからゲルを溶かして細胞を取り出し、マウスへ移植・生着させることにも成功しました。
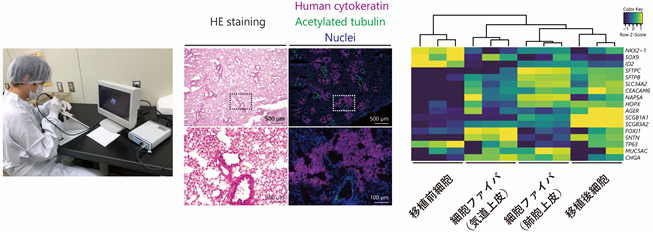
図2左:小動物用内視鏡を用いたマウスへの細胞移植システム。中:HE染色注11ではマウスの本来の肺組織と見分けがつきませんが、蛍光免疫染色ではマウス肺に生着したヒト細胞(紫色)を確認できました。移植されたヒトiPS細胞由来肺前駆細胞はマウスの肺と組織的に一体化していることがわかります。右:生着したヒト細胞を取り出してRNAシークエンスを実施し、他の細胞と比較した解析結果。投与したヒトiPS細胞由来の肺前駆細胞が、生着を経てマウス体内で肺胞や気道上皮細胞に近い細胞集団へと変化したことがわかります(右端の遺伝子リストのうち、上段3遺伝子が肺前駆細胞のマーカー、それ以下の遺伝子群が肺胞や気道上皮細胞のマーカーで、黄色くなるほど発現量が多いことを意味します)。
波及効果、今後の予定
私たちは本研究で、量と質ともに優れた細胞を得ることができる、マトリゲルを含まない肺前駆細胞の培養システムの構築と、その細胞のマウス肺移植および生着に成功し、ヒトiPS細胞を用いた肺再生医療応用への大きな一歩となりました。生着したヒト由来細胞は既存のマウス肺の細胞と置き換わっており、細胞として機能的に働いていることが期待されます。現在はまだマウス肺の上皮細胞全体の1%程度の置換率ですが、今後はさらに生着効率を高めて、マウス体内でヒトiPS細胞由来のこれらの細胞が正常に機能しているかどうか検討する予定です。引き続き、難治性呼吸器疾患の新たな治療法を確立するべく研究を進めてゆきます。
研究プロジェクトについて
本研究は、下記機関より資金的支援を受けて実施されました。
日本医療研究開発機構 再生医療実現拠点ネットワークプログラム、日本学術振興会 特別研究員奨励費・科学研究費補助金、京都大学産学共同実用化促進事業(インキュベーションプログラム)、HiLung株式会社、株式会社セルファイバ
用語説明
- 注1 パラクライン作用
- 細胞から分泌された物質が周囲の細胞や組織に作用すること。
- 注2 肺前駆細胞
- 幹細胞から呼吸器上皮細胞に分化する途中の段階にある細胞のことで、肺胞上皮細胞と気道上皮細胞の両方に分化できる細胞のこと。
- 注3 肺胞や気道上皮細胞
- 肺の中の上皮細胞は、空気の通り道となる気道にある気道上皮細胞と、通り道の終着点にある肺胞上皮細胞とに大きく二つにわかれます。肺胞上皮細胞は、1型肺胞上皮細胞という血液とのガス交換を担う細胞と2型肺胞上皮細胞という肺の恒常性を保つ役割を担う細胞にさらにわかれます。
- 注4 ハイドロゲル
- 三次元網目状構造をとる高分子の内部に水を含んだ材料。
- 注5 NKX2.1
- NK2 homeobox1の略。肺の発生初期に発現する転写因子。
- 注6 SOX9
- SRY-box9の略。肺は、肺芽と呼ばれる突起から先端部が枝分かれして伸長し、気管支や肺胞に分化してゆく。その分化過程で主に遠位端部に発現する転写因子。
- 注7 マトリゲル
- 三次元培養で頻用されるゲル状の細胞外基質の一つ。マウス肉腫から成分抽出しており、未知の成分も含まれることから、再生医療への応用は難しいとされる。
- 注8 ナフタレン
- マウスに投与することで、クラブ細胞という気道上皮細胞の一つや肺胞上皮細胞など様々な呼吸器上皮細胞に障害を引き起こす薬剤。
- 注9 RNAシークエンス
- 次世代シーケンスを用いることで、遺伝子の発現量が網羅的に解析できる方法。
- 注10 クラブ細胞
- ドーム状の分泌細胞で、気道上皮細胞の一つ。粘液酸性や気道の維持に関与している。
- 注11 HE染色
- ヘマトキシリン・エオシン染色の略。核などを青紫色に、核以外の細胞質や結合組織などを赤色に染めることで組織の構造を染め分ける、代表的な組織染色法。
参考文献
- Gotoh S, et al. (2014). Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Reports, 3(3), 394-403.
- Yamamoto Y, et al. (2017). Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nat Methods, 14(11), 1097-1106.
- Konishi S, et al (2016). Directed induction of functional multi-ciliated cells in proximal airway epithelial spheroids from human pluripotent stem cells. Stem Cell Reports, 6(1), 18-25.
- Onoe H, et al. (2013). Metre-long cell-laden microfibres exhibit tissue morphologies and functions. Nat Materials, 12(6), 584-590.
- Ikeda K, et al. (2017). Cell fiber-based three-dimensional culture system for highly efficient expansion of human induced pluripotent stem cells. Scientific Reports, 7(1), 2850.
論文タイトルと著者
- タイトル
- Core-shell hydrogel microfiber-expanded pluripotent stem cell-derived lung progenitors applicable to lung reconstruction in vivo(コアシェル型ハイドロゲルマイクロファイバーを用いた多能性幹細胞由来肺前駆細胞の拡大培養および生体内における肺再構築への応用)
- 著 者
- Satoshi Ikeo, Yuki Yamamoto, Kazuhiro Ikeda, Naoyuki Sone, Yohei Korogi, Lucia Tomiyama, Hisako Matsumoto, Toyohiro Hirai, Masatoshi Hagiwara, Shimpei Gotoh
- 掲載誌
- Biomaterials
- DOI
- 10.1016/j.biomaterials.2021.121031
お問い合わせ先
研究に関するお問い合わせ先
後藤 慎平(ごとう しんぺい)
国立大学法人京都大学大学院医学研究科 呼吸器疾患創薬講座・呼吸器内科学 特定准教授
報道・取材に関するお問い合わせ
国立大学法人京都大学 総務部広報課国際広報室
HiLung株式会社に関する問い合わせ先
HiLung株式会社 事業開発部
株式会社セルファイバに関する問い合わせ先
株式会社セルファイバ
AMED事業に関する問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
再生医療実現拠点ネットワークプログラム