2021-06-09 自治医科大学,日本医療研究開発機構
発表者
大貫良幸(自治医科大学 脳神経外科学講座)
村松慎一(自治医科大学 神経遺伝子治療部門)
山形崇倫(自治医科大学 小児科学講座)
発表のポイント
- ポジトロン断層法画像と拡散テンソル画像を用いて、芳香族lアミノ酸脱炭酸酵(AADC)欠損症の遺伝子治療の脳内機構を解析しました。
- 遺伝子導入された被殻領域は、運動の遂行を担う一次運動野だけでなく、運動の計画を担う前頭前野とも結合していることが明らかになりました。
- 遺伝子導入された被殻において、前頭前野と結合する領域が運動機能の回復と関係があることを示しました。
発表概要
芳香族lアミノ酸脱炭酸酵素(aromatic l-amino acid decarboxylase, AADC)※1はドパミンやセロトニンの合成に必要な酵素です。ドパミンは被殻※2で運動機能の調整を行う機能を担っています。AADC欠損症※3は、AADC遺伝子の変異により、ドパミンを介した被殻の神経機能が障害される遺伝性の希少疾患であり、世界で140例程度診断されています。
この疾患の治療として、自治医科大学の研究グループは、AADC遺伝子を発現するアデノ随伴ウイルス(AAV)ベクター※4を被殻に注入することにより、被殻におけるドパミンの産生を回復する遺伝子治療※5を開発してきました。この遺伝子治療によって、認知機能と運動機能が改善し、ジストニア※6が消失することが確認されています。自治医科大学を含め、これまで国内外でこの遺伝子治療の効果が報告されてきました(Chien et al., 2017, Lancet Child Adlesc Health; Kojima et al., 2019, Brain)が、治療効果発現の詳細な機構は未解明でした。
自治医科大学の大貫良幸(脳神経外科学講座)、村松慎一(神経遺伝子治療部門)、山形崇倫(小児科学講座)らの研究グループは、遺伝子治療を行った国内外の8人の患者(重症型7人、中間型1人)に対して、AADCの基質である6-[18F]fluoro-l-m-tyrosine(FMT)をトレーサーとした高解像度ポジトロン断層画像(PET)と、神経線維を可視化する拡散テンソル画像(DTI)を用いて、遺伝子治療前後の被殻内のFMTの集積、および大脳皮質の各領域と被殻の構造的結合性を基に区分けした被殻領域を解析しました。その結果、FMT高集積を示した被殻領域は、これまで予想されていた運動遂行機能を担う一次運動野と結合しているだけでなく、運動計画機能を担う前頭前野にも結合していることが明らかになりました。本研究成果から得られた知見によって、今後、運動機能障害を呈する他の疾患においても治療法の開発へ繋がることが期待されます。本研究成果は、2021年4月14日に英国科学雑誌「Brain Communications」のオンライン版で公開されました。
発表内容
自治医科大学 小児科学講座教授 山形崇倫と神経遺伝子治療部門教授 村松慎一らの研究グループは、国立研究所開発法人 日本医療研究開発機構(AMED)の難治性疾患実用化研究事業「AADC欠損症等の小児神経疾患に対する遺伝子治療開発」(2019年終了)において、難治性小児神経疾患であるAADC欠損症患者にアデノ随伴ウイルス(AAV)ベクターを用いた遺伝子治療を2015年より実施してきました(図1A)。これまでに治療を受けた患者では、全例で運動機能と認知機能が改善し、ジストニアが消失しています(Kojima et al., 2019, Brain)。これらの結果は運動システムの機能的回復を示していますが、この遺伝子治療の効果発現機構の詳細は未解明でした。
複雑な運動を行う際には、大脳皮質のうち運動の計画を担う前頭前野(Prefrontal cortex)から出力された信号が、運動前野(Premotor cortex)、補足運動野(Supplementary motor area)を経て、運動の実行を担う一次運動野(Primary motor cortex)に伝達されると考えられています。一方、大脳皮質は皮質同士の結合性により、複数の皮質ネットワークに分類され、それぞれのネットワークが大脳基底核と機能的に連携していることが知られています。大脳基底核のなかで、被殻は大脳皮質から最初に入力を受ける部位であり、この入力の調整をドパミンが担っています。また、被殻は大脳皮質の領域毎に入力を受ける領域が異なる部位特異性という特徴があります。
これらの知見に基づき、遺伝子治療を実施したAADC欠損症の患者(重症型7人、中間型1人)に対して、AADCの基質である6-[18F]fluoro-l-m-tyrosine(FMT)をトレーサーとした高解像度ポジトロン断層画像(PET)と拡散テンソル画像(DTI)を計測しました。遺伝子治療前後の被殻内のFMT集積を調べ、FMT高集積を示す被殻領域を同定しました。さらに、拡散テンソル画像解析による各皮質領域と被殻との構造的結合性(structural connectivity)を基にして、FMT高集積を示す被殻領域を区分けしました。
その結果、治療前は著しく低下していた被殻のFMT集積が、治療後に幅広い被殻領域で増加し、2年経過後も維持されていることが判明しました(図1B)。これは被殻の特定の領域に高濃度のドパミンが生成されていることを反映していると考えられます。さらに、この高濃度のドパミンの生成を示す被殻の領域は、運動機能に関わる前頭前野、運動前野、一次運動野と結合していることが明らかになりました。特に前頭前野と結合している被殻領域の体積は、遺伝子治療6か月後の運動機能の回復と関係(正の相関関係)があることが認められました。また、この前頭前野は運動の計画に関与する前頭-頭頂ネットワーク(frontoparietal control network)と呼ばれる皮質ネットワークに属していることも明らかになりました(図1C)。
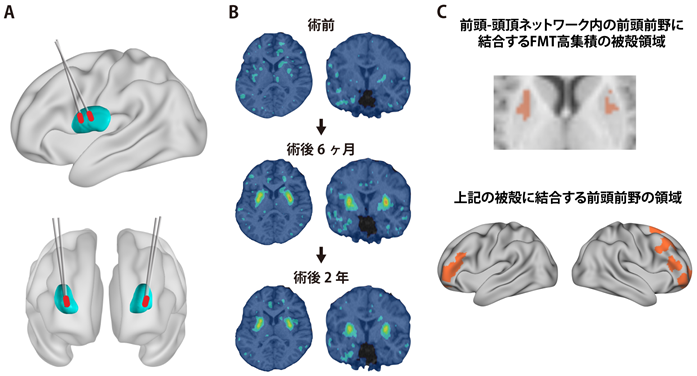
図1 AADC欠損症の遺伝子治療により遺伝子導入された被殻領域とそれに結合する大脳皮質領域A.被殻にベクターを注入する定位脳手術。B.遺伝子治療前後のFMT-PET画像。C.運動機能回復と相関のあったFMT高集積の被殻領域とそれに結合する前頭前野領域。
これまで、パーキンソン病などの知見から、運動遂行機能を担う一次運動野と結合する被殻領域内のドパミンの回復がAADC欠損症に対する遺伝子治療の主要な効果発現機構と考えられてきました。本研究により、一次運動野だけでなく、運動計画機能を担う前頭前野と結合する被殻領域内のドパミンの回復も運動機能回復に重要であることが明らかになりました(図2)。
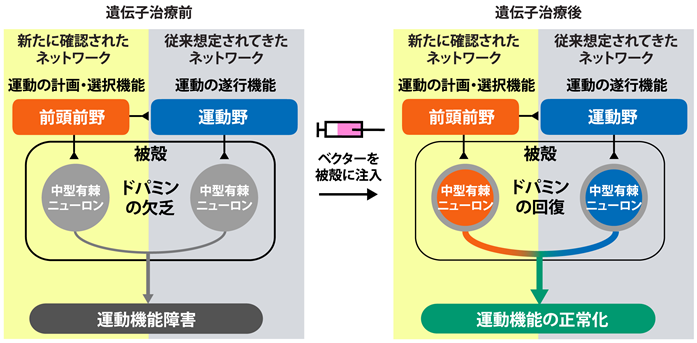
図2 遺伝子治療により機能回復する大脳皮質と被殻のネットワーク
本研究により、AADC欠損症の運動機能回復の効果発現機構の一端が明らかになったことで、運動機能障害を呈する疾患の新たな治療法の確立へ貢献することが期待されます。
発表雑誌
- 雑誌名
- Brain Communications
- 論文タイトル
- Dopaminergic restoration of prefrontal cortico-putaminal network in gene therapy for aromatic l-amino acid decarboxylase deficiency
- 著者
- Yoshiyuki Onuki, Sayaka Ono, Takeshi Nakajima, Karin Kojima, Naoyuki Taga, Takahiro Ikeda, Mari Kuwajima, Yoshie Kurokawa, Mitsuhiro Kato, Kensuke Kawai, Hitoshi Osaka, Toshihiko Sato, Shin-ichi Muramatsu, Takanori Yamagata
- DOI番号
- 10.1093/braincomms/fcab078
用語解説
- ※1 AADC
- 芳香族lアミノ酸脱炭酸酵素 aromatic l-amino acid decarboxylaseの略。中枢神経で、l-ドーパをドパミンに、5-HT(hydroxytryptophan)をセロトニンへ変化させる酵素。
- ※2 被殻
- 脳深部にある大脳基底核は随意運動の調節や、姿勢、筋肉の緊張を調整するなど、様々な運動機能を司り、また、認知機能、感情、眼球運動の制御にも関わる。大脳基底核は線条体・淡蒼球・黒質・視床下核からなる。被殻は尾状核とともに線条体を構成し、主に運動系機能を司る。
- ※3 AADC欠損症
- AADCをコードするDDC遺伝子(AADC遺伝子)の変異で発症する遺伝疾患。AADCの働きが低下するため、ドパミンやセロトニンの産生が顕著に低下する。ドパミンから産生されるエピネフリン・ノルエピネフリン、セロトニンから産生されるメラトニンも低下する。これらの重要な神経伝達物質が低下するために、神経発達が遅れ、運動機能障害、知的障害、自律神経機能障害(発汗過多、血圧低下、低血糖など)、精神的な不安定さ、睡眠障害などの症状が見られる。
- ※4 AAVベクター
- 病原性のないアデノ随伴ウィルス(Adeno-associated virus:AAV)に、正常な遺伝子を組み込み、細胞内に遺伝子を導入する運び屋(ベクター)としたもの。
- ※5 遺伝子治療
- 患者の細胞に遺伝子を導入することにより病気を治療する方法。AADC欠損症の遺伝子治療は、機能が低下しているAADC遺伝子の代わりに正常に働くヒトAADC遺伝子を直接患者の体内(脳内)に入れる方法(in vivo遺伝子治療)を行なっている。
- ※6 ジストニア
- 筋肉が異常に収縮してしまう不随意運動で、大脳基底核を含むネットワークの障害が考えられている。
お問い合わせ先
研究内容に関するお問い合せ先
自治医科大学脳神経外科
助教 大貫良幸(おおぬきよしゆき)
自治医科大学 オープンイノベーションセンター 神経遺伝子治療部門
特命教授 村松慎一(むらまつしんいち)
自治医科大学 小児科学講座
教授 山形崇倫
AMEDの事業についてのお問い合せ先
国立研究開発法人日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 遺伝子治療研究開発課
難治性疾患実用化研究事業 担当