副作用の少ないβアドレナリン受容体標的薬の創製に貢献へ
2021-07-27 東京大学
名切 千彩恵(研究当時:生物科学専攻 修士課程2年)
小林 和弘(生物科学専攻 博士課程2年)
富田 篤弘(生物科学専攻 博士課程3年)
加藤 雅彦(生物科学専攻 修士課程1年)
西澤 知宏(研究当時:生物科学専攻 准教授)
井上 飛鳥(東北大学大学院薬学研究科 准教授)
志甫谷 渉(生物科学専攻 助教)
濡木 理(生物科学専攻 教授)
発表のポイント
- 重要な薬の標的分子である3種類のβアドレナリン受容体(注1) のうち、構造が未解明だったβ3受容体と過活動膀胱治療薬ミラべグロンとの複合体の立体構造を明らかにしました。
- β3受容体の薬剤結合ポケットはほかのβアドレナリン受容体よりも狭く、ミラべグロンは狭いポケットにはまり込むことでβ3受容体選択的に結合できることがわかました。
- 本研究によって全てのβアドレナリン受容体の立体構造が可視化されたことにより、副作用の少ないβアドレナリン受容体標的薬の開発が加速すると考えらえます。
発表概要
アドレナリンは、Gタンパク質共役受容体 (GPCR) (注2) であるβアドレナリン受容体を活性化することで交感神経を刺激して、心拍数や血圧を上昇させます。βアドレナリン受容体にはβ1-3の3種類が存在しており、β1やβ2を標的とした薬剤は心臓病や喘息の代表的な薬になっています。一方、β3受容体は、脂肪細胞に多く発現しており熱産生や脂肪分解を担っています。β3受容体の遺伝子の多型は基礎代謝を下げ太りやすくなるため、倹約遺伝子(注3) として知られています。また、β3受容体は膀胱の平滑筋弛緩に関与しており、β3受容体選択的刺激薬であるミラベグロン(製品名ベニダス)が過活動膀胱(注4) の治療薬になっています。β1-3受容体は異なる生理作用を示すため、薬剤の各受容体への選択性が副作用の低減に重要です。これまでβ1やβ2受容体の研究は進んでおり、原子レベルの構造もたくさん解明されて、薬の作用機序がわかっていました。しかし、β3受容体の立体構造だけは未解明であり、β受容体刺激薬の選択性への理解は限られたものでした。
今回、東京大学大学院理学系研究科の濡木教授らのグループは、東北大学大学院薬学研究科の井上飛鳥准教授と共同研究のもと、クライオ電子顕微鏡(注5) を用いた単粒子解析によって過活動膀胱治療薬ミラべグロンが結合した β3受容体の立体構造を決定しました。構造中では、ミラベグロンは細長い形をしており、β3受容体の薬剤結合ポケットの中に垂直に収まっており、ミラべグロンとβ3受容体の相互作用の詳細を可視化しました。β3受容体の薬剤結合ポケットの入口はβ1やβ2受容体と比べて狭く、ポケット全体が直線的な形であることがわかりました。こうしたポケットの形の違いが、ミラべグロンのβ3受容体選択性に重要であることを明らかにしました。全てのβアドレナリン受容体の立体構造が明らかになったことで、各受容体への選択性をより高めた、副作用の少ないβアドレナリン受容体標的薬の創製が期待されます。
本研究成果は、日本時間2021年7月27日に米国科学雑誌「Molecular Cell」に掲載されました。
発表内容
研究の背景
アドレナリンは、「闘争か逃走か」という人の本能を司るホルモンであり、交感神経を刺激して心拍数や血圧を上昇させます。アドレナリンは、GPCRであるβアドレナリン受容体を活性化することで興奮作用を発揮します。βアドレナリン受容体にはβ1-3の3種類が存在しており、生理的な役割が大きく異なります(図1)。
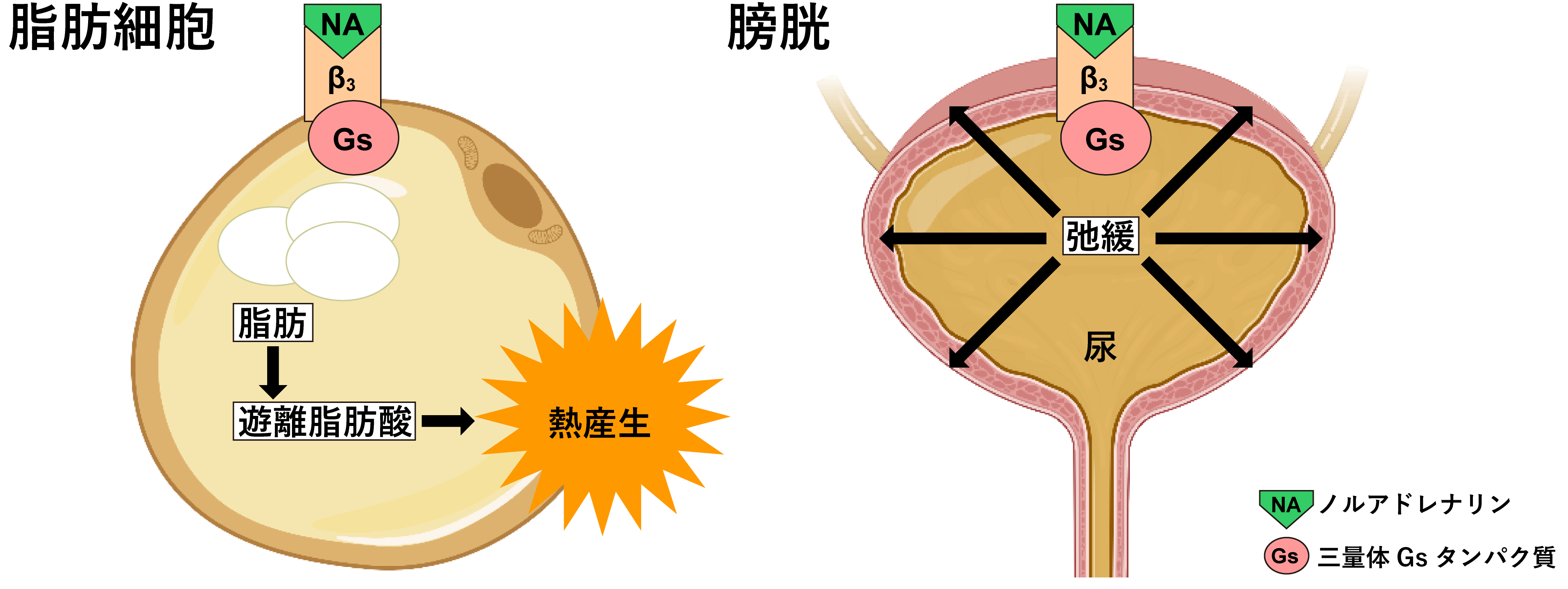
図1:β3受容体の代表的な機能
β1受容体は心筋に発現して心拍数を制御しており、β1受容体を阻害し心拍数や血圧を下げるβ1遮断薬は心不全の治療薬です。一方、β2受容体は血管や気管支の平滑筋弛緩に関与しており、β2刺激薬は気管支喘息の代表的な治療薬です。β1およびβ2受容体は最初期に発見されたGPCRであり、GPCR研究のファーストランナーとして研究分野を盛り上げてきました。受容体の原子レベルの立体構造もホルモン受容体として初めて解明され、薬剤の結合様式や受容体の動作原理について最も理解が進んでいます。βアドレナリン受容体の研究は2012年のノーベル化学賞(注6)の対象になっています。
β3受容体は最後に同定されたβアドレナリン受容体であり、β1やβ2受容体とは機能が異なっています。β3受容体はノルアドレナリンによって活性化され、下流のシグナルを活性化することで生理作用を発揮します。β3受容体は脂肪細胞に多く発現しており、熱産生や脂肪分解を担っています(図1)。β3受容体の遺伝子には多型(1箇所のアミノ酸残基の置換)が存在し、倹約遺伝子として知られる多型のβ3受容体は機能が低下し、これを有するヒトは基礎代謝料が平均150 kcal少なくなります。日本人の3人に1人はこの倹約型変異をもっており、痩せにくく、飽食の現代では糖尿病や肥満のリスク因子になっています。このことから、β3受容体刺激薬は肥満や糖尿病の薬として研究されてきました。また、β3受容体は消化器官の平滑筋弛緩に関与しており、特に膀胱に多く発現しています(図1)。β3受容体の活性化は膀胱を緩めて尿排出を抑制できるため、アステラス製薬が開発したβ3受容体選択的刺激薬であるミラベグロン(製品名ベニダス)が過活動膀胱の治療薬になっています。
このように、β1-3は異なる生理作用を示すため、薬剤の各受容体への選択性が副作用の低減に重要です。実際に、ミラベグロンはβ1受容体の直接的または間接的な活性化によって心拍数を上昇させるため、重篤な心疾患を有する患者には禁忌とされています。β1-3の選択性の理解のためには、選択的薬剤がどのように受容体に結合しているか可視化する必要があります。β1やβ2受容体の構造が明らかになってから13年間、β3受容体の立体構造だけは未解明でした。そのため、β受容体刺激薬の選択性への理解も限られたものでした。
研究の内容と成果
本研究グループは、最初にヒト由来β3受容体の構造解析を試みましたが、精製することができず解析困難でした。さまざまな検討の結果、イヌ由来β3受容体が安定で構造解析に最適であることを見出しました。クライオ電子顕微鏡を用いた単粒子解析によって、ミラベグロン、イヌ由来β3受容体、三量体Gsタンパク質からなるシグナル伝達複合体の立体構造を決定しました(図2)。これにより、ミラベグロンの結合様式や活性化した受容体によるシグナル伝達メカニズムを解明しました。
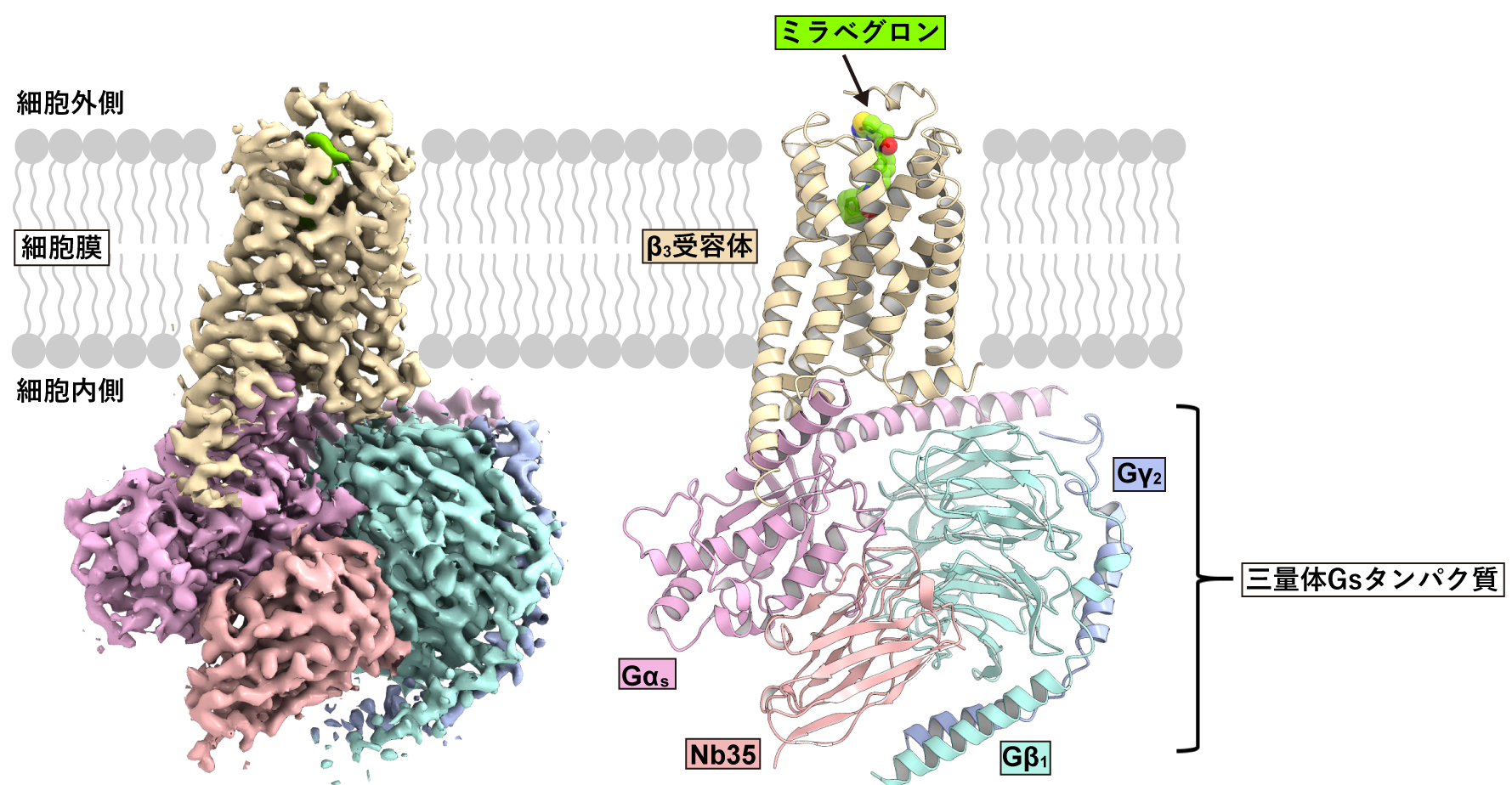
図2:β3アドレナリン受容体のシグナル伝達複合体の全体構造
左が単粒子解析によって得られた密度マップ。右が密度マップに基づいてモデリングしたシグナル伝達複合体の立体構造。
ミラベグロンは、ノルアドレナリンを模した部分と以外の部分からなる薬剤です(図3左)。ミラベグロンは細長い形で、β3受容体の薬剤結合ポケットの中に垂直に収まっていました(図3右)。ミラベグロンのノルアドレナリンを模した部分は、ノルアドレナリン結合部位と相互作用している一方で、尾部は結合ポケットの細胞外側のポケット入口と相互作用していました。合計で17のアミノ酸残基がミラベグロンと相互作用しており、1つのアミノ酸残基を除いてヒトとイヌのβ3受容体の間で保存されていました。これらの事実から、ミラベグロンがヒトのβ3受容体にも同様に結合することが予想されました。
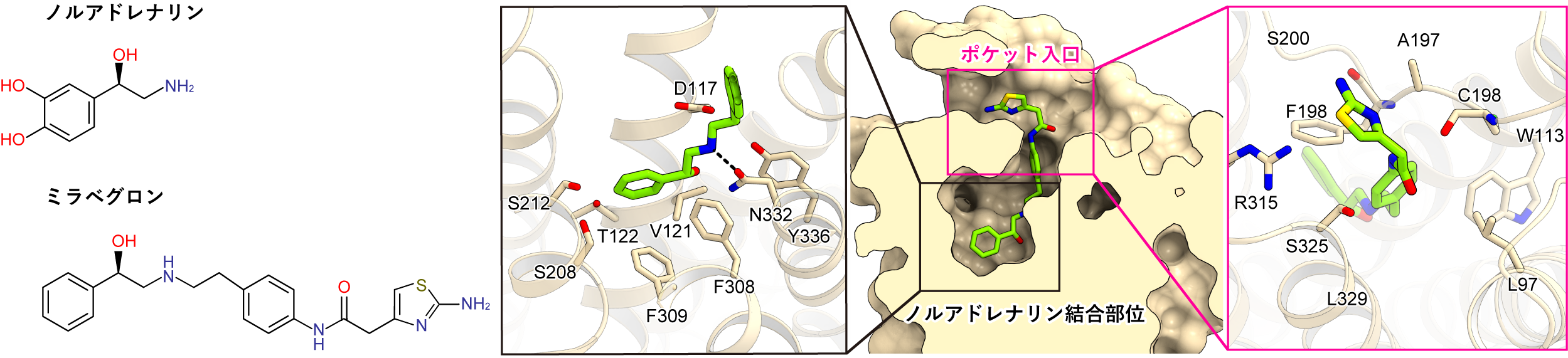
図3:ミラベグロンの結合様式
(左)ミラベグロンの化学構造、(右)ミラベグロン結合ポケットの断面図と相互作用。
次に、ミラベグロンがβ3受容体を選択的に活性化できる理由を調べるために、β3受容体とβ1受容体やβ2受容体の構造と比較しました(図4)。ノルアドレナリン結合部位を形づくるアミノ酸残基はβ受容体間で保存されており、薬剤の結合様式も似ていました。対照的に、ポケットの入口を形づくるアミノ酸残基は保存性が低く、入口の形が大きく異なっていました。β1やβ2受容体の薬剤結合ポケットは開いた構造をしており、選択的薬剤の尾部はミラベグロンとは異なった形で相互作用しています。対して、細胞外側に面したβ3受容体のポケット入口はβ1やβ2受容体よりも狭い形になっていました。ミラベグロンはβ3受容体の狭い薬剤結合ポケットはまり込むことで高い親和性で結合でき、入口が開いているβ1やβ2受容体には上手く結合できません。逆に、β1やβ2選択的刺激薬では狭いβ3受容体の薬剤結合ポケットと立体障害を起こします。このように、β3受容体では薬剤結合ポケットの入口が狭いことが、ミラベグロンのβ3受容体選択性を生み出していると考えられました。
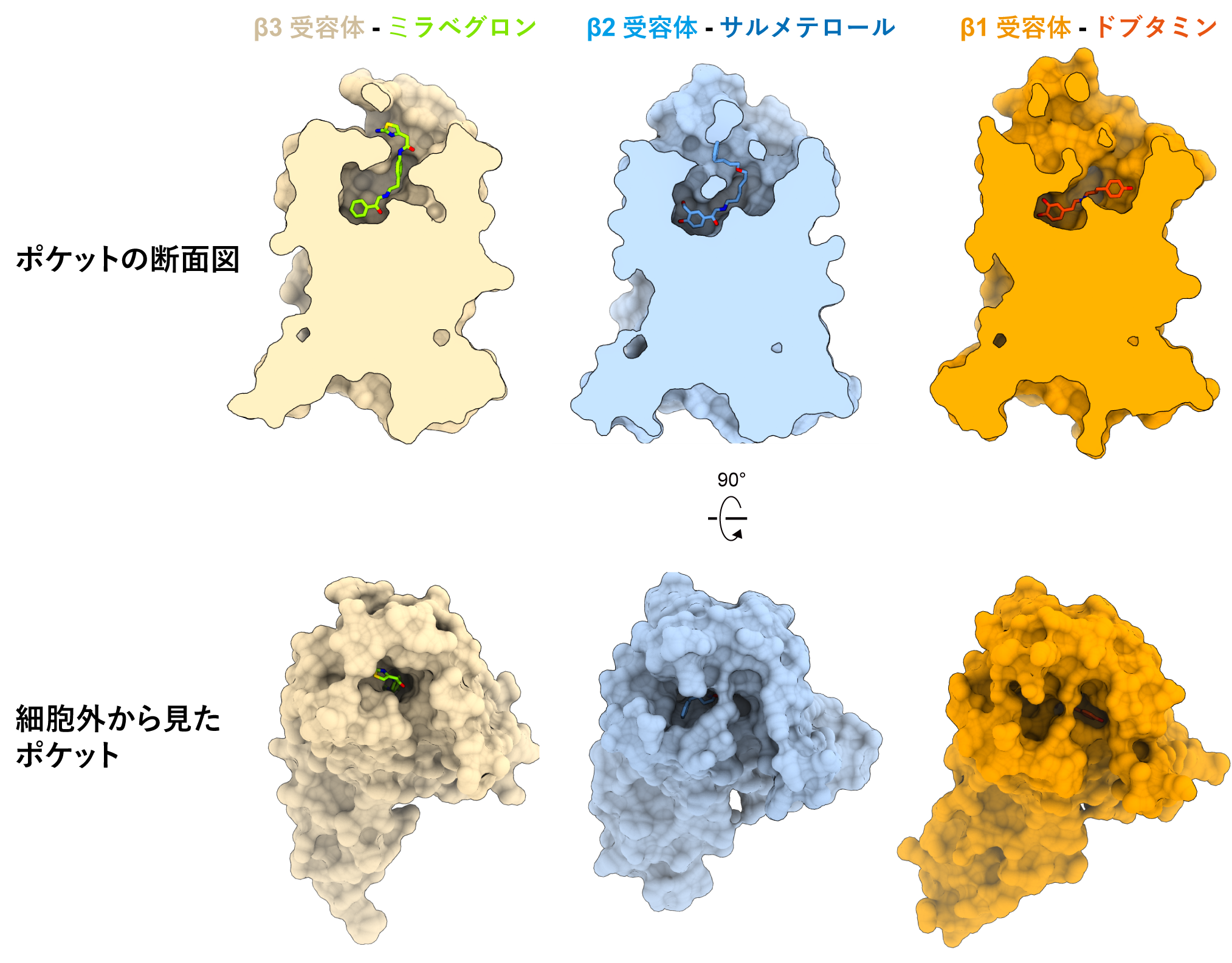
図4:βアドレナリン受容体の構造比較
β1、β2、β3受容体とそれぞれ受容体選択的な薬剤が結合した構造を比較している。
本研究は、日本学術振興会における科学研究費助成事業の特別推進研究「物理刺激で制御される膜蛋白質の分子機構の解明」(課題番号:16H06294 研究開発代表者:濡木理)や公益財団法人 上原記念生命科学財団 研究助成金「β3アドレナリン受容体の単粒子解析」(研究代表者:志甫谷 渉)、および国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業ソロタイプ「リガンドが不要な革新的GPCRツールを用いた脂質関連オーファン受容体の機能解明」(課題番号:19gm5910013 研究開発代表者:井上飛鳥)の一環で行われました。また、本研究は、AMED「創薬等ライフサイエンス研究支援基盤事業」および「革新的先端研究開発支援事業インキュベートタイプ」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。
今後の展望
本研究は、薬剤がβ3受容体の狭い薬剤結合ポケットに上手くはまることで、β3受容体選択性を実現していることを示しています。構造情報を元にβ3受容体選択性をより高めた薬剤が開発され、副作用の少ない過活動膀胱治療薬や、さらには肥満・糖尿病の治療薬の開発が期待されます。また、アドレナリン受容体の構造が全て明らかになったことで、アドレナリン受容体を標的とした創薬全体の活性化が期待されます。
発表雑誌
- 雑誌名Molecular Cell論文タイトルCryo-EM structure of the β3 adrenergic receptor reveals the molecular basis of subtype selectivity .著者Chisae Nagiri, Kazuhiro Kobayashi, Atsuhiro Tomita, Masahiko Kato, Kan Kobayashi, Keitaro Yamashita, Tomohiro Nishizawa, Asuka Inoue*, Wataru Shihoya*, Osamu Nureki*.DOI番号 https://doi.org/10.1016/j.molcel.2021.06.024
用語解説
注1 アドレナリン受容体
主に心筋や平滑筋に存在し、脳や脂肪細胞にもある。アドレナリン受容体は現在α1、α2、βの3種類と、更に3つずつのサブタイプに分類されている。
注2 Gタンパク質共役受容体(GPCR)
細胞膜に存在する代表的な受容体タンパク質であり、細胞外部分でシグナル分子と結合すると、細胞内部分の構造が変わり、三量体Gタンパク質を活性化する。ヒトではおよそ800種類のGPCRが存在しており、さまざまな生命現象に関わっていることから、重要な薬剤ターゲットとなっている。
注3 倹約遺伝子
人類が飢餓と戦ってきた中で生まれてきた、エネルギーを効率よく脂肪に蓄えるための遺伝子変異。倹約遺伝子を持っている人は、持っていない人に比べて日常生活で使うエネルギーが少ないために、飢餓の時代でも生き残ることができ、生存に有利だった。しかし、飽食と運動不足が慢性化している現代社会では、脂肪がつきやすく肥満や糖尿病のリスク因子である。40種類存在している中で、β3受容体の変異はもっとも代表的な倹約遺伝子であり、遺伝子検査の判断に基準にもなっている。人種間で倹約型変異の比率が大きく異なり、肥満や糖尿病のリスクが相関している。言うまでもないが、遺伝的背景だけではなく、肥満や糖尿病には生活習慣が大きなリスクである。
注4 過活動膀胱
過活動膀胱は、尿が十分たまっていなくても膀胱が自分の意思とは無関係に収縮する病気である。排尿トラブルの1つであり、頻尿や尿意切迫感といった症状が表れる。発症メカニズムの詳しいメカニズムはわかってないが、神経を通じた脳と尿道、膀胱の筋肉のやりとりが上手くいかなくなることが原因と考えられている、高齢になるほど増加し、過活動膀胱の患者は日本で800万人といわれている。
注5 クライオ電子顕微鏡
液体窒素(-196℃)冷却下でタンパク質などの生体分子に対して電子線を照射し、試料の観察を行うための装置。タンパク質の立体構造を高分解能で決定する手法として、検出器などにおいて目覚ましい技術革新を遂げており、2017年に、その開発に貢献した海外の研究者三名にノーベル化学賞が贈られた 。
注6 2012年のノーベル化学賞
2012年のノーベル化学賞は、ロバート・レフコビッツ氏とブライアン・コビルカ氏に「for studies of G-protein-coupled receptors (GPCRに関する研究)」というタイトルで贈られた。レフコビッツ氏はβアドレナリン受容体を単離し、作用機構の解明、コードする遺伝子の同定した。この遺伝子は体内各所に存在する受容体の遺伝子配列と酷似しており、この解明をきっかけとして、身体の中で別の場所にあるはずの受容体が、同じような構造・機構で働いているGPCRであるという理解が広がった。ブライアン・コビルカ氏はレフコビッツ氏のグループでアドレナリン受容体の研究に携わったのち、立体構造情報の解析に取り組んだ。氏は20年近い年月の上、ホルモンを受容するGPCRとして初めてβ2受容体の構造を決定した。2011年には本研究と同様のGタンパク質との複合体構造が報告され、アドレナリンによる受容体活性化機構の詳細が明らかになった。